小反刍兽疫病毒非结构蛋白C和V基因突变的克隆与表达
和伟程,石晓玲,李 菊,张潇文,刘方程,李琼毅,柏家林,*
(1.西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室, 甘肃 兰州 730030;2.西北民族大学生命科学与工程学院;3.甘肃省医学科学研究院)
小反刍兽疫 (PPR)是由小反刍兽疫病毒 (PPRV)引起的一种急性、主要感染小反刍动物绵、山羊的传染病。PPR因其发病率、死亡率高,给养羊业带来严重危害。PPRV属于副粘病毒科、麻疹病毒属病毒,已被列入世界动物卫生组织应报告的陆生动物疾病清单。根据国际病毒分类学委员会的最新病毒分类法,该病毒已更名为小反刍动物麻疹病毒 (SRMV)。麻疹病毒属病毒有麻疹病毒(MeV)、牛瘟病毒(RPV)、小反刍兽疫病毒(PPRV)、犬瘟热病毒(CDV)、海豹瘟热病毒(PDV)、鲸类动物麻疹病毒(CeMV)和猫科动物麻疹病毒(FMV)7个成员,都有相似的基因组成。PPRV呈球形,有包膜,直径为150~700 nm,病毒基因组约为16 kb的单股负链RNA。基因组从5'-3' 端由N、P、M、F、H和L 6个基因组成,分别编码N、P、M、F、H和L 6个结构蛋白,参与构成病毒粒子。此外,P基因还额外编码两个非结构蛋白C和V,在病毒诱导宿主免疫功能抑制与疾病发生中起重要作用。也有研究表明非结构蛋白还与病毒毒力有。
C蛋白和V蛋白是P基因的产物,通过RNA编辑从P蛋白转录单元中获得,C蛋白分子量约20 kD,不发生磷酸化修饰。前期同属病毒相关研究表明C蛋白与L蛋白可在高分子量聚集体中相互结合,促进病毒RNA的合成,敲除C基因的重组麻疹病毒 (MV)不会在感染动物中繁殖。但由于V和C缺陷病毒都能诱导高水平的中和抗体和强烈的细胞免疫应答,它们可以为免疫缺陷个体开发合适的疫苗。V蛋白分子量约32 kD,V蛋白需要磷酸化修饰,敲除V基因的MV可导致病毒RNA合成受阻和病毒效价降低,从而影响病毒毒力。研究表明C、V蛋白均参与I型干扰素应答的初始阶段,缺失C蛋白的重组MV在具有完整I型干扰素系统的细胞中复制缓慢,且突变型毒株感染细胞后I型干扰素的表达量显著高于野生型,C蛋白缺失的仙台病毒 (SeV)在感染期间可产生更多的双链核糖核酸(dsRNA),进而激活IFN-β启动子的转录促进IFN-β的产生。反之,野生型病毒不产生dsRNA,对IFN-β的产生有抑制作用,但PPRV C蛋白在IFN-β诱导中的作用机制仍需进一步探究。副粘病毒V蛋白能通过结合黑色素瘤分化相关蛋白5(MDA-5)或视黄酸诱导基因I (RIG-I)抑制IFN-β启动子的激活。PPRV V蛋白N端的110位酪氨酸能阻断转录激活子1 (STAT1)的磷酸化并阻止其进入细胞核,在阻断IFN-β诱导的STAT1的活化中发挥重要作用,富含半胱氨酸的C端可以通过结合κB激酶a抑制剂 (IKKα)抑制IRF7的活性从而下调IFN-β的产生。
迄今为止,小反刍兽疫病毒非结构蛋白C和V的研究相对较少,为进一步研究其功能,本研究运用PCR技术克隆了点突变的C和V基因,构建了两种突变基因真核表达载体p3Flag-CMV-14-ΔC和p3Flag-CMV-14-ΔV,通过重组质粒转染HEK-293T细胞检测了突变基因的表达,为进一步C蛋白和V蛋白的功能提供了科学依据。
1 材料和方法
1.1 材料
人胚胎肾细胞(HEK-293T)由甘肃省动物细胞技术创新中心提供;HEK-293T和Vero细胞在含10%胎牛血清的DMEM培养基中于37℃、5% CO2条件下培养;质粒p3Flag-CMV-14-C、p3Flag-CMV-14-V及p3Flag-CMV-14由西北民族大学生物医学研究中心提供。
1.2 试剂
Ex Taq DNA 聚合酶、Hind III、EcoR I、Kpn I购自大连宝生物公司;T4 DNA连接酶购自NEB公司;RNA提取试剂盒购自北京天根生物科技有限公司;质粒提取试剂盒购自广州美基生物科技有限公司;凝胶回收试剂盒购自北京全式金生物技术有限公司;抗Flag标签抗体,抗β-actin抗体,山羊抗鼠抗体购自Sigma公司;胎牛血清、新生牛血清购自北京赛澳美细胞技术有限公司;DMEM培养基购自兰州民海生物工程有限公司;Power up SYBR Green master mix购自Applied Biosystems公司;Lipofectamine 2000购自Invitrogen公司,Pierce增强ECL蛋白印迹化学发光底物购自ThermoFisher Scientific公司。
1.3 PPRV病毒突变基因扩增
根据GeneBank登录的PPRV Nigeria 75/1 C和V基因序列 (序列号为ADX95992.1和ADX95991),设计C基因和V基因qPCR引物 (表1)。参照报道设计突变基因ΔC和ΔV的PCR引物序列,ΔC基因5’端引入Hind III酶切位点,3'引入Kpn I酶切位点;ΔV基因5'引入Hind III酶切位点,3'端引入EcoR I酶切位点(表1)。ΔC基因:起始密码子AUG突变为ACG,并在氨基酸序列的第9位、第12位引入终止密码子(图1A)。ΔV基因:在氨基酸序列的第7位、第285位、第294位引入三个终止密码子(图1B)。以p3Flag-CMV-14-C和p3Flag-CMV-14-V质粒DNA为模板扩增ΔC和ΔV基因。引物由生工生物工程 (上海)有限公司合成。以p3Flag-CMV-14-C、p3Flag-CMV-14-V质粒为模板扩增ΔC和ΔV基因,PCR反应体系为50 μL:Ex Taq Buffer 5 μL,Ex Taq 0.5 μL,dNTP Mixture 4 μL,上下游引物各 1 μL,模板 2 μL,补加 ddH2O 至 50 μL。PCR反应程序:35 个循环,98 ℃ 5 min ,95 ℃ 1 min,55 ℃ 30 s,72 ℃ 45 s,72 ℃ 1 min。配制1.2%的核酸胶,并进行胶回收。

表1 PCR和qPCR引物的核苷酸序列

图1 PPRV病毒ΔC基因 (A)和ΔV(B)基因突变策略
1.4 突变基因重组表达载体构建
用Hind III和Kpn I,Hind III和EcoR I 分别双酶切p3Flag-CMV-14和ΔC,p3Flag-CMV-14和ΔV基因片段,T4DNA连接酶将目的基因连于载体上,构建重组表达载体p3Flag-CMV-14-ΔC和p3Flag-CMV-14-ΔV,进行双酶切和测序验证。
1.5 突变基因的表达
1.5.1 重组质粒转染HEK-293T细胞 将HEK-293T细胞 (2×105)接种于含10%胎牛血清DMEM培养基的6孔培养板中,37 ℃、5% CO2培养至70%~90%汇合时,按Lipofectamine 2000转染试剂盒操作说明书每孔分别转染p3Flag-CMV-14-ΔC (2.5 μg)、p3Flag-CMV-14-ΔV (2.5 μg)、p3Flag-CMV-14-C (2.5 μg)、p3Flag-CMV-14-V (2.5 μg)和p3Flag-CMV-14 (2.5 μg)。转染后24 h收集细胞,分别提取RNA和蛋白质进行RT-qPCR和Western blot检测。
1.5.2 实时荧光定量PCR(RT-qPCR) 使用RNA提取试剂盒提取质粒转染细胞总RNA,反转录合成cDNA。按照实时荧光定量PCR试剂盒操作说明进行ΔC和ΔV基因表达测定。qPCR反应体积20 μL:Power up SYBR Green master mix 10 μL,上、下游引物各1 μL,cDNA 2 μL, ddH2O 6 μL。反应条件为:95℃、30 s,95℃、5 s,60℃、34 s,72℃、1 min,40个循环,在荧光定量PCR仪(Life Technologies Holdings Pte Ltd, The United States of America)进行扩增并分析结果。
1.5.3 蛋白质印迹(Western blot) 将转染后的细胞用细胞裂解液(RIPA)与蛋白酶抑制剂(PMSF)进行裂解,加上样缓冲液处理,然后进行SDS-PAGE电泳,将蛋白移到PVDF膜上,用2.5%脱脂奶粉液封闭1 h,加1∶2 000稀释的鼠抗Flag抗体孵育2 h,PBST洗6次,加带有HRP标记的羊抗鼠IgG孵育1 h,PBST洗涤5次,用去离子水终止反应,Pierce增强ECL蛋白印迹化学发光底物观察结果。使用β-Actin作为内参蛋白。
1.6 统计学分析
运用Graphpad Prism 7 (San Diego, CA, USA)对结果进行Student’s t-test统计分析。每组数据用mean ± SEM表示,至少设置三个重复。两组间P<0.05表示差异显著用“*”表示,P< 0.01和P<0.001表示差异极显著,分别用“**”和“***”表示。
2 结果与分析
2.1 PPRV突变基因ΔC和ΔV的扩增
根据设计的特异性引物ΔC-F和ΔC-R, ΔV-F和ΔV-R分别从p3Flag-CMV-14-C和p3Flag-CMV-14-V质粒扩增获得大小约为533 bp的PPRV病毒突变基因ΔC和896 bp的PPRV病毒突变基因ΔV片段,其大小与预期基因片段一致 (图2)。
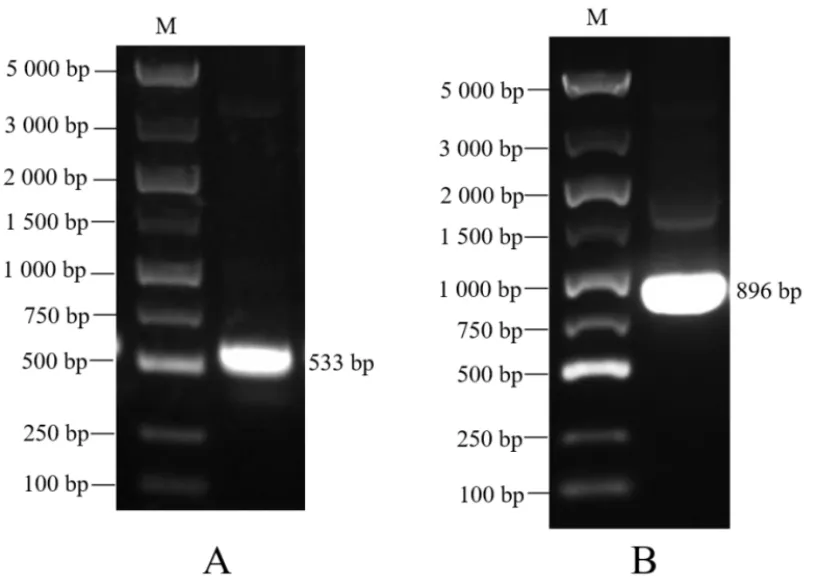
图2 PPRV突变基因 ΔC和ΔV 片段PCR扩增电泳
2.2 突变基因重组表达质粒的构建
将扩增获得ΔC和ΔV的产物与p3Flag-CMV-14载体连接后得到重组质粒p3Flag-CMV-14-ΔC和p3Flag-CMV-14-ΔV。经Hind III与Kpn I、Hind III与EcoR I双酶切,1%琼脂糖凝胶电泳分别得到约533 bp的ΔC和896 bp的 ΔV基因条带,以及约6 310 bp载体骨架条带 (图3),其结果与预期大小一致。测序表明,重组表达质粒中ΔC和ΔV基因序列与其设计模板序列 (包括突变碱基)同源性分别为99.8%和100%。除了引入的突变位点外,p3Flag-CMV-14-ΔC中ΔC序列的第123位发生单碱其突变A123G,但其编码氨基酸未改变,均为精氨酸,对后期表达无影响(图4)。

图3 重组质粒pFlag-CMV-ΔC和pFlag-CMV-ΔV
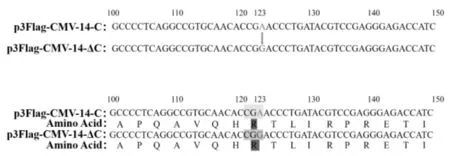
图4 重组质粒p3Flag-CMV-14-ΔC测序鉴定
2.3 突变基因表达检测
6孔细胞培养板中培养HEK-293T细胞至70%~90%汇合时,Lipofectamine 2000每孔分别转染p3Flag-CMV-14-ΔC (2.5 μg)、p3Flag-CMV-14-ΔV (2.5 μg)和p3Flag-CMV-14 (2.5 μg)。转染24 h后,转染p3Flag-CMV-14和p3Flag-CMV-14-ΔC质粒细胞C基因表达极显著低于转染p3Flag-CMV-14-C细胞(P<0.001),p3Flag-CMV-14和p3Flag-CMV-14-ΔC转染细胞中C基因几乎无表达,差异不显著(P>0.05)(图5A)。Western blotting检测表明转染p3Flag-CMV-14-ΔC细胞中C蛋白也无表达(图5B)。结果表明通过PCR突变技术获得了表达沉默的C基因。同样,转染p3Flag-CMV-14和p3Flag-CMV-14-ΔV质粒细胞V基因表达极显著低于转染p3Flag-CMV-14-V细胞(P<0.01),p3Flag-CMV-14-ΔV转染细胞中V基因虽然有表达,但表达量不高,与转染p3Flag-CMV-14细胞V基因表达量差异不显著(P>0.05)(图6A)。Western blotting检测表明转染p3Flag-CMV-14-ΔV细胞中V蛋白也无表达(图6B)。结果表明通过PCR突变技术获得了表达沉默的V基因。
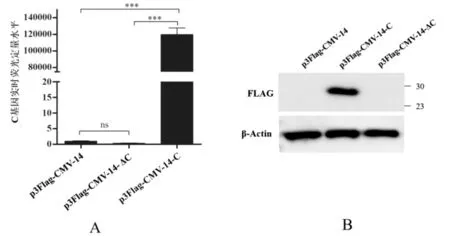
图5 C基因和C蛋白在HEK-293T细胞中表达

图6 V基因和V蛋白在HEK-293T细胞中表达
3 讨论
在全球牛瘟根除计划(GREP)成功实施后,国际兽疫局(OIE)已开始采取多种措施控制PPRV的传播。自2007年我国西藏首次出现PPR病例以来,该病不断向其他地区扩散,其发病率逐年上升,对我国养羊业和野生动物造成巨大的危害。目前该病治疗方法有限,主要依靠接种疫苗进行预防。
与所有副粘病毒一样,PPRV基因组编码的非结构蛋白C是从P基因前半部分开放阅读框的第二个ATG开始编码的表达蛋白。C蛋白分子量约20 KDa,无磷酸化,与L蛋白结合,定位于细胞核或细胞质。C蛋白在免疫逃逸和疾病发生中有不同的作用。副粘病毒科病毒中,C蛋白主要通过两种机制抑制IFN产生,一种是C蛋白减少病毒复制,因此减少了PRRs可以识别的基因基序的数量,从而降低了IFNs的产生;另一种是C蛋白直接干扰PRRs信号通路,影响IFN基因的转录。PRRs信号中,MeV-C、RPV-C蛋白的靶标已被识别,但PPRV-C蛋白靶标未见报道。尽管确切机制仍不清楚,但MeV-C、RPV-C蛋白作用于细胞核中IRF3,干扰了IRF3的转录而不影响其磷酸化、二聚化或核积聚,从而阻断IFN-I的生成,其作用机理是IRF3二聚体位阻了IFN-β启动子。MeV-C蛋白还能阻断NF-κB信号通路,但比V蛋白弱,表明副粘病毒C蛋白可能还存在其它机制抑制宿主免疫反应。虽然V蛋白可能是MeV感染过程中IFN信号的主要拮抗剂,也有报道C蛋白也能阻断IFN-I信号通路。总之,副粘病毒科病毒C蛋白抑制干扰素诱导的信号通路是天然免疫启动上的一个必要组成部分,如MeV-、RPV-C蛋白一样,PPRV C蛋白是否影响PRRs通路是将来研究重点,对阐明PPRV免疫抑制机理具有重要意义。
麻疹病毒属病毒P基因通过其开放阅读框移码的特殊编辑策略,在保守的RNA编辑位点5'-TTAAAAGGGCACAG-3'插入一个G或两个G产生V蛋白或W蛋白,该位点没有碱基插入时合成P蛋白,V蛋白是麻疹病毒属病毒的毒力因子。与其他病毒P、V、W蛋白一样,PPRV V蛋白含有氨基端结构域,但氨基酸序列同源性不高;羧基端有富含组氨酸和半胱氨酸的锌指结构,氨基酸序列同源性高。副粘病毒科呼吸病毒属、亨尼病毒属、轮状病毒属和麻疹病毒属病毒编码的V蛋白分子量28-32 KDa,被磷酸化后与N、L蛋白结合在一起,均可产生IFN信号逃逸。与其他副粘病毒科病毒一样,麻疹病毒属病毒V蛋白可在IFN-I信号转导通路的不同阶段均可产生干扰作用,阻断干扰素信号,抑制细胞的抗病毒作用。PPRV V蛋白通过与STAT1和STAT2互作抑制IFN信号通路,介导天然免疫逃逸。PPRV V蛋白对ISRE和GAS启动子表达的抑制作用比N和P蛋白强烈,其氨基端结构域第101位酪氨酸突变为丙氨酸能减弱IFN信号通路的抑制,表明这一结构域的功能是拮抗IFN信号转导,羧基端结构域锌指结构中的保守半胱氨酸簇和色氨酸基序与STAT2也有互作,其中第275和第277两个氨基酸发挥重要作用。麻疹病毒属病毒V蛋白不仅与STAT1和STAT2作用,还能干扰其上游Jak家族蛋白质的磷酸化,MeV、CDV、RPV和PPRV病毒的V蛋白能抑制Tyk2磷酸化,但只有强毒RPV的V蛋白才能破坏Jak1的磷酸化。在这些实验中,所有V蛋白都能免疫共沉淀Jak1和Tyk2,而不影响其磷酸化,表明V蛋白可能结合于IFNR受体的Jak1/Tyk2复合体,然后破坏信号转导。这种辅助的IFN-I抑制机制表明麻疹病毒可能有几条途径阻断IFN-I和IFN-II信号通路,提示了这一途径在该属病毒致病性上具有重要作用。
很少有研究关注PPRV、RPV病毒V蛋白抑制IFN产生路径或与RLR的互作。至少有13种副粘病毒V蛋白能与MDA5结合从而抑制IFN产生。已证实MeV-V蛋白羧基端结构域与MDA-5结合,该结构域还与LGP2相互作用,而不是与RIG-I直接作用抑制它的信号转导。MeV-V蛋白还能干扰其他PRRs诱导的信号通路,如抑制浆细胞样树突状细胞中TLR7/9诱导的IFN产生;与IKKɑ互作阻碍IRF7激活,进而影响IFN-β生成;抑制NF-κB活性等。虽然RPV、PPRV病毒V蛋白与RLR或TLR信号通路接头蛋白的互作还没有更多研究,但研究表明RPV病毒通过C蛋白抑制MDA-5信号而不是V蛋白。尽管如此,PPRV-V蛋白能够抑制IFN-β启动子活性,表明RPV-和PPRV-V蛋白作用不完全一样。PPRV-V蛋白是否与MeV蛋白作用靶点相同仍有待研究。与其他麻疹病毒一样,PPRV-V蛋白通过削弱IFN-I和IFN-II信号、阻止IFN产生而在抑制细胞的抗病毒作用中发挥必要作用。
本研究将PPRV C基因起始密码子AUG突变为ACG,并在氨基酸序列的第9位、第12位引入终止密码子,在V基因编码氨基酸序列的第7位、第285位、第294位引入三个终止密码子,运用PCR技术扩增获得了表达沉默的突变基因ΔC和ΔV,构建了真核表达载体p3flag-CMV-14-ΔC和p3flag-CMV-14-ΔV。实时荧光定量PCR (RT-qPCR)检测表明转染突变基因质粒HEK-293T细胞中C基因和V 基因表达均极显著降低, 蛋白质印迹检测表明转染突变基因质粒细胞中C蛋白和V蛋白均无表达。研究结果为进一步研究PPRV病毒C和V蛋白的功能提供了科学依据。
——一道江苏高考题的奥秘解读和拓展

