Mi R-32-3p在多发性骨髓瘤中的表达及其临床意义
石 林,张帅帅,任翠爱
多发性骨髓瘤(multiple myeloma,MM)是一种好发于中老年人的恶性浆细胞肿瘤,约占血液系统恶性肿瘤的10%,发病率仅次于非霍奇金淋巴瘤。随着新型药物的引入,患者的总体生存率得到明显改善,5年相对存活率从1973-1982年的28%增加到2003-2013的41%[1],但由于耐药性的存在,大多数骨髓瘤患者仍无法摆脱复发的厄运[2]。
MicroRNA(miRNA)是长度约为22个核苷酸的非编码RNA,可以通过靶向mRNA沉默mRNA的翻译或促进mRNA降解[3]。miRNA可以调节人体内约30%~80%的mRNA转录水平,通过调节转录后基因的表达控制细胞的增殖、分化、迁移以及凋亡[4]。miR-32-5p已被证实在多种肿瘤中高表达,在多发性骨髓瘤中,过表达miR-32-5p的骨髓瘤细胞系,细胞周期蛋白c-Jun,c-Myc表达也随之增高[5],表明miR-32-5p在多发性骨髓瘤中作为致癌因子发挥作用[6]。但是对于miR-32-3p在多发性骨髓瘤中作用几乎没有相关报道。miR-32-3p作为染色体不稳定相关micRNA,可能会影响MM的发生发展。为了研究miR-32-3P在MM患者中发挥的作用以及对药物的敏感性的影响,本次实验收集了中国医学科学院血液病医院淋巴瘤诊治中心就诊的26例骨髓瘤患者标本,8例健康供者的骨髓标本,与健康患者比较,miR-32-3p在骨髓瘤患者中呈现低表达状态,提示miR-32-3p可能在骨髓瘤中发挥着抑癌作用。
1 材料和方法
1.1 骨髓瘤样本收集及处理 收集中国医学科学院血液病医院淋巴瘤诊治中心2014年6月-2014年12月就诊的26例骨髓瘤患者标本(实验室检验后废弃样本),8例健康供者的骨髓标本(实验室检验后废弃的骨髓移植的健康供者标本),两组标本年龄、性别具有可比性。所有样本经淋巴细胞分离液分离出单个核细胞,使用80μL PBS-AB重悬2×107/mL的细胞悬液,加入20μL CD138磁珠,4℃孵育5 min,过柱分离出CD138+细胞,-80℃保存备用。
1.2 骨髓瘤细胞系(ARP1)培养与转染 将生长状态良好的ARP1细胞以2×106/孔接种于10 cm培养皿中,使用Lenti-PacTM HIV慢病毒包装试剂盒(Genecopia,LT001-01,LT001-03),使用miR-32模拟物和miR-control质粒转染ARP1野生型细胞,分别记做ARP1-miR-32 OE和ARP1-EV,同时加入polybrene 3μg/mL,转染24 h后换液,用RPMI1640培养基(含10%FBS+1%双抗)培养2 d后,在荧光显微镜下观察荧光情况,使用嘌呤霉素(puro)1μg/mL筛选细胞,流式检测阳性率,阳性率在90%以上为最佳。
1.3 PCR验证转染细胞miR-32-3p的表达丰度 使用All-in-OneTMmiRNA qRT-PCR Detection Kit试剂盒(Genecopia,QP015),以U6(Genecopia,HmiRQP9001)为内参,用实时定量PCR检测ARP1-miR-32OE和ARP1-EV2个细胞系miR-32-3p(Genecopia,HmiRQP0403)的表达丰度。以2-ΔΔCt计算miR-32-3p的相对表达量,重复3次,取平均值。
1.4 细胞增殖实验 取对数生长期的ARP1-EV和ARP1-miR-32 OE细胞,调整浓度为1×105/mL,在12孔板中铺板,每孔加入2 mL细胞悬液,使每孔起始细胞数为2×105个,设3个复孔。分别在d 2、3、4、5、6、7记录细胞数据。
1.5 药敏试验 CCK8检测miR-32-3p对细胞化疗耐药性影响,取对数期生长的ARP1-miR-32-3P-OE与ARP1-EV细胞,细胞密度调整为5×105/mL,每孔取100μL,接种于6孔板中;设置化疗药物硼替佐米浓度为5 nmol/L,每孔加如10μL,设3个复孔。在37℃、5%CO2的培养箱中,分别孵育24、48、72 h,加CCK8溶液10μL/孔,2 h后使用用酶标仪检测在450 nm处的吸光度。实验重复3次,计算细胞存活率。细胞存活率=实验孔平均吸光度/对照孔平均吸光×100%,。
1.6 Western blot验证细胞周期相关蛋白表达量将ARP1-EV细胞以及ARP1-miR-32 OE的细胞裂解,BSA定量法测定蛋白浓度,上样量调整为每孔20μL进行蛋白电泳,转膜;用5%的脱脂奶粉封闭1 h,洗膜,分别用c-Myc(Proteintech,10828-1-AP),Aurka(Abcam,ab13824),p53(Abcam,ab131442),p-H2AX(CST,#9718)等细胞细胞周期相关抗体,4℃冰箱孵育过夜,洗膜,室温孵育相应二抗1 h后洗膜,在化学发光成像仪(Biorad,chemiDoc)中进行显色,用灰度值表示个蛋白相对表达量。
1.7 动物体内实验 小鼠(NOD-SCID)雌性小鼠(10只),购自北京维通利华实验动物技术有限公司(动物质量合格证号SCXK(京)2016-0006),在中国医学科学院血液学研究所SPF级动物合格环境下饲养(合格证号SYXK(津)2020-0003),适应性饲养1周后(6周龄,体重为18~20 g),随机分为2组,每组5只,共10只小鼠,将对数生长期的ARP1-EV细胞、ARP1-miR-32OE细胞离心,PBS清洗两遍,重悬,细胞浓度调制1×107/mL,小鼠腋下注射100μL细胞悬液(1×106个细胞),对照组接种ARP1-EV细胞,实验组注射ARP1-miR-32OE细胞,成瘤后使用游标卡尺测量肿瘤长径(a),短径(b),计算肿瘤体积V(cm3)=a×b2/2,当肿瘤长径超过2 cm时脱颈处死小鼠,剥离肿瘤组织。
1.8 统计学处理 使用GraphPad Prism8.0.1进行图片绘制。采用SPSS 22.0软件进行数据分析,计量资料均以均数±标准差()表示,两组间比较采用t检验,重复测量资料使用方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 骨髓瘤患者与健康供者miR-32-3p的相对表达水平 骨髓瘤患者26例,男15例,女11例,年龄(53.1±9.7)岁,健康供者8例,男5例,女3例,年龄(43±6)岁。骨髓瘤患者骨髓CD138+细胞miR-32-3p的表达水平(7.33±6.17)低于健康供者骨髓CD138+细胞miR-3-3p的表达水平(40.49±27.97,P<0.001)(图1)。
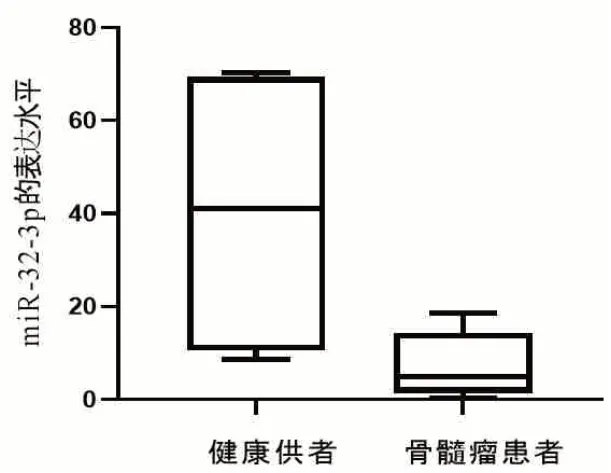
图1 Mir-32-3p在健康供者与骨髓瘤患者样本中的表达水平
2.2 RT-PCR检测细胞转染效率 RT-PCR检测miR-32-3p过表达水平为(12.11±0.32)倍(P<0.01),差异具有统计学意义(图2)。细胞绝对计数法检测ARP1-miR-32OE/EV细胞的增殖情况,与对照组比较,过表达miR-32-3p的MM细胞系能明显抑制细胞增殖(P<0.01,图3)。
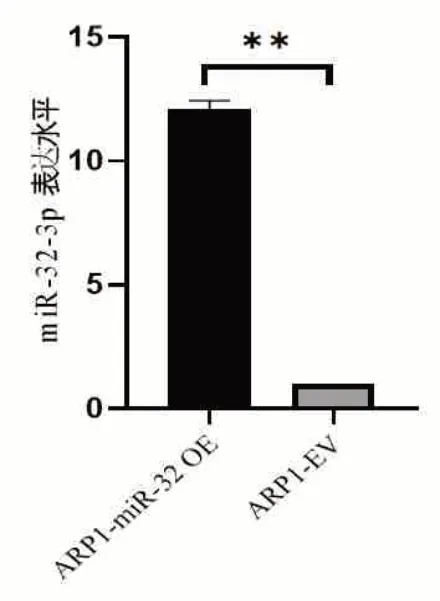
2.3过表达miR-32-3p对MM细胞增殖的影响 用
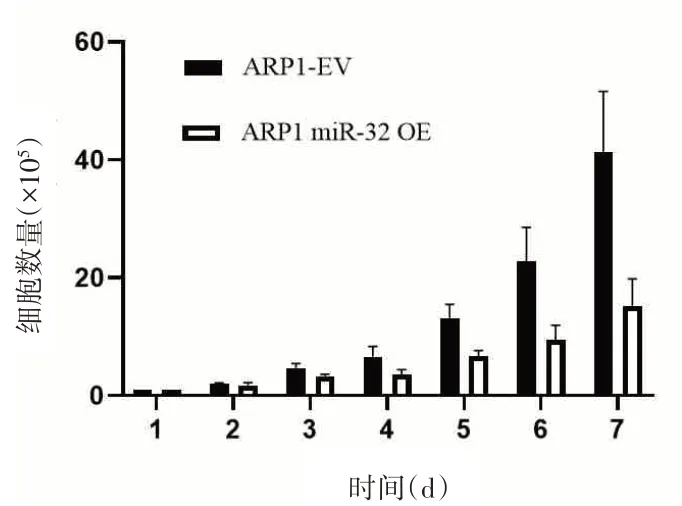
图3 过表达miR-32-3p对MM细胞增殖的影响
2.4 ARP1-miR-32-3p-OE细胞系对化疗药物耐药性的影响 在抗癌药物硼替佐米的作用下,ARP1-EV细胞系存活率均高于同时点的ARP1-32-3p-OE细胞系(P<0.05)。表1。
表1 ARP1-miR-32-3p-OE细胞系对化疗药物耐药性的影响(±s)

表1 ARP1-miR-32-3p-OE细胞系对化疗药物耐药性的影响(±s)
与同时点ARP1-EV细胞比较,*P<0.05
?
2.5 WB实验结果 免疫印迹实验结果显示,miR-32-3p在蛋白水平下调c-Myc,Aurka,Bcl2,Notch1的表达,上调p-53,p-H2AX表达(图4,表2)。

表2 Mir-32-3p对ARP1细胞系相关蛋白的影响
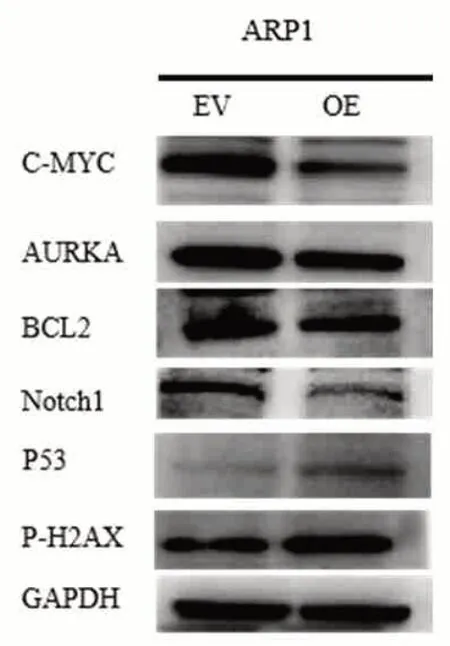
图4 WB实验结果
2.6 MiR-32-3p表达水平对MM细胞体内增殖的影响 ARP1-miR-32-3p OE组小鼠肿瘤体积(V3=5.33±2.13cm3)与ARP1-EV组肿瘤体积(V3=9.40±4.29cm3)比较,增殖受抑制,(P<0.05,图5)。

图5 MiR-32-3p表达水平对MM细胞体内增殖的影响(A)ARP1-miR-32-3pOE细胞系肿瘤生长速度;(B)小鼠肿瘤体积大小直观图
3 讨论
多发性骨髓瘤是血液系统中发病率仅次于非霍奇金淋巴瘤的恶性肿瘤[7],由于复杂的骨髓微环境以及高度的侵袭性,多发性骨髓瘤的发病机制至今未被完全了解,随着新药的不断开发,多发性骨髓瘤患者的5年相对生存率得到明显改善,然而,频繁的复发与耐药仍然是大多数患者无法避免的结局[8]。因此,寻找MM潜在靶向因子,有望为临床疾病治疗提供新的思路与靶标。
MicroRNA显示出了其在生命过程中的调控能力[9],研究显示,miRNA多出现在染色体缺失或扩增的不稳定区域,与癌症的发生密切相关,已被证实多种miRNA可以调控MM的发展,miR-15a与miR-16在MM显著低表达,并与Bcl2和Cyclin E的表达呈负相关[10],通过影响CDC25A和Cyclin D1/D2表达,靶向Bcl2并抑制AKT3和NF-kB途径来抑制细胞增殖;miR-221和222通过靶向肿瘤抑制基因PTEN和与促凋亡基因PUMA,发挥致癌作用[11];miR-138可以抑制TRPS1和SULF2的表达,抑制miR-138的表达增强了MM的骨生成[12]。本研究结果显示,miR-32-3p相较于正常样本,在骨髓瘤患者体内显著低表达,并且能够下调c-Myc,Bcl2等蛋白的表达,抑制MM细胞的增殖。
为了探索ARP1-miR-32-3p在药物敏感性方面发挥作用的机制,本研究检测了与耐药增殖等相关的蛋白。c-Myc基因是位于染色体8q24.21的原癌基因,编码一种核磷蛋白,在细胞周期,凋亡和细胞转化中起到作用,编码的蛋白质与相关转录因子MAX形成异源二聚体结构[13]。该基因的易位常发生在伯基特淋巴瘤[14]和多发性骨髓瘤[15]。研究发现,c-Myc过表达会激活相关下游基因的表达,促进DNA合成,介导细胞周期延长,增加染色体畸变率,导致基因组不稳定并产生化疗药物抵性。现有研究证实,c-Myc在急性髓系白血病等多种肿瘤中过表达,并与细胞的耐药性有关。Aurka编码的蛋白质是调节细胞周期的一种激酶,在染色体分离过程中参与纺锤体极的形成与稳定过程[16]。研究发现,在MM中影响染色体不稳定与DNA损伤,并参与肿瘤细胞耐药[17]。Bcl2蛋白是调节蛋白Bcl2家族成员,Bcl2的异常表达可以破坏MM中的正常的凋亡途径,且为MM患者耐药的重要[18];Notch通路是一条高度保守的信号转导通路,参与细胞的增殖,分化与凋亡。研究表明,Notch信号通路与多发性骨髓瘤的发病与进展密切相关,Notch1的激活可以促进MM细胞增殖[19],抑制MM细胞凋亡,促进肿瘤细胞耐药性[20]。本研究结果显示,miR-32-3p均可明显下调上述蛋白的表达,表明miR-32-3p可以抑制MM细胞的增殖,促进MM细胞凋亡,加强了对硼替佐米的敏感性。
早期有关microRNA命名较为混乱,许多实验并未明确指出所研究miR-32的是来自miR-32前体(pre-miR-32)的5’端还是3’端,由于肿瘤细胞的异质性和所处微环境的不同,不同肿瘤中microRNA的5’端和3’端表达丰度可能会存在差异。目前有关miR-32的报道多数集中于肝癌[21],结肠癌[22](miR-32),前列腺癌[23],肾癌[24](pre-miR-32)等。MiR-32在这些癌细胞中均表现出高表达。而对于miR-32-3p报道,在一项胸膜间皮瘤的研究中明确显示miR-32-3p表达升高,在鼻粘膜息肉的研究中miR-32-3p的表达下调[25],而有关卵巢癌的研究中显示出miR-32的下调,且高表达miR-32能明显抑制卵巢癌细胞的增殖[26]。
miR-32位于染色体9q31.3,越来越多的研究显示MM疾病的发生与9号染色体异常有关[27],因此可以推测可能是9号染色体的异常使得miR-32-3p的表达降低。此次实验,miR-32-3p在多发性骨髓瘤中抑制肿瘤生长的作用已得到验证,然而miR-32-3p的具体作用机制尚不明确,miR-32-3p是否受其他蛋白或LncRNA调节,是否参与了MM经典通路,miR-32-3p的靶基因都有哪些等还需做进一步的研究与验证。
目前对miR-32-3p的研究较少,尚未有关于miR-32-3p在多发性骨髓瘤中研究的相关报道,此次对miR-32-3p的研究显示出了较好的阳性结果,提示miR-32-3p可能是多发性骨髓瘤的一个潜在抑癌因子,可能通过调节细胞周期进程,促进细胞衰老,增加对抗癌药物的敏感性,来抑制多发性骨髓瘤的发展。有望成为治疗多发性骨髓瘤的新的靶点,同时为研究多发性骨髓瘤提供新的方向。

