十倍体长穗偃麦草Ca2+转运蛋白ThCAX1表达及生物信息学分析
付丽娜, 赵丽敏, 胡喜贵, 卢柳月, 胡铁柱, 王玉泉
(1.河南省杂交小麦重点实验室, 河南 新乡 453003; 2.河南科技学院, 河南 新乡 453003)
钙是植物必需的营养元素,是细胞壁的组成部分,也是介导细胞反应的第二信使[1-3]。在植物细胞内,Ca2+浓度受到精细调节,外界环境变化时,细胞质中Ca2+浓度迅速升高,但又能维持在满足细胞基本需要的低浓度,Ca2+/H+反向转运蛋白[Cation(Ca2+)/H+antiporter]在上述精准调控机制中发挥重要作用[4]。Cation(Ca2+)/H+反向转运蛋白定位在液泡膜上,又称为阳离子交换器[Cation(Ca2+)/H+exchanger,CAXs],通过水解 ATP供能可将细胞质中Ca2+转运到液泡中,从而形成跨膜Ca2+浓度梯度,调控细胞质的Ca2+水平[5]。
Cation(Ca2+)/H+反向转运蛋白属于CAX家族,CAX基因对维持细胞内 Ca2+浓度平衡,控制植物正常的生长发育[6],以及调节植物对逆境胁迫的响应如盐胁迫和低温胁迫至关重要[4]。在植物中,AtCAX1-4[7-8]、OsCAX1-4[9-10]、VCAX1[11]等多个CAX基因已被鉴定。AtCAX1和AtCAX2是被首次鉴定的植物CAX家族蛋白,其可恢复酵母突变株的Ca2+转运能力[7]。
尽管多个CAX蛋白已经被鉴定为Cation(Ca2+)/H+反向转运蛋白,但在这些反向转运蛋白中,Ca2+的亲和力并不相同。研究表明,AtCAX1、VCAX1、OsCAX1的亲和力高于CAX2[7,9,11],同等浓度的Ca2+诱导下,CAX1mRNA的表达量增加5倍,而CAX2表达量却没有发生变化[4,12]。在烟草中,过表达CAX2,Cd2+和Mn2+向液泡中的转运速度增加,表明CAX1和CAX2的功能存在差异[13]。
本研究通过全长转录组测序的方法,鉴定获得了十倍体长穗偃麦草ThCAX1基因序列,并拟在此基础上分析ThCAX1在不同处理中的表达量变化,通过在线网站进一步分析其生物信息,为研究该基因的功能奠定基础。
1 材料与方法
1.1 实验材料
所用材料为5 ES易位系,由河南科技学院小麦中心提供,为十倍体长穗偃麦草和普通小麦品种百农AK 58经远缘杂交而来。在该易位系中,十倍体长穗偃麦草5 E染色体短臂代替了普通小麦百农AK 58的5 D染色体短臂[14]。
1.2 实验处理
将5 ES易位系分别种植于2个苗盘中,露白后将其中1盘转移到培养箱中继续生长,培养条件设为4 ℃,另1盘作为对照,光照时间均为16 h,21 d后取叶片和根并进行混合,送到上海凌恩生物有限公司进行全长转录组和普通转录组测序。
1.3 分析方法
参考韦春等[15],王作日等[16]的生物信息预测方法,利用DNAMAN对蛋白质氨基酸进行序列进化分析;Prot Param分析蛋白质的基础理化性质;利用在线软件 Prot Scale对ThCAX 1蛋白质亲疏水性进行分析;蛋白跨膜螺旋分析采用TMHMM Serverv 2.0软件;利用在线分析软件TMpred Server对ThCAX 1编码蛋白跨膜结构域进行预测;利用在线软件SOPMA对蛋白质的二级结构进行预测,并利用SWISS-MODEL软件对蛋白质的三级结构进行同源建模;利用在线网站string(https://cn.string-db.org)进行蛋白质互作网络分析。
2 结果与分析
2.1 ThCAX1基因表达量及序列分析
普通转录组表达量分析发现,低温处理后Tel5E01G057500基因表达量显著降低(图1)。功能注释发现该基因编码Ca2+/H+反向转运蛋白为CAX1的同源基因。该基因全长编码序列1 695 bp,编码565个氨基酸,分子量59.39 kDa。565个氨基酸中碱性氨基酸和酸性氨基酸分别为74个和34个,占比分别为13.09%和6.01%,极性氨基酸93个,比例为16.46%。
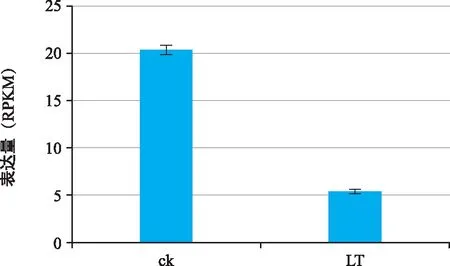
图1 ThCAX1基因在低温和对照间的表达量分析Fig.1 Expression analysis of ThCAX1 gene between low temperature and control
2.2 ThCAX1基因序列进化分析
利用全长转录组测序所得ThCAX1基因序列与百农AK 58(基因组已测序)基因组进行比对,获得百农AK 58TaCAX1-5A、TaCAX1-4B、TaCAX1-5D基因编码序列。通过NCBI获取水稻OsCAX1(XM_015764722.2)、大麦HvCAX1(EF 446604)、玉米ZmCAX1(NM_001111529)、粗山羊草AeCAX1(XM_020327808.2)、圆锥小麦TdCAX1(XM_044515287)编码序列进行比较,结果显示,该基因与百农AK 58TaCAX1-5A、TaCAX1-4B序列相似性较低,与TaCAX1-5D及AeCAX1相似性较高(图2),但并不完全一致,推测该基因来源于十倍体长穗偃麦草5 ES染色体短臂,将该基因命名为ThCAX1。

图4 ThCAX 1蛋白跨膜结构域预测Fig.4 Protein transmembrane domain prediction of ThCAX 1

注:红色:α螺旋(α-helix),灰色:无规卷曲(random coil),黄色:延伸链(extendedstrand)。图5 ThCAX 1蛋白次级结构预测Fig.5 Protein secendary structure prediction of ThCAX 1

图2 ThCAX1基因遗传进化分析Fig.2 Genetic evolution analysis of ThCAX1
2.3 蛋白亲疏水性分析
应用在线分析软件 ProScale对ThCAX 1编码蛋白进行亲疏水性分析,高峰区为疏水区,低谷为亲水区。根据结果可知该蛋白为亲水性蛋白,其中峰值大于3的氨基酸位点有4个(图3),分别为25-31位、119位、202位、228位,峰值低于-3的位点有2个,分别为369-371位和547位,最高峰值和最低峰值分别为3.667和-3.744,分别为27位缬氨酸和547位精氨酸。信号肽预测表明TelCAX1基因没有信号肽,为非分泌蛋白。
2.4 ThCAX 1蛋白跨膜结构域预测
ThCAX1编码Ca2+/H+反向转运蛋白,定位于液泡膜上,是跨膜蛋白。利用TMHMM Serverv 2.0软件对其跨膜区域进行分析,结果可知,该基因具有5个跨膜区域,对应的氨基酸分别为13-35位、105-107位、134-156位、183-205位和226-248位,对应的氨基酸长度分别为23、3、23、23、23个(图4)。

图3 ThCAX 1蛋白亲疏水性分析Fig.3 Protein hydrophilicity and hydrophobicity ananlysis of ThCAX 1

图7 ThCAX 1蛋白互作网络预测Fig.7 Protein interaction network prediction of ThCAX 1
2.5 ThCAX 1蛋白质结构预测
利用在线分析软件NovoPro(https://www.novopro.cn/tools/secondary-structure-prediction.html)对ThCAX 1蛋白质的次级结构进行预测,结果显示ThCAX 1蛋白质序列中存在25个α螺旋(α-helix)、7个延伸链(extendedstrand)和26个无规卷曲(random coil)、氨基酸残基分别为238个、19个和308个,占比分别为42.12%、3.36%和54.51%。利用软件 SWISS-MODEL(https://swissmodel.expasy.org/interactive/GXrkSs/models/)对ThCAX 1蛋白进行三级结构模型预测。

图6 ThCAX 1蛋白三维结构模型预测Fig.6 3D protein structure model prediction of ThCAX 1
2.6 ThCAX 1蛋白互作网络分析
利用蛋白互作在线分析网站string(https://cn.string-db.org)分析了ThCAX 1蛋白在小麦基因组中的互作网络,结果显示共有10个蛋白参与互作,10个蛋白中,有9个与ThCAX 1直接互作(图7),仅有一个为间接互作,但10个蛋白均缺少详细的功能报道。在NCBI对10个蛋白进行功能注释,发现其中6个基因参与离子交换(Traes_2 AS_7 BDDE 5 AD 6.1、Traes_1 BS_30079 BCB 0.1、Traes_2 AS_85 C 774 FA0.1、Traes_2 DS_93 A 43 B 61 E.1、Traes_2 DS_977 F 19 A 7 D.2、Traes_2 DS_981 F 332 F 2.2),3个为U-box domain蛋白(Traes_3 AL_F 4131B 815.1、Traes_3 B_5 E 4 CDEE 3 E.1、Traes_3 B_AF 9400 E 7 F.2),1个为乙酰辅酶A类似蛋白(Traes_2 BL_52480 A 403.2)。
3 讨 论
钙是植物生长发育所必需的营养元素之一,也是细胞信号传导的重要信使[17]。Cation (Ca2+)/H+反向转运蛋白参与调控细胞内的钙离子浓度平衡,CAX1是CAX基因家族的重要成员,在植物耐逆境胁迫反应中发挥重要作用[18]。本课题组以十倍体长穗偃麦草和普通小麦百农AK 58远缘杂交而来的5 ES易位系为研究材料,通过全长转录组和普通转录组测序获得了Tel5E01G057500基因的全长编码序列,表达分析表明,其在低温处理及对照中表达差异显著,说明该基因参与低温调节。序列分析表明,该基因全长编码序列1 695 bp,功能注释表明该基因属于CAX1基因家族,编码565个氨基酸,与粗山羊草AeCAX1、百农AK 58TaCAX1-5A、TaCAX1-4B、TaCAX1-5D编码氨基酸个数相同,表明该基因编码序列具有一定的保守型。序列进化分析表明该基因与粗山羊草AeCAX1、百农AK 58TaCAX1-5D相似性较高。王红日等[19]认为长穗偃麦草与山羊草属遗传关系较近,这与前人研究结果一致,推测Tel5E01G057500基因来源于十倍体长穗偃麦草5 E染色体长臂,将该基因命名为ThCAX1。ThCAX 1蛋白跨膜结构域预测发现该基因含有5个跨膜结构域,没有信号肽,属亲水性蛋白。张璐等[20]对苹果MdCAX进行研究发现,该基因含5个跨膜结构域,ThCAX 1跨膜结构域预测结果与此一致。廖琼等[21]对BnaCAX基因家族的研究表明,该家族基因含有6~8个跨膜结构域,表明该基因在不同的物种中序列多样性丰富。AtCAX1不仅参与细胞钙离子的调控,还参与镉、锰等有毒重金属物质的运输,表明该基因功能具有多样性[22]。
研究表明,不同转运蛋白之间可以发生相互作用以扩大其调节范围和功能,同时胞质阳离子浓度的平衡也是多种转运蛋白相互作用的结果。拟南芥cax1突体中,sAtCAX1在cax1-1中的表达导致AtCAX3、AtCAX4和ACA4表达降低,进一步的研究表明,AtCAX3和AtCAX4共同参与Ca2+浓度平衡调控,CAXs之间具有相互作用[23]。通过AtCAX1和AtCAX3相互作用,植物可以获得生长发育所需要的养分[24]。sAtCAX1或sAtCAX3共同表达时可以生成新的异二聚体,调控Li+的耐性[22,25]。利用在线网站分析了ThCAX 1蛋白在小麦中的互作网络,结果显示,共有10个蛋白参与互作,对10个蛋白的功能注释发现,其中有6个基因均为离子交换蛋白,表明在小麦中,CAX基因之间也存在相互作用,这与前人的研究结果一致,但如何作用,还需要进一步的研究。

