肠道菌群影响慢性乙型肝炎、慢性丙型肝炎及相关肝病的研究进展
邓 辉, 张 斌, 朱 彬, 迪丽胡玛尔·扎依尔, 王伟仙, 郭春霞, 杨东亮, 郑 昕,王俊忠, 王宝菊
华中科技大学同济医学院附属协和医院 感染性疾病科, 武汉 430022
HBV和HCV是导致病毒性肝炎的主要病原体,HBV和HCV感染可导致急慢性肝炎,甚至发展成肝硬化、肝衰竭和肝细胞癌(HCC)等[1]。肠道菌群与人体健康关系密切。越来越多的证据表明,肠道菌群与肝脏的互作(肠-肝轴)对慢性乙型肝炎(CHB)、慢性丙型肝炎(CHC)等慢性肝病的发生、发展、预后和治疗均具有深远的影响[2]。本篇综述系统回顾了近年来肠道菌群参与CHB、CHC及其相关肝病发生发展及治疗的研究进展。
1 肠道菌群概述
据估计[3],人体内含有约100万亿个微生物细胞,大部分存在于肠道,被称为肠道菌群,或称肠道微生物组。门静脉将肠道菌群与肝脏联系起来,肠道菌群的代谢产物通过门静脉运送到肝脏,肝脏通过分泌胆汁及产生抗体等影响肠道菌群。肠道菌群与肝脏之间的相互作用被称为肠-肝轴,肠道菌群是维护肠-肝轴自稳的关键。除作为屏障防御病原体入侵外,肠道菌群还参与维持免疫系统的平衡[4]。当肠道菌群失调时,可通过细菌及其代谢产物上调炎症反应来加速慢性肝病的发展,促进肝纤维化、肝硬化及其并发症,甚至肝癌的发生[3]。
2 肠道菌群与CHB、CHC及其相关肝病
2.1 肠道菌群与CHB 慢性HBV感染是重要的全球公共卫生问题,全球约有2.96亿慢性HBV感染者[5],我国约有慢性HBV感染者7000万例,其中CHB患者约2000万~3000万例[6]。研究[7-8]发现,无论是CHB还是HBV相关肝硬化和HCC患者,肠道菌群的多样性均显著降低,且组成也发生明显改变,表现为潜在有害菌如肠杆菌科、放线菌属等增多和潜在有益菌如双歧杆菌科、类杆菌属等减少。在排除年龄和BMI对肠道菌群产生的影响后仍可得出与上述研究类似的结论。在小鼠模型中,研究者也发现HBV感染能明显延缓幼年小鼠肠道菌群的成熟[9],而用广谱抗生素诱导出肠道菌群失衡后,成年小鼠的HBV清除明显被阻断,出现与幼年小鼠类似的HBV持续复制[10]。从慢性HBV感染进展到CHB,再到肝硬化,患者肠道菌群拟杆菌门和厚壁菌门逐渐减少,而变形菌门和放线菌门逐渐上升;此外肠道菌群组成与血液学和生化学指标如红细胞、血红蛋白、血小板、AST/ALT、白蛋白水平等明显相关[11]。上述研究提示CHB患者的肠道菌群发生明显改变,肠道菌群的变化可影响HBV复制,且与病情进展密切相关,因此肠道菌群有可能能成为CHB治疗的新靶点。
肠道菌群影响HBV清除和CHB病情进展的机制尚不明确。已有研究[12]显示获得性免疫应答在HBV清除中起着至关重要的作用,而天然免疫应答对于诱导随后的获得性免疫应答也同样十分重要。在幼年小鼠中,尚未成熟的肠道菌群可能通过Toll样受体4(Toll like receptor 4, TLR4)依赖的途径诱导HBV的免疫耐受[10]。研究者也发现肠道菌群失衡可损害肠道屏障功能,使得肠道菌群移位到肝脏,并通过增强程序性死亡受体1(programmed cell death protein 1, PD-1)的表达抑制肝脏T淋巴细胞抗病毒免疫应答,从而阻碍HBV的免疫清除[13]。胆汁酸的肝肠循环与肠道菌群的组成和功能相互影响,初级胆汁酸经胆管排泄进入肠道后,需经特定的肠道菌群转化为次级胆汁酸后重吸收回肝脏[14]。HBV感染可通过减少初级胆汁酸转化相关肠道菌群数量或抑制其功能来减少次级胆汁酸的生成,通过BA-FXR-FGF19轴进一步导致初级胆汁酸的异常积聚,最终使肝细胞和胆管细胞出现损伤和炎症,促进肝纤维化的发生,甚至导致肝硬化和肝癌[15-16]。除胆汁酸外,细菌代谢产物,如芳香族氨基酸、磷脂、短链脂肪酸等,也可能影响肝病进展[17-18]。
综上,HBV相关慢性肝病不同阶段的患者均存在不同程度的肠道菌群异常,肠道菌群及其代谢产物有可能通过影响胆汁酸转化及影响天然和获得免疫来影响HBV的清除及相关肝脏疾病进展。因此特征性肠道菌群的组合用于诊断、靶向肠道菌群用于治疗有望成为CHB相关肝病研究领域的热点。
2.2 肠道菌群与CHC 慢性HCV感染也是导致肝硬化、HCC的主要原因之一。世界卫生组织报告[19]称,全球约有5800万人感染HCV,2019年约有29万人死于HCV感染相关的肝硬化、HCC等终末期肝病。目前关于肠道菌群与CHC的研究较少且研究结果存在差异。有研究[20]显示HCV感染者的细菌多样性显著降低,表现为梭状芽胞杆菌、乳螺科和瘤胃球菌科减少,乳杆菌和链球菌增加,上述肠道菌群的变化与FIB-4指数明显相关。不同临床阶段的CHC患者经直接抗病毒药物(direct-acting antiviral agents, DAA)治疗获得持续病毒应答(sustained virological response, SVR)后其肠道菌群多样性得到明显恢复[21-22],且潜在致病菌(肠杆菌科、肠球菌和葡萄球菌)的丰度显著降低[23]。但也有研究[24]发现未经治疗的慢性HCV感染者相比健康对照组菌群多样性明显增加,表现为普菌属、琥珀酸弧菌属、铜绿假单胞菌等的丰度增加,而拟杆菌属、小杆菌属、链球菌属等的丰度降低。造成上述研究结果差异的具体原因尚不清楚,肠道菌群与CHC的相互关系、肠道菌群是否影响DAA的疗效等问题尚需进一步研究,在设计临床研究时需注意年龄、性别、BMI、饮食习惯、伴随疾病和疾病进展阶段等因素的影响。
2.3 肠道菌群与HBV相关慢加急性肝衰竭(ACLF) ACLF是发生在慢性肝病/肝硬化(先前诊断/未确诊)基础上的急性肝损伤,表现为黄疸和凝血障碍,可并发腹水和/或肝性脑病(HE)等并发症[25]。20世纪90年代,李兰娟院士团队[26]就发现HBV相关重型肝炎患者肠道微生态严重失衡,肠道双歧杆菌、拟杆菌等有益菌显著减少,肠杆菌科细菌、肠球菌、酵母菌等有害菌显著增加。而最近的研究[27]发现随着HBV-ACLF的病情进展,肠道微生物群落的多样性和丰度显著降低,肠道细菌及其代谢产物与血清生物标志物(如血清ALT、AST、TBil和INR)之间存在显著的相关性,提示肠道菌群失衡可能参与HBV-ACLF的进展。另有研究[28]发现肠球菌的富集与HBV-ACLF进展相关,而粪球菌的富集与HBV-ACLF缓解相关。这提示上述肠道菌群特征有可能成为有潜力的HBV-ACLF 预后标志物。
综上所述,HBV-ACLF患者肠道微生物存在显著的失衡,总体表现为整体多样性和丰度显著降低,肠杆菌科细菌等潜在致病菌显著升高,而拟杆菌等潜在有益菌降低,相应肠道菌群的改变与HBV-ACLF的进展与预后相关,靶向失衡的肠道微生态进行干预可能成为治疗HBV-ACLF的重要靶点。
3 靶向肠道菌群治疗CHB及其相关肝病
如前所述,大量研究的数据均表明:CHB、CHC及其相关肝病均存在肠道菌群改变,肠道菌群的改变可能影响病毒清除及疾病进展,因此靶向肠道菌群的策略也有可能用于CHB、CHC及其相关肝病的预防及治疗。靶向肠道菌群的策略主要有:不可吸收的抗生素、粪菌移植(fecal microbiota transplantation, FMT)、益生菌制剂和FXR激动剂等。目前上述策略用于肝硬化相关并发症如HE、自发性腹膜炎的治疗和预防的研究较多,但最近的研究也发现FMT可被用于CHB的治疗(图1)。
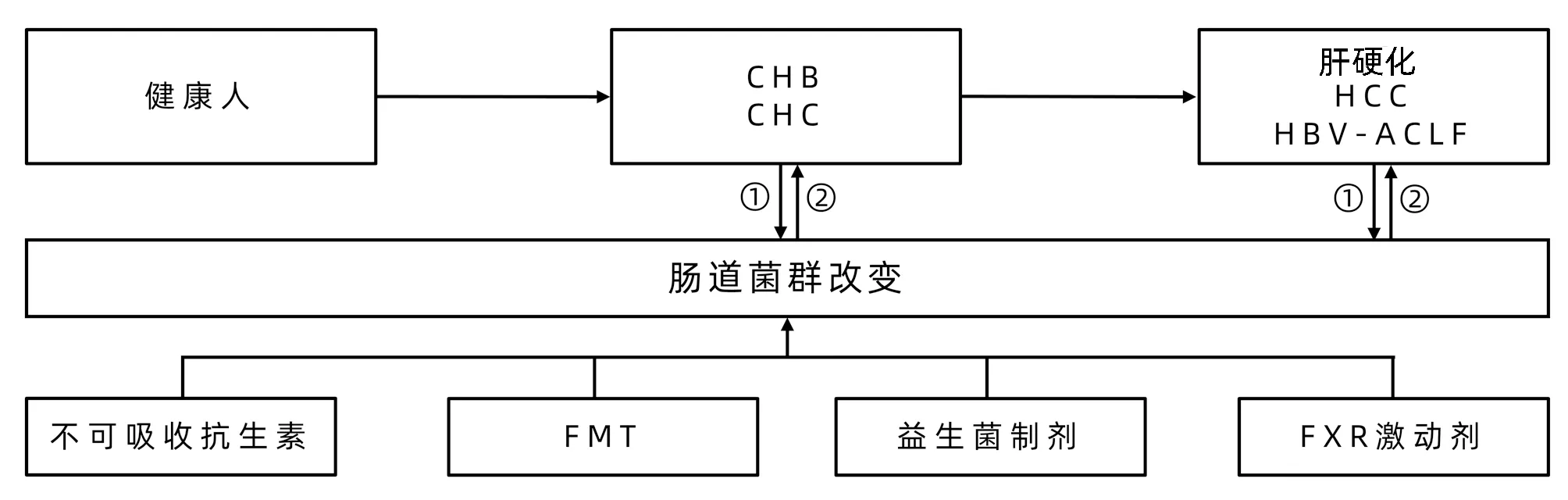
注:①肠道菌群参与慢性病毒性肝炎病情进展;②靶向肠道菌群用于治疗慢性病毒性肝炎及其相关肝病。
3.1 不可吸收性抗生素 用不可吸收的抗生素减少肠道菌群的负担从而治疗肠道菌群失衡相关的慢性肝病似乎是传统且合乎逻辑的方法。利福昔明是胃肠道几乎不可吸收的半合成广谱抗生素,通过结合细菌DNA依赖的RNA聚合酶的β亚基,从而抑制细菌RNA的合成而产生抗菌作用。利福昔明具有广谱抗菌作用,覆盖革兰阳性和革兰阴性菌,包括需氧菌和厌氧菌[29]。
目前利福昔明直接用于治疗CHB和CHC的研究较少,但其预防和治疗肝硬化所致HE的有效性和安全性已被大型随机临床试验证明[30]。除此之外,还有研究[31-32]表明利福昔明可以有效预防肝硬化患者自发性细菌性腹膜炎和静脉曲张破裂出血的发生。研究[33-34]表明利福昔明对肠道菌群的组成改变不大,其对抗病毒性肝炎所致肝硬化及其并发症的功能主要通过影响肠道菌群的代谢功能来发挥,包括有效减少内毒素血症、改变胆汁酸组成、改善患者认知和改变肠道菌群代谢组学等。目前利福昔明是否能用于病毒性肝炎及其他肝硬化并发症如门静脉高压等的治疗尚待进一步研究。
3.2 粪菌移植(FMT) FMT指将健康供者的粪便通过肠镜、饲管、吞入胶囊等方式植入患者的胃肠道中,来重建患者的肠道菌群,最早用于治疗艰难梭状芽孢杆菌性腹泻、炎症性肠病等肠道疾病,近年来用于肠道菌群失调相关肝病的研究亦正在开展。FMT可能是通过直接改变患者的肠道菌群组成,帮助其恢复肠-肝轴自稳和正常功能,进而达到改善病毒性肝炎及相关肝硬化所致HE症状的目的。
最近有两项临床研究[35-36]尝试将FMT用于治疗经长期核苷类似物抗病毒治疗但HBeAg仍阳性的CHB患者,结果显示FMT治疗可实现部分患者HBeAg和HBV DNA阴转,提示FMT治疗可能对控制病毒复制和清除HBeAg是安全有效的。即使这两项研究样本量相对较小,依然说明调节肠道菌群对CHB患者的治疗有一定意义,但未来需要开展更大规模的研究。
目前常用的FMT方式包括口服胶囊和直肠灌肠两种。经广谱抗生素预处理后通过灌肠进行FMT,能显著改善经乳果糖联合利福昔明治疗后仍有反复HE发作的肝硬化患者的肠道菌群组成和认知水平,并减少住院时间[37]。该研究团队后续的临床研究[38]发现,口服粪菌胶囊治疗上述患者也能取得很好的疗效。但考虑到FMT可能带来的诸如感染耐药菌等严重并发症[39],采用不同方式进行FMT治疗的安全性和有效性需要更严格的论证。
3.3 益生菌制剂 益生菌指当摄入足够数量时对宿主的健康起到有益作用的活的微生物,包括食物和膳食补充剂中含有的益生菌以及用于治疗和预防疾病的益生菌制剂。多种益生菌制剂主要是通过补充有益菌来改善肠道及肝脏功能,进而改善肝病症状及预后[40]。因其安全性和有效性,益生菌制剂在临床上被广泛用于治疗和预防HE[41]。一项双盲随机对照临床研究发现VSL#3用于治疗肝硬化时,患者HE等并发症的出现显著减少,Child-Turcotte-Pugh和终末期肝病模型评分得到显著改善[42]。类似地,应用益生菌制剂(含丁酸梭菌和婴儿双歧杆菌)治疗乙型肝炎相关肝硬化合并轻微HE患者,患者血氨水平降低,认知水平明显提高,这可能与肠黏膜屏障功能恢复有关[43]。目前益生菌制剂已被推荐用于包括HBV-ACLF在内的肝衰竭患者的辅助治疗[44],但尚需进一步的临床研究来明确其安全性和有效性。
3.4 FXR激动剂 钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide, NTCP)不仅是HBV进入肝脏的受体,同时也是牛磺胆汁酸的转运体[45]。FXR激动剂不仅能通过抑制初级胆汁酸的合成改变肠道菌群的数量或功能,同时有可能通过影响胆汁酸代谢竞争性抑制HBV与肝细胞表面的NTCP结合,减少病毒在肝脏的复制并降低血中胆汁酸浓度。事实上,FXR激动剂GW4064被发现能在体内和体外降低HBsAg和HBV DNA的表达水平[46]。这些研究均提示FXR激动剂有可能成为CHB治疗的新靶点。FXR激动剂奥贝胆酸治疗能降低人和小鼠内源性胆汁酸水平,改变人和小鼠肠道菌群组成;去除正常共生菌后奥贝胆酸的作用被削弱,提示正常的肠道菌群可能有助于奥贝胆酸取得更好疗效[47-48]。目前奥贝胆酸获批用于治疗原发性胆管炎[49],但在临床应用中是否对HBV复制水平产生影响尚未见相关报道。
4 结论
CHB、CHC常常伴随肠道菌群的改变,其特征主要包括潜在致病菌的增加和潜在有益菌的减少,而肠道菌群的改变可能通过多种机制影响病毒复制及参与疾病进展。虽然DAA的普及使得慢性HCV感染者的持续病毒学应答达90%以上,但CHB的临床治愈率仍不理想,且与他们相关的终末期肝病的病死率仍较高。最近FMT促进CHB HBeAg阴转的临床研究结果为靶向肠道菌群策略用于CHB的治疗带来了曙光。而靶向肠道菌群的多种策略包括不可吸收性抗生素、FMT、益生菌制剂和FXR激动剂在肝硬化相关并发症的成功应用,也为CHB、CHC及其终末期肝病的治疗提供了重要的参考价值。进一步阐明肠道菌群与慢性病毒性肝病之间相互作用及其机制、靶向肠道菌群在慢性病毒性肝病治疗中的价值,将为CHB、CHC及相关肝病的治疗提供更多可能。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:邓辉起草文章内容;张斌、朱彬、迪丽胡玛尔·扎依尔、王伟仙、郭春霞、杨东亮、郑昕、王俊忠参与文章框架设计与修改文章;王宝菊提供思路与框架,修改并校对文章。

