慢性肾脏病患者肾素-血管紧张素系统与血浆β-淀粉样蛋白相关性研究
王 萍,王文娟,杜 翔
(咸阳市中心医院,陕西 咸阳 712000)
阿尔茨海默病(Alzheimer’s disease,AD)是常见的痴呆类型,以β-淀粉样蛋白(Beta-amyloid peptide,Aβ)的沉积和神经元纤维缠结为主要的病理学特征,2018年世界流行病学调查登记的痴呆患者中AD占60%~80%,预计到2050年这一数字将翻3倍[1-2]。慢性肾脏病(Chronic kidney disease,CKD)也称为慢性肾衰竭,临床研究发现CKD患者容易出现认知功能下降,肾移植后CKD患者的认知功能可能得到改善。既往研究认为CKD患者多合并血管性痴呆,然而也有研究认为是合并AD,但大都基于简易精神状态评估(MMSE)、蒙特利尔认知评估(MOCA)等量表,未行AD特异性标志物检测。在慢性病流行病学登记调查的早期诊断和治疗中证明,CKD是AD的独立危险因素[3]。2010年中国CKD多中心研究[4]发现,50 550例CKD患者中AD增长率高达10.8%,发病率呈逐年上升趋势。CKD促进认知衰退的发展和AD的进展,且AD是CKD患者的重要并发症。研究[5]发现AD患者CKD的患病率约30%~60%。因为它可能导致医疗依从性缺失和健康管理素养的降低,是透析患者病死率的独立预测因子,所有这些指标都表明肾功能与痴呆症间可能存在联系。基于此,本研究以CKD患者为研究对象,检测血浆β淀粉样蛋白(Aβ)水平,探索两者之间的相关性。
1 对象与方法
1.1 研究对象 收集2019年6月1日至2021年7月1日入住我院肾病内科、神经内科的CKD患者33例,其中男性18例,女性15例;年龄50~75岁,平均(59.61±11.34)岁。病例纳入标准:①首次确诊CKD;②年龄大于18岁;③同意参加本研究,所有参与者均签署知情同意书。排除标准:①急性肾功能障碍者;②维持性透析者;③重症心、肺、肝功能障碍者;④急性感染或肿瘤者;⑤已经应用血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体阻断剂(ARB)者。同时选取健康体检者35例为对照组,其中男性15例,女性20例;平均年龄(61.64±10.91)岁。本研究通过咸阳市中心医院院内伦理委员会审批通过。
1.2 研究方法
1.2.1 一般资料:收集所有研究对象一般临床资料(包括性别、年龄)、生活方式(包括饮酒、吸烟)、共病(包括高血压、糖尿病)以及实验室检查指标(包括肌酐、尿素氮、二氧化碳、尿酸、胱抑素C)。
1.2.2 血浆肾素、血管紧张素Ⅱ含量检测:空腹抽取2 ml肘静脉血,采用全自动生化分析仪(C501,瑞典罗氏公司)检测肾素、血管紧张素Ⅱ的含量。
1.2.3 血浆Aβ水平检测:取3 ml肘静脉血,以3000 g离心15 min,于-80 ℃快速保存。使用RT-6000分析仪(深圳瑞拓公司),采用科研用酵素吸附微量检测试剂盒(ELISA法,批号:CEA946Hu L210407380、CEA864Hu L210407381,武汉云克隆有限公司)检测血浆中Aβ1-40、Aβ1-42水平,检测敏感度为1.0 pg/ml。在450 nm时,用标准曲线计算浓度。
1.3 观察指标 比较两组患者血浆Aβ1-40、Aβ1-42以及Aβ1-40/Aβ1-42水平,分析CKD患者各项指标与血浆Aβ的相关性。
2 结 果
2.1 两组一般资料及实验室指标比较 见表1。两组年龄与性别,以及吸烟、饮酒、糖尿病情况,二氧化碳水平比较,差异无统计学意义(均P>0.05)。CKD组高血压患病数高于对照组(P<0.05)。CKD组肾素、血管紧张素Ⅱ、肌酐、尿素氮、尿酸、胱抑素C水平均高于对照组(均P<0.05)。
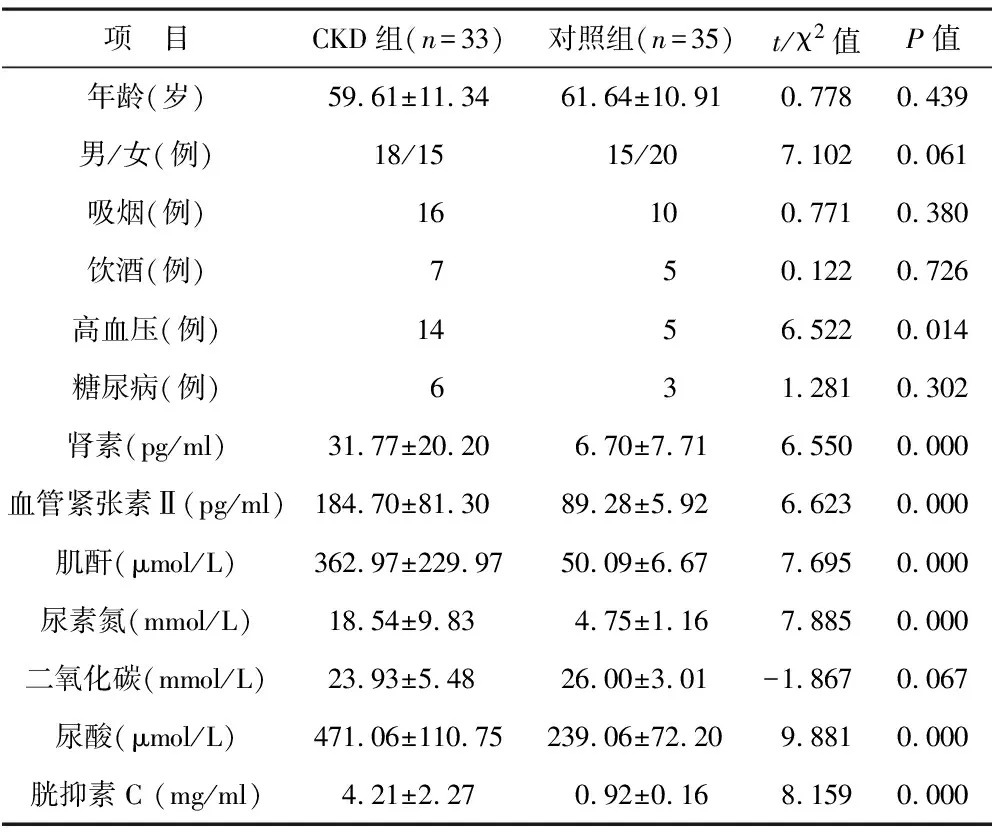
表1 两组一般资料及实验室指标比较
2.2 两组血浆Aβ1-40、Aβ1-42及Aβ1-40/Aβ1-42水平比较 见表2。CKD组Aβ1-40和Aβ1-42水平高于对照组,Aβ1-40/Aβ1-42低于对照组(均P<0.05)。
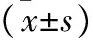
表2 两组血浆Aβ1-40、Aβ1-42及Aβ1-40/Aβ1-42水平比较
2.3 CKD患者相关指标与血浆Aβ相关性分析 见表3。分别以Aβ1-40、Aβ1-42、Aβ1-40/A1-42为因变量,以肾素、血管紧张素Ⅱ、肌酐、二氧化碳、尿素氮、尿酸、胱抑素C为自变量,进行多重线性回归分析。结果显示,CKD患者血管紧张素Ⅱ与Aβ1-40、Aβ1-40/A1-42呈负相关,与Aβ1-42呈正相关(均P<0.05);胱抑素C与Aβ1-40、Aβ1-40/A1-42呈正相关(均P<0.05);肌酐与Aβ1-40/Aβ1-42呈正相关性(P<0.05)。
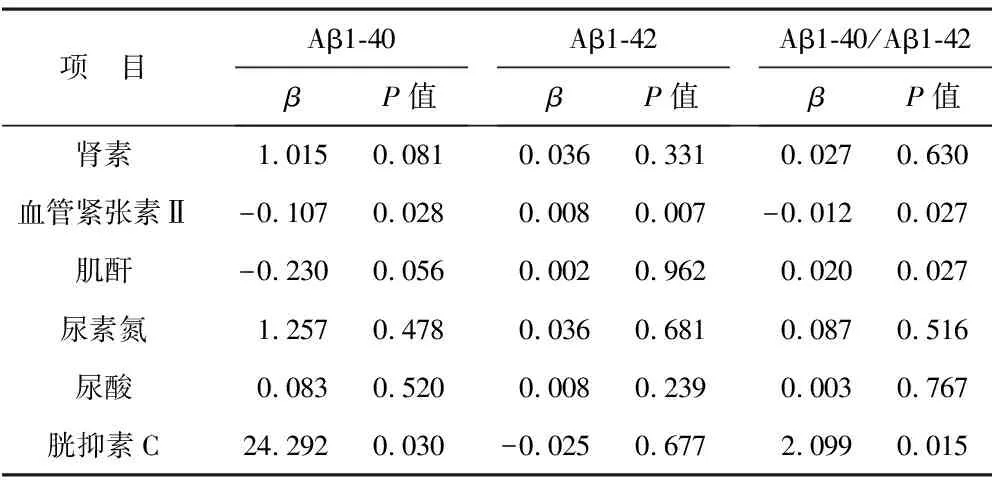
表3 CKD患者相关指标与血浆Aβ相关性
3 讨 论
AD的发生和演变与CKD分期呈密切相关。CKD患者血清Aβ水平升高,可能是由于这些患者血液中Aβ蛋白过量产生而肾功能损伤后清除率降低,使脑内Aβ沉积,导致了认知功能损害[6]。一项纳入54 779例患者的横断面和纵向研究荟萃分析[7]表明,CKD3期[估计的肾小球过滤率(eGFR)<60 ml/(min·1.73m2)]之后,eGFR值每减少10 ml,认知损害风险增加11%。此外,研究的另一部分显示,随着年龄的增长,认知能力的下降将加快CKD出现的时间。本研究中,CKD组血浆Aβ1-40、Aβ1-42、Aβ1-40/Aβ1-42与对照组相比,差异均具有统计学意义。
本研究发现,CKD组患者高血压的患病率远远高于对照组,不同于既往研究发现CKD患者糖尿病患病率更高,考虑与本研究入组的CKD患者长期肾功能衰竭且均未透析有关,CKD患者顽固性高血压与其肾素-血管紧张素系统持续激活及高血容量有关,在一项以西安市鄠邑区农村人群为基础的横断面调查研究[8]发现,70岁以上人群的收缩压≥160 mmHg,与认知障碍患病风险升高相关。
本研究发现,血管紧张素Ⅱ、肌酐、胱抑素C与血浆Aβ存在相关性。其中,血管紧张素Ⅱ、胱抑素C与Aβ1-40相关,而仅有血管紧张素Ⅱ与Aβ1-42有相关性;以Aβ1-40/Aβ1-42为因变量分析,发现CKD患者的血管紧张素Ⅱ、肌酐、胱抑素C与血浆Aβ1-40/Aβ1-42存在相关性,提示血浆Aβ1-40/Aβ1-42在数据分析时较单项Aβ1-40或Aβ1-42更有敏感性,同时也说明血管紧张素Ⅱ与Aβ密切相关。血管紧张素Ⅱ作为肾素-血管紧张素-醛固酮系统(RAAS)代表产物,CKD患者RAAS持续激活,使血管紧张素Ⅱ持续升高,故推测血管紧张素Ⅱ升高可促进Aβ沉积。血管紧张素Ⅱ主要分布于肺、心脏、心脏、肾脏、肾上腺和大脑,具有多种功能,如对所有血管都有血管活性,刺激肾上腺醛固酮释放参与维持钠-钾稳态刺激近端小管,刺激抗利尿激素(ADH),以及在认知过程(记忆和学习)中发挥作用[9-11]。RAAS激活会介导大脑水平的应答效应,RAAS受体已经在几个脑区被观察到,包括大脑皮质海马和扣带回皮质[6],对大脑功能稳定以及神经保护具有重要意义。血管紧张素Ⅱ是该系统的关键元素,其2型受体激活有助于控制脑循环、中枢交感神经活动、血脑屏障的完整性以及大脑固有免疫反应的调节,它也促进了AD的进展[12]。本研究目标人群为CKD患者,且纳入患者主要为CKD 3、4期未行血液透析的患者,随CKD病程进展,肾素分泌增多和肾小球纤维化、肾缺血,可持续性地激活RAAS,导致认知功能损伤,促进AD的发生与发展。体外实验[13]发现,ACEI可延缓Aβ聚集和沉积。有动物实验发现,通过给野生型小鼠喂食含腺嘌呤的食物诱导CKD,与正常野生型小鼠比较,CKD组表现出明显的认知障碍,推测CKD本身似乎加速了AD小鼠的认知损伤,血管紧张素Ⅱ受体阻滞剂奥美沙坦干预10周后发现,CKD对小鼠空间学习记忆功能的损害得到显著改善。
由于肾小球滤过率降低,CKD患者体内的毒素积聚。本研究发现,在尿毒症化合物中,肌酐和胱抑素C与血浆Aβ密切相关,有可能参与CKD患者的认知功能下降。研究[14]表明,肌酐可能是CKD患者脑萎缩和记忆下降的独立危险因素。在老年人群中,低肾小球滤过率与认知障碍和记忆丧失有关。而在血液透析后血浆Aβ减少或肾移植后CKD患者的认知功能可能得到改善。研究[7]证实,肌酐通过触发促炎细胞因子的表达以及Toll样受体4(TLR4)/核因子(NF)-κB通路的激活而增加大鼠海马胶质增生,抑制TLR4/NF-κB信号通路可显著改善肌酐诱导的海马炎症和认知能力下降。
胱抑素C不同于肌酐,似乎受肌肉质量的影响较小,仅由肾小球滤过清除,不受性别、年龄及生化指标等因素影响,可参与中枢神经系统的神经元变性和修复[15-16]。研究发现,胱抑素C与Aβ共同出现在AD脑组织淀粉样沉积物中,胱抑素C似乎可以与Aβ直接结合并抑制其活性聚集,从而直接保护神经细胞免受Aβ毒性。但另一方面,作为组织蛋白酶B的底物,它似乎对于Aβ降解具有竞争性作用。迄今为止,尚不清楚胱抑素C的脑沉积是否会直接导致脑损伤,但研究显示胱抑素C与AD存在关联。在AD患者的大脑中,发现胱抑素C在Aβ淀粉样变性中的作用,起保护或损害作用,观点不一。研究[7]发现,随着老年CKD患者肾功能的逐渐恶化和血清胱抑素C的逐渐累积,认知功能逐渐下降,血清胱抑素C是老年CKD患者认知功能损害的独立危险因素。但另有研究发现,血清胱抑素C水平与AD患者的病程呈负相关,在早期AD组血清胱抑素C水平更高,痴呆加重时胱抑素C水平则下降,推测胱抑素C在AD前期或早期可能起着保护作用,但随着AD病程进展,胱抑素C主要通过损害血管、促进细胞凋亡等方式加重脑损害及导致AD病情加重,而其保护作用微弱。Duan等[17]研究证实胱抑素C通过抑制糖原合成激酶3B细胞内转录促进tau蛋白纤维缠结及造成微管的不稳定性,从而加重晚期AD。本研究显示,CKD患者血清胱抑素C水平高于对照组,且与血浆Aβ有相关性,提示过高水平的血清胱抑素C可能参与AD的病理过程。综上,现有研究无法确定胱抑素C与AD之间的因果关系,但至少发现胱抑素C参与了AD病理过程,其作用机制复杂,对AD有保护或损害的双重作用,故推测血清胱抑素C水平可能是CKD患者预测AD的一个新的生物标志物。
除此之外,既往研究[18]发现AD患者的脑组织、脑脊液和尿液中还共同存在阿尔茨海默相关神经丝蛋白(AD7C-NTP),且AD组患者尿AD7C-NTP的含量显著高于非AD7C-NTP痴呆组及正常对照组。当尿AD7C-NTP含量为268.57 ng/L时,对应的灵敏度和特异度分别为83.3%和90.0%,故监测尿液中AD7C-NTP含量对AD的早期识别及尽早干预有着积极意义。但因其不属于临床常规化验,仅限于实验研究阶段,缺乏大样本临床研究证实。随着医学科技发展,有学者总结了AD的病理改变形成过程中的一些代表性的信号转导机制[19-20],如Wnt、MAPK及AKT信号通路等,但是现有的研究还仅停留在实验检测的水平上,尚无法普遍应用于临床。考虑到AD逐年升高的发病率现状,本研究从临床常见实验室检测项目入手,发现CKD患者的相关指标血管紧张素Ⅱ、肌酐、胱抑素C与血浆Aβ存在相关性,故大胆推测CKD患者持续的RAAS激活引起血管紧张素Ⅱ升高,可能促进了Aβ的沉积,而肌酐、胱抑素C的升高也可能使Aβ生成增多而清除减少,从而共同促进了AD的发生与发展。
综上所述,CKD患者RAS与血浆Aβ存在相关性,而Aβ沉积为AD的主要病理学特征,故CKD与AD密切相关。本研究数据来源于咸阳市中心医院收治尚未行血液透析的CKD患者,有较好的代表性及数据真实性。但本研究也存在不足:首先,住院患者合并症多,症状较重,存在局限性;其次,本研究是一个单中心研究,样本量小,存在选择偏倚,代表性偏低;最后,论证因果关系能力弱。因此,CKD患者各项指标与Aβ的相关性仍需大型、前瞻性、干预性研究进一步明确。

