震颤同系物-5过表达对卵巢癌细胞A2780增殖和凋亡的影响
段小霞,郭 华,付 婷,晋雅凌,周 卓
(1.陕西省第四人民医院妇产科,陕西 西安710043;2.西安市中心医院呼吸与危重症医学科,陕西 西安710004)
卵巢癌是常见的女性恶性肿瘤之一,因为其临床症状模糊和早期难以被及时诊断而被称为沉默的杀手[1]。截至2018年,每年卵巢癌新增病例约为240 000例,在女性恶性肿瘤发病率中位列第11位,而致死率位列第5位。在欧美国家40岁以上的女性中,卵巢癌是仅次于乳腺癌的第2大常见恶性肿瘤[2]。仅在美国,每年就有超过22 000例新增卵巢癌病例,其中14 000例癌症死亡患者与卵巢癌有关,而在我国卵巢癌的发病率和致死率也呈现逐年递增的趋势[3]。最新研究表明卵巢癌5年存活率仅为47.4%,这主要是因为超过50%的卵巢癌患者初诊时疾病已进展至晚期[4-6]。目前,卵巢癌的主要治疗手段仍然是手术及术后辅助化疗[7]。虽然在一定时间内延缓了病情的进展,但部分患者仍然面临疾病复发和转移的风险[8]。因此,探索更多、更有效的早期诊断生物标志物和治疗靶点对于改善卵巢癌预后和突破现有治疗手段的瓶颈具有重要意义。震颤同系物(Quaking homologue,QKI)属于RNA结合信号转导和RNA激活(Signals transductions activators of RNAs,STAR)蛋白家族成员[9]。QKI基因通过选择性剪接产生三种主要转录产物,分别是Quaking homologue-5,-6,-7(QKI-5、QKI-6、QKI-7)[10]。QKI-5是胚胎发生过程中表达的主要核同种型,其表达在出生后下降,而QKI-6和QKI-7同种型在胚胎发生的晚期表达,表达峰值出现在髓鞘形成过程中[11]。这些同种型由于过早的mRNA选择性剪接而具有不同的碳末端。既往研究表明QKI-5能够在多种肿瘤中发挥抗肿瘤活性。例如,QKI-5能够通过抑制内收蛋白3(Adducin 3,ADD3)第14外显子的剪接从而抑制肺癌细胞的增殖和迁移[12]。QKI-5甲基化水平的增高使得其在前列腺癌中表达水平异常降低,过表达QKI-5后前列腺癌细胞增殖出现延缓,同时凋亡率出现明显增加[13]。QKI-5在卵巢癌组织中也被证实出现异常的表达水平降低[14],但进一步阐述其在卵巢癌中抗肿瘤活性的相关研究还尚未见报道。综上所述,我们推测QKI-5很可能在卵巢癌的发生发展中发挥了一定的作用,因此本研究采用慢病毒介导的方式在卵巢癌细胞株A2780中扩增了QKI-5的表达丰度,通过一系列实验验证过表达的QKI-5对A2780细胞增殖和凋亡的影响,并初步地探讨了可能涉及的机制,为探索更多卵巢癌的治疗靶点提供了新的思路和理论基础。
1 材料与方法
1.1 实验材料 人卵巢癌细胞株A2780、SKOV3、HO-8910以及人正常卵巢上皮细胞株IOSE-80均为本院检验科实验室保存。洛斯维·帕克纪念研究所1640(Roswell park memorial institute 1640,RPMI 1640)培养基,胰酶均购自北京索莱宝科技有限公司,胎牛血清(FBS)购自杭州四季青生物有限公司。QKI-5单克隆鼠抗人抗体购自Sigma公司,多克隆兔抗鼠荧光二抗购自苏州宇恒生物科技有限公司,过表达QKI-5慢病毒购自广州辉园苑医药科技有限公司。蛋白裂解液购自北京百奥莱博科技有限公司,细胞增殖和毒性分析(Cell counting kit-8,CCK8)试剂盒购自上海尚宝生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养:液氮取出冻存细胞,37 ℃水浴锅复苏后800 r/min离心,弃上清后使用含10%FBS的RPMI 1640培养基重悬,平放于5% CO2、37 ℃恒温孵箱培养,间隔4 h观察细胞贴壁情况,待细胞生长至培养瓶底部面积90%时进行传代或冻存。
1.2.2 Western blot检测蛋白表达:取对数期生长细胞,常规消化离心后加入蛋白裂解液冰上裂解15 min,收集蛋白裂解液12 000 r/min离心10 min,弃上清液后取10 μg蛋白进行定量,其余蛋白样品放入-20 ℃保存。分别制备上下层胶,安装电泳设备后插入上下层胶,加入电泳液至上下层胶同水平层面,计算蛋白溶度后取蛋白样品加入,补齐体积后开始电泳。电泳结束后进行转膜,转膜时间1 h,硝酸纤维素(NC)膜苏木红染色,加入PBS摇床脱色3次,5 min/次。按目的条带位置选择合适比例裁剪NC膜,脱脂牛奶封闭5 h,洗脱后滴加一抗4 ℃过夜,荧光二抗室温孵育2 h,滴加显色液,发光仪采集蛋白条带图片,实验重复3次,记录灰度值强度并进行统计学分析。
1.2.3 慢病毒感染:为了充分验证实验效果和排除载体本身可能对实验结果产生的影响,将实验分为三组,分别是:空白对照组、空载体对照组和过表达QKI-5组。选取对数期生长细胞,常规消化离心后按照1×106细胞数量加入6孔板中,观察4~6 h待细胞完全贴壁后移除培养基。空白对照组中加入500 μl新鲜无血清培养基,空载体对照组中加入500 μl不具备过表达效果的空载体病毒原液,过表达QKI-5组加入500 μl慢病毒原液,各组均补充新鲜培养基至3 ml。常规孵育12 h后荧光倒置显微镜观察感染效率,移除培养液,更换新鲜培养基继续培养6 h。滴加杀瘟稻素进行筛选,重复上述步骤直至感染效率超过90%。通过Western blot观察目的基因表达水平变化以此验证稳定感染细胞株构建效果。
1.2.4 CCK8实验:首先将细胞悬液进行细胞计数,按照3×102个细胞数滴入96孔板中并用培养基补齐至150 μl,共设6个重复孔。实验分为三组:空白对照组、空载体对照组和过表达QKI-5组。常规条件下孵育1 d,各组待测孔中分别加入8 μl CCK8溶液,酶标仪450 nm处检测吸光度,记录数据。按上述相同步骤,分别在不同时间节点(第2、3、4、5、6、7 天)重复测量吸光度数值。统计测量数值并绘制增殖曲线。
1.2.5 平板克隆实验:实验分为三组:空白对照组、空载体对照组和过表达QKI-5组。按照实验预定分组分别制备细胞悬液进行细胞计数后,6孔板中按照2×102细胞数加入细胞悬液。新鲜培养基补齐至5 ml,放入恒温孵箱孵育。12 h观察一次确定细胞正常孵育,每2 d更换一次新鲜培养基,7 d后停止孵育。吸弃培养基,细胞固定液室温条件下固定15 min,自然干燥后吉姆萨染液染色30 min,自来水轻柔漂洗2次,采集图片后计算每孔中克隆菌落的数量进行统计学分析。
1.2.6 凋亡检测:收集对数期生长细胞,PBS洗脱培养基后制备细胞悬液。实验分为三组:空白对照组、空载体对照组和过表达QKI-5组,按照实验预定分组分别进行细胞计数后按照2×105个细胞数加入各组。每组细胞样品中加入膜联蛋白-V(Annexin-V)6 ml和碘化丙啶(PI)12 ml避光染色15 min,流式细胞仪检测细胞凋亡率,FLOWJO软件生成图像并进行统计学分析。
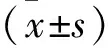
2 结 果
2.1 不同卵巢癌细胞株中QKI-5表达水平比较 与正常卵巢上皮细胞IOSE-80相比三株卵巢癌细胞中QKI-5的表达水平明显减少。在三株癌细胞中QKI-5的表达水平从高至低依次为SKOV3、HO-8910、A2780(均P<0.05)。因此,选择QKI-5相对表达水平最低的A2780进行过表达慢病毒感染。见图1。
注:与IOSE-80比较,*P<0.05,△P<0.01
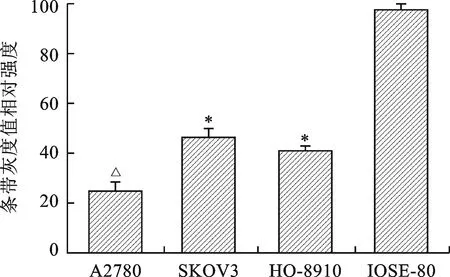
2.2 构建稳定过表达QKI-5的A2780细胞 慢病毒感染及杀瘟稻素进行筛选后构建了稳定过表达QKI-5的A2780细胞,通过Western blot实验检测感染效果,实验结果显示:与空白对照组及空载体对照组相比,过表达QKI-5组中QKI-5基因的表达水平显著增高(P<0.01),见图2。
注:与空白对照组比较,△P<0.01
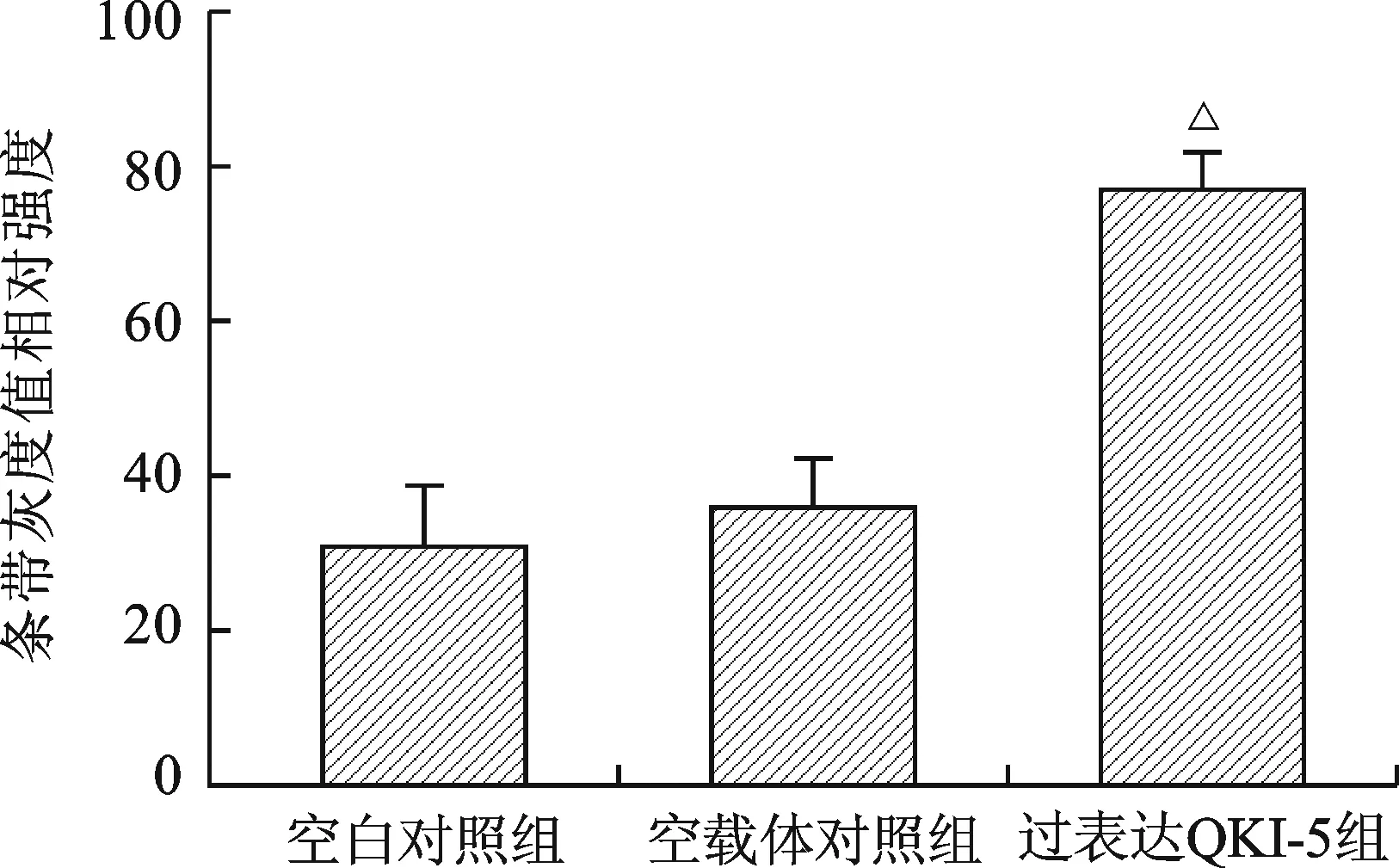
2.3 过表达QKI-5对A2780细胞增殖的抑制作用 为了验证过表达QKI-5对A2780细胞增殖的抑制作用,采用CCK8实验进行检测,实验结果显示:与空白对照组和空载体对照组相比较,过表达QKI-5组细胞增殖出现了明显抑制(P<0.01)。随着时间的延长这种增殖抑制效应呈现更加显著的趋势。见图3。
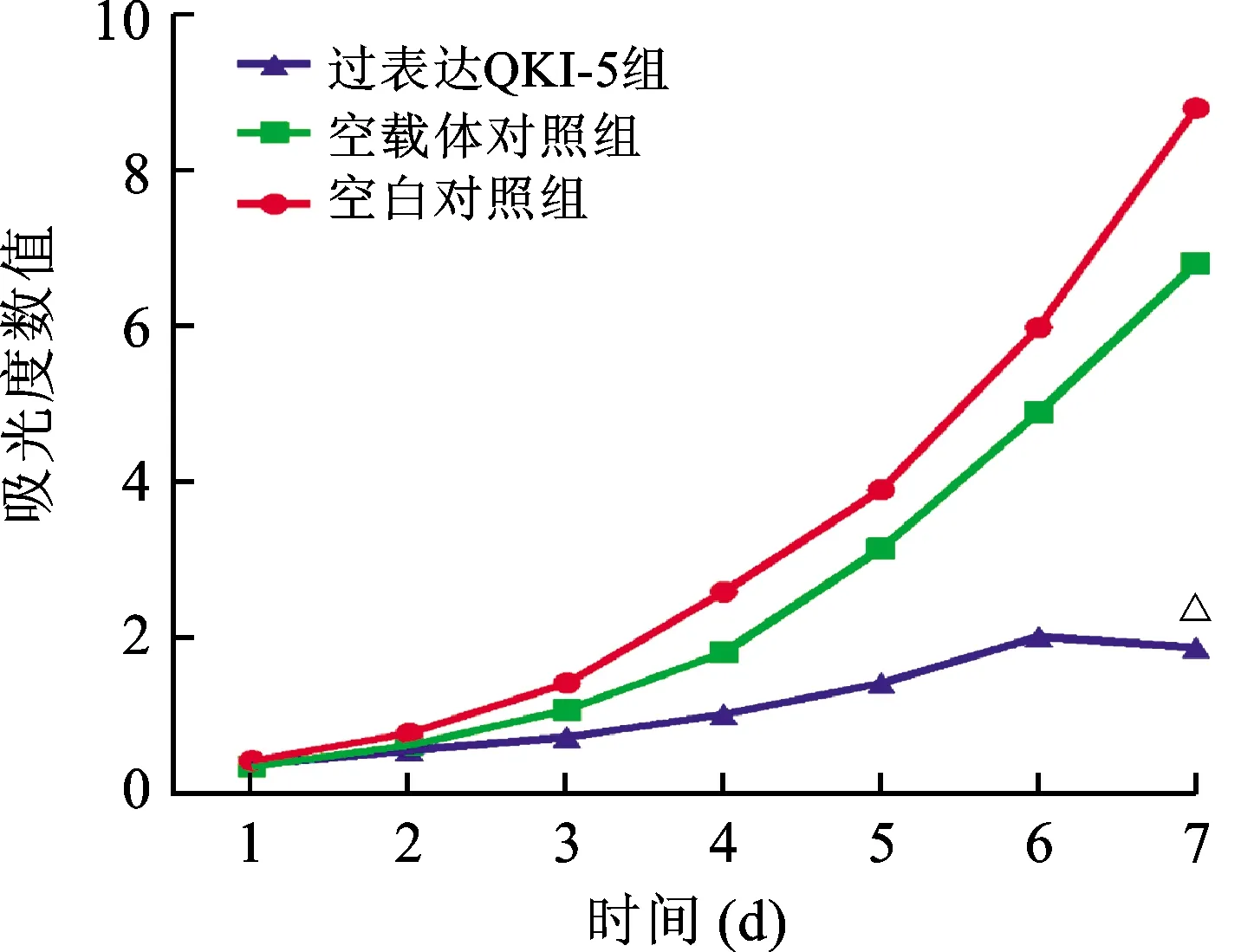
注:与空白对照组比较,△P<0.01
2.4 过表达QKI-5对A2780细胞克隆形成的影响 平板克隆实验结果显示:过表达QKI-5组的克隆形成率为(29.33±5.79)%,空载体对照组为(65.67±6.34)%,空白对照组为(62.00±6.38)%。过表达QKI-5组的克隆形成率相对比两个对照组出现了明显的抑制(P<0.001),而空载体对照组和空白对照组之间差异无统计学意义(P>0.05)。见图4。
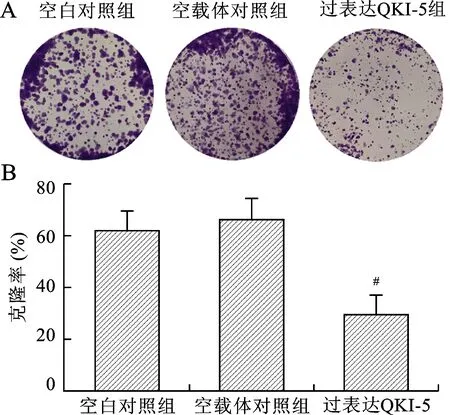
注:与空白对照组比较,#P<0.001
2.5 过表达QKI-5能够增加A2780细胞的凋亡率 流式细胞仪检测不同实验组间的细胞凋亡率差异,实验结果显示:过表达QKI-5组的细胞凋亡率为(7.10±0.455)%,空载体对照组为(3.13±0.805)%,空白对照组为(2.87±0.330)%。分别将过表达QKI-5组的细胞凋亡率与其他两组进行比较,结果显示过表达QKI-5组的细胞凋亡率相比其他两组出现增高趋势(P<0.05),提示过表达QKI-5可以增加卵巢癌细胞A2780的凋亡水平。见图5。
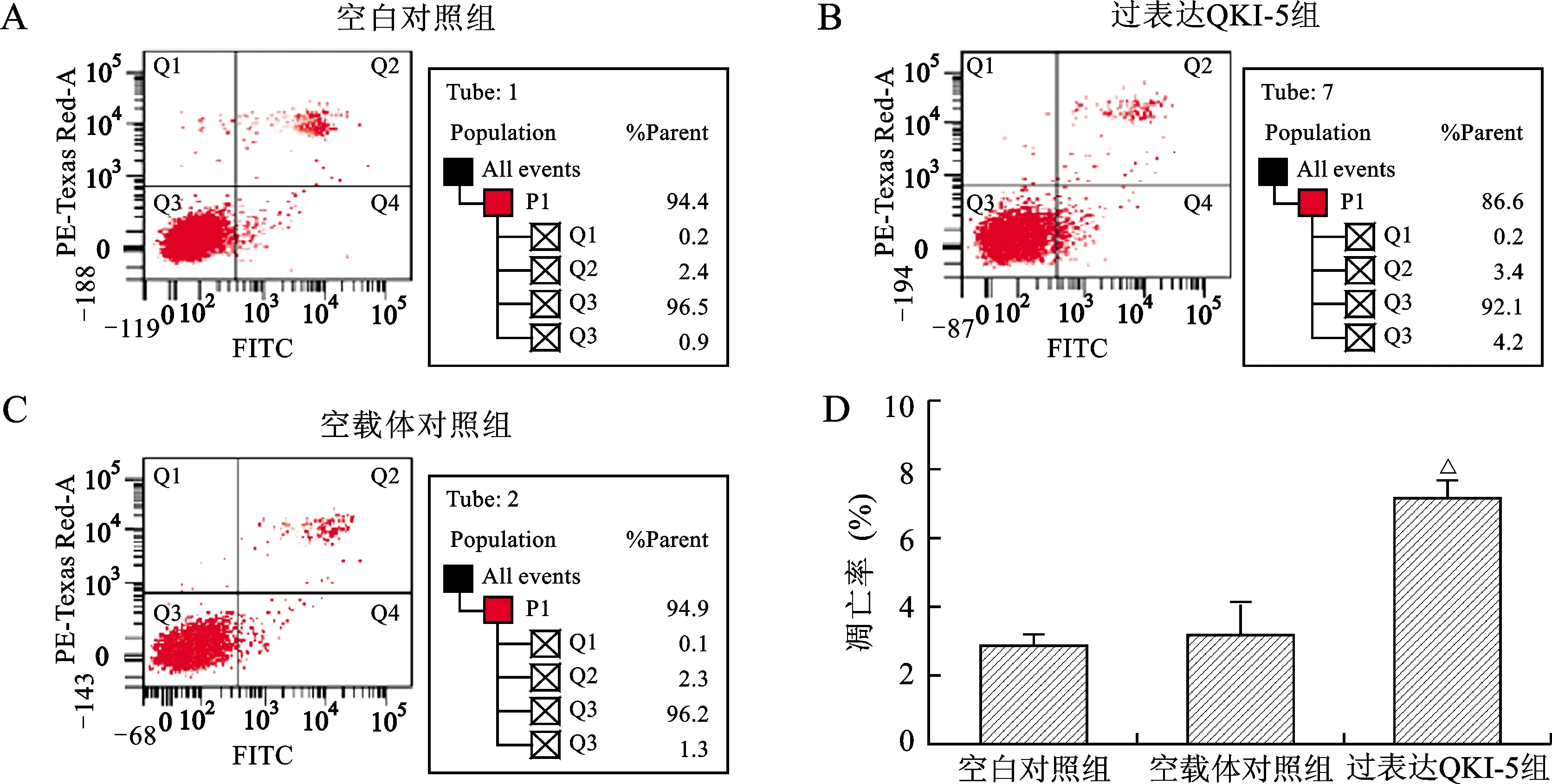
注:与空白对照组比较,△P<0.01
3 讨 论
卵巢癌的早期诊断和现有治疗方法的突破目前仍然是临床难题,超过50%的卵巢癌患者在初诊时已经处于疾病晚期[15-17]。而晚期卵巢癌患者更容易出现广泛的腹部转移从而具有较高的病死率。尽管采用现代治疗方法,相当一部分女性获得完全缓解,但大多数晚期疾病患者将在18个月内复发。早期的诊断和有效的筛查对于降低卵巢癌病死率具有积极的意义。然而,目前尚不存在早期发现卵巢癌的有效筛查策略,但存在卵巢癌高危人群,例如乳腺癌1号基因(Breast cancer 1,BRCA1)或乳腺癌2号基因(Breast cancer 2,BRCA2)或其他与卵巢癌高风险相关的基因的种系突变。对于此类人群,降低卵巢癌风险的策略是通过低风险的手术来实施的,例如双侧输卵管卵巢切除术(切除卵巢和输卵管)。对卵巢癌平均风险女性的筛查策略主要集中在生物标志物CA125和经阴道超声检查的使用上。这些筛查模式的组合已显示出在检测早期癌症方面的优势,但尚未证明患者病死率的确切改善。此外,近年来卵巢癌的诊疗技术也取得了一定的进展,但患者5年生存率仍然不足50%,严重威胁着女性生命健康[18-19]。在肿瘤领域随着诊断技术和治疗靶点的不断进步和发展,越来越多的生物标志物和治疗靶点被应用于临床并取得了良好的诊疗效果,例如在卵巢癌中同时阻断程序性死亡受体1(Programmed cell death protein 1,PD-1)和细胞程序性死亡-配体1(Programmed cell death 1 ligand 1,PD-L1)免疫检查点能够增强高级别浆液性卵巢癌中的疗效。PD-1及其配体PD-L1是刺激免疫检查点通路的分子,以此为靶点的免疫治疗整合和改变了既往非小细胞肺癌的治疗方式,对患者产生了快速的治疗反应并延长了患者的生存时间。此外还有例如黑色素瘤、肾癌等多种肿瘤中以PD1,PDL-1为靶点的免疫治疗的应用,以及乳腺癌中针对人表皮生长因子受体-2(Human epidermal growthfactor receptor 2,HER2)基因的靶向治疗等[20]。关于如何寻找早期诊断卵巢癌的生物标志物和探索有效的治疗靶点一直都是卵巢癌研究领域的关注热点。
RNA结合蛋白QKI属于RNA蛋白家族的信号转导和激活STAR家族成员之一,是一个关键的转录后调节因子,参与多种癌症调节机制,包括胃癌、乳腺癌和前列腺癌等。最近的研究结果表明,QKI-5的基因组缺失增加了癌细胞的增殖和去分化,这表明QKI-5是许多癌症类型的肿瘤抑制因子。结合既往的研究结果,RNA结合蛋白QKI-5已被证实在多种癌症表现出抗肿瘤活性,是一个潜在的候选抑癌基因。QKI-5表达水平的变化与前列腺癌细胞的增殖、分化以及细胞周期阻滞密切关联,同时高表达QKI-5的前列腺癌患者拥有更好的预后[13]。此外,QKI-5还能够通过MAPK信号通路抑制Cyclin D1的表达从而抑制口腔鳞癌细胞的增殖[21]。在卵巢癌中QKI-5的表达水平也出现了异常的降低,并且这种表达水平的降低与卵巢癌分期分级等临床病理特征密切关联。在我们的研究中,首先与正常卵巢细胞相比三株卵巢癌细胞中QKI-5的表达水平都出现了降低,这与前期的研究结果相一致。选取QKI-5表达水平相对最低的A2780细胞作为过表达慢病毒感染的对象,通过慢病毒感染和杀瘟稻素进行筛选最终成功构建了稳定过表达QKI-5的A2780细胞系。CCK8和平板克隆实验结果表明,过表达QKI-5能够显著抑制A2780细胞的增殖和克隆形成能力。而流式细胞仪凋亡检测证实,过表达QKI-5能够促进A2780细胞的凋亡水平。
综上所述,本研究证实了在相对低表达QKI-5的卵巢癌细胞A2780中扩增RNA结合蛋白QKI-5后,A2780细胞的增殖和克隆能力出现了明显的抑制,而细胞的凋亡水平则出现了显著的增高。卵巢癌细胞的增殖在细胞学和分子水平被证实得到了抑制,这为卵巢癌的治疗提供了新的靶点和理论基础。

