3-磷酸肌醇依赖性蛋白激酶1基因敲除对心肌梗死诱导心力衰竭小鼠心血管重构的影响及其机制研究
王 磊,王海强
(1.西安市中心医院心内科,陕西 西安 710004;2.空军第九八六医院心血管内科,陕西 西安 710054)
心肌梗死(Myocardial infarction,MI)是指因冠状动脉出现阻塞,心脏肌肉因急性、持续性缺血缺氧所引起的心肌坏死,是最严重的一种心脏病,常导致猝死,严重威胁人类健康[1-2]。流行病学研究[3-4]发现,在全球范围内MI的发病呈现逐年上升的趋势,并且急诊科接收的胸痛患者中约10%被确诊为MI。在中国,每年约新发急性MI患者70万例,尽管全国各级医院心痛中心的建立极大降低了MI的病死率,但MI患者病死率仍高达30%[5]。引起MI患者死亡的主要原因是,在发病早期约25%的患者临床症状不明显,未能及时引起患者的重视,到院后确诊也较困难[5]。此外,研究[6-7]表明,MI患者发展为心力衰竭的风险是非MI患者的8倍,约20%~68%存活的MI患者会继发心力衰竭,心力衰竭是造成MI患者死亡的重要诱因之一。因此,研究MI后心力衰竭发生发展的分子机制对降低MI后心力衰竭的发生率,延缓MI患者的生命意义重大。3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1,PDK1)是AGC蛋白激酶家族中的重要一员,其位于AGC蛋白激酶家族的上游,调控该蛋白激酶家族下游多个成员的转录,包括磷酸化核糖体S6蛋白激酶、蛋白激酶B以及叉头框蛋白O等,而该蛋白激酶家族中的多个因子被证实参与心脏心力衰竭和心血管重构的发生发展[8]。此外,研究[9]发现,PDK1参与调控细胞各种生命活动,包括增殖、分化、凋亡、坏死、迁移以及侵袭等,并且在心脏中特异性敲除PDK1可通过诱导心肌细胞凋亡和心脏结构的改变而导致心力衰竭。然而,目前尚无PDK1表达对MI诱导的心力衰竭小鼠心血管重构影响的研究报道。因此,本研究通过比较心脏PDK1特异性敲除对MI诱导的心力衰竭小鼠心电图、血流动力学和心室重构的影响,以研究PDK1基因敲除对MI诱导的心力衰竭小鼠心血管重构的影响,并探讨其分子机制。
1 材料与方法
1.1 实验动物 35只昆明小鼠(8周龄,雄性,18~22 g),SPF级别,购买自赛业生物科技有限公司[SCXK(粤)-2021-0005],分为对照组15只,模型组20只,对模型组小鼠制作MI模型。另外20只心肌组织PDK1基因敲除昆明小鼠为PDK1组(8周龄,雄性,18~22 g),SPF级别,购买自赛业生物科技有限公司。所有小鼠均饲养在正常昼夜环境中(光照12 h/d),室温控(23±3)℃,相对湿度50%,饮用水为纯净水。本研究所有动物操作都符合伦理要求,且研究得到了动物伦理委员会的批准。
1.2 主要仪器与试剂 酶标仪(型号Infinite-F50,瑞士TECAN公司),电子天平(型号BT25S,德国赛多利斯),动物心电图机(型号DE12-Vet,江苏大为宠物医疗有限公司),戊巴比妥钠(货号150205,美国西格玛),鼠脑钠肽(BNP)检测试剂盒(货号ab193694,ABCAM公司)、鼠肿瘤坏死因子-α(TNF-α)检测试剂盒(货号ab208348,ABCAM公司)、鼠白细胞介素质1β(IL-1β)检测试剂盒(货号ab197742,ABCAM公司)和鼠白细胞介素10(IL-10)检测试剂盒(货号ab255729,ABCAM公司)。
1.3 实验方法
1.3.1 MI诱导建立心力衰竭模型:将模型组和PDK1组的小鼠经腹腔注射戊巴比妥钠麻醉后,暴露气管和心脏,在距离小鼠左心耳尖端2 mm处,结扎小鼠左冠动脉前降支,观察心肌组织变白,且心电图ST段显著抬高,持续时间为10~15 min,即可证明心力衰竭模型建立成功。对照组小鼠仅开胸而不结扎动脉。术后1周,模型组存活15只,PDK1组存活15只,对照组存活15只,继续饲养3周。
1.3.2 心电图检测:术后4周,腹腔注射戊巴比妥钠麻醉小鼠,麻醉后的小鼠取仰卧位固定,连接小动物心电图机器测量小鼠心电图指标P波、QRS波宽度、S波。
1.3.3 血流动力学检测:术后4周,各组小鼠在完成心电图测量后,去除心电图仪,暴露并分离小鼠右颈总动脉,使用5-0丝线结扎远心端右颈总动脉,同时使用手术剪刀在右颈总动脉处制作一个V型缺口,插入血流动力学仪器检测导管持续记录2~5 min平稳信号波形,测量并记录血流动力学指标:左心室收缩压(LVSP)、左室舒张末压(LVEDP)、左室最大压力下降速率(-dp/dtmax)和左室最大压力上升速率(+dp/dtmax)。
1.3.4 心室重构指标:术后4周,腹腔注射戊巴比妥钠麻醉小鼠,测量小鼠体重(g),完成心电图和血流动力学检测后,通过颈椎脱臼安乐死小鼠,然后分离小鼠心脏组织并测量心脏组织重量(mg),计算心重指数,心重指数=心脏重量(mg)/小鼠体重(g)。小鼠心脏组织经苏木素-伊红染色后在电子显微镜下测量心肌细胞横截面积。
1.3.5 血清和心肌组织炎性因子及BNP含量检测:术后4周,断尾取小鼠外周血,离心以收集血清,通过Elisa检测试剂盒测量小鼠血清BNP、TNF-α、IL-1β、IL-10含量。取小鼠部分心脏组织,组织匀浆后离心收集组织匀浆上清液,然后采用Elisa检测试剂盒测量小鼠心肌组织BNP、TNF-α、IL-1β和IL-10含量。
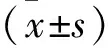
2 结 果
2.1 三组小鼠心电图指标比较 见表1。与对照组相比,模型组和PDK1组小鼠心电图均出现异常改变,S-T段升高明显,其中P波高度和QRS波宽度显著降低(均P<0.05),而P波宽度、S波宽度和高度均显著升高(均P<0.05);与模型组相比,PDK1组小鼠心电图S-T段明显升高,其中P波高度和QRS波宽度显著降低(均P<0.05),而P波宽度、S波宽度和高度均显著升高(均P<0.05)。
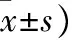
表1 三组小鼠心电图指标比较(¯
2.2 三组小鼠血流动力学指标比较 见表2。与对照组比较,模型组和PDK1组血流动力学指标LVEDP显著升高(P<0.05),而LVSP、+dp/dtmax和-dp/dtmax均显著降低(均P<0.05);与模型组相比,PDK1组血流动力学指标LVEDP显著升高(P<0.05),而LVSP、+dp/dtmax和-dp/dtmax均显著降低(均P<0.05)。
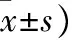
表2 三组小鼠血流动力学指标比较(¯
2.3 三组小鼠心室重构指标比较 见表3。与对照组小鼠相比,模型组和PDK1组小鼠心重指数、心肌细胞横截面积均显著升高(均P<0.05),并且PDK1组小鼠心重指数、心肌细胞横截面积均显著高于模型组小鼠(均P<0.05)。
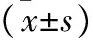
表3 三组小鼠心室重构指标比较
2.4 三组小鼠血清和心肌组织炎性因子及BNP含量比较 见表4、5。与对照组小鼠相比,模型组和PDK1组小鼠血清和心肌组织TNF-α、IL-1β和BNP均显著升高(均P<0.05),而IL-10含量却显著下降(P<0.05)。此外,PDK1组小鼠血清和心肌组织TNF-α、IL-1β和BNP均显著高于模型组小鼠,而IL-10含量却显著低于模型组小鼠(均P<0.05)。

表4 三组小鼠血清炎性因子及BNP含量比较(ng/ml)

表5 三组小鼠心肌组织炎性因子及BNP含量比较(ng/ml)
3 讨 论
心力衰竭是一种严重威胁生命的疾病,特别是心肌梗死后心力衰竭大大增加患者的病死率。国内外数据均显示,心梗后心衰的发生率呈上升趋势。基于中国人群的数据显示,ST段抬高型心梗(ST segment elevation myocardial infarction,STEMI)患者心梗后7 d内心衰的发生率为19.3%[10]。而研究提示,心梗后心衰的发生可显著增加患者短期及长期不良事件风险。数据显示,在接受冠脉介入治疗的STEMI患者中,出院后第1年内发生心衰者的5年累积全因死亡(36.3%与10.1%)、心衰住院(40.4% 与4.3%)、心血管死亡(19.1%与3.3%),风险均明显高于未发生心衰的患者[11]。传统改善心肌收缩力的药物,诸如β肾上腺素能受体激动剂,磷酸二酯酶抑制剂等,尽管可以改善患者症状,但也增加患者远期死亡风险,因此迫切需要研发更加安全有效的药物[6-7]。
本研究发现,与野生型心肌梗死诱导的心力衰竭小鼠相比,心脏PDK1特异性敲除的心肌梗死诱导的心力衰竭小鼠心电图S-T段异常改变更加明显,表明心脏PDK1特异性敲除加重心肌梗死后心力衰竭小鼠心电重构,这与牛燕等[9]的研究结果一致。牛燕等[9]研究发现,心脏PDK1特异性敲除可诱发心衰,其机制可能与通过影响代谢重构而影响心脏功能或心脏重构有关。心肌梗死后心室重构将影响心脏的收缩功能和舒张功能、心脏瓣膜功能以及其他心脏并发症,比如心肌瘢痕和心室壁血栓。血流动力学是指血液在心血管系统中流动的力学,主要研究血流量、血流阻力、血压以及它们之间的相互关系,其可被用于评估心功能和血流灌注[12]。本研究发现,PDK1组血流动力学指标LVEDP较模型组显著升高,而LVSP、+dp/dtmax和-dp/dtmax较模型组均显著降低,表明PDK1组小鼠心功能较模型组差。进一步分析可知,PDK1作为AGC蛋白激酶家族的一员,其功能与AGC蛋白激酶家族类似;之前的研究[9]表明,PDK1缺乏表达的小鼠心肌收缩功能将出现下降,并对缺血缺氧的敏感性增强,被证实与多种心脏疾病(心律失常、心力衰竭和心肌扩张)的发生发展有关。而在心肌梗死后,由细胞因子或激素等刺激引起的病理性心肌肥厚可诱发心脏收缩功能和舒张功能异常[13-14]。结合本次研究可知,心脏PDK1特异性敲除加剧了心肌梗死后引起的心脏功能异常。
现有的研究[15]表明,缺氧引起的心肌细胞凋亡或坏死是导致心肌梗死后心室重构和心力衰竭的重要原因,而心室重构是心力衰竭发生的基本病理过程。本研究比较PDK1表达对心肌梗死后心力衰竭小鼠心室重构的影响,结果显示:PDK1组小鼠心重指数、心肌细胞横截面积均显著高于模型组小鼠,表明PDK1心脏特异性敲除加重心肌梗死后心力衰竭小鼠心脏肥大和心肌肥厚,即加重心室重构。心梗后凋亡及坏死的心肌细胞引起免疫损伤,触发严重的炎性反应,加重组织功能受损,直接导致一系列病理生理改变,加重心脏重构,最终导致心衰[16-17]。为进一步研究PDK1敲除加重心肌梗死诱导的心力衰竭小鼠心血管重构的机制,本研究比较PDK1敲除对心肌梗死后心力衰竭小鼠炎症因子的影响,结果显示:PDK1组小鼠血清和心肌组织TNF-α、IL-1β和BNP均显著高于模型组小鼠,而IL-10含量却显著低于模型组小鼠,表明PDK1心脏特异性敲除加重心肌梗死后心力衰竭小鼠体内炎性反应。进一步分析可知,心肌梗死后受损的心肌组织愈合被分为炎症阶段、修复阶段和愈合阶段,而过重的炎症不仅不会促进组织愈合,而且加重组织损伤和延缓修复阶段的到来,TNF-α和IL-1β是体内重要的促炎因子,而IL-10是重要的炎症因子合成抑制剂[18-19]。BNP由心肌细胞合成并分泌的激素,是表征左心室功能的生物标志物,同时在临床上也被用于心力衰竭的诊断和严重程度的评估[20]。结合本文研究结果表明,PDK1基因敲除通过加重炎性反应而加重心肌梗死后心肌损伤,进而加剧心肌梗死后心力衰竭小鼠心血管重构。
综上所述,PDK1基因敲除加重心肌梗死诱导的心力衰竭及心血管重构,其机制可能与PDK1基因敲除加重炎性反应有关。

