参芍口服液抑制NLRP3炎症小体改善创伤性脑损伤小鼠炎性反应实验研究
李宝福,刘柏麟,袁 兴,郝璞珩,邓齐奇,孙皖秦
(西安国际医学中心医院神经外科,陕西 西安 710100)
创伤性脑损伤(Traumatic brain injury,TBI)具有患病率高、病情多变、致死致残率高的特点;且因其治疗费用昂贵,伤后多发终身性认知障碍,预后较差,严重影响患者生活质量,一直以来给患者家庭和社会带来沉重负担,是临床实践与公共卫生事业中亟待突破的问题之一[1-2]。TBI由原发性损伤和继发性损伤组成;继发性损伤的病理机制复杂,包括脑水肿、兴奋性毒性、钙超载、线粒体功能障碍、氧化应激反应及炎性反应等[3];伤后初期的神经炎性反应对神经组织的恢复起积极作用,但后期强烈的炎性反应又会对组织造成伤害[4]。参芍口服液在临床上主要用于冠心病的治疗,有降低血稠,增加冠脑血流量的作用[5];近期也有研究指出参芍口服液对部分炎性反应有治疗效果,如参芍口服液可以减轻小鼠2型糖尿病引起的肝脏和心肌的炎症损伤等[6-7];但是目前有关参芍口服液是否能对TBI的继发性炎性反应发挥作用的研究仍未见报道,因此本文旨在探讨参芍口服液对TBI后炎性反应的作用,并尝试解释其机制。
1 材料与方法
1.1 实验动物 实验动物为空军军医大学动物实验中心8~10周龄C57雄性小鼠54只,体重20~24 g,饲养时保持室温20~25 ℃,湿度40%~60%,每日光照12 h,不限食水;预先适应性饲养2周。
1.2 实验方法
1.2.1 实验分组:54只C57小鼠完全随机分为三组:假手术组(Sham组)、TBI组和参芍口服液组(SS组);每组中,6只用以评估改良的神经功能评分和受损组织中的细胞凋亡情况,6只用于酶联免疫吸附法检测炎症因子表达水平,6只用于蛋白印迹法检测NLRP3炎症小体通路相关蛋白NLRP3、Caspase-1的表达情况。
1.2.2 模型建立:小鼠称重后,制作小鼠控制性皮层损伤(CCI)模型,选用10%水合氯醛作为麻醉剂,注射入小鼠腹腔进行麻醉。将麻醉后的小鼠俯卧置于立体定位仪上,对小鼠头部备皮剃毛,在头皮正中剪开长1.2 cm的切口,取前囟点与后囟点正中左侧4 mm为圆心,钻开直径5 mm的圆形骨窗。将撞击锤的打击头放在骨窗内,注意不要损伤硬脑膜。设置打击参数:打击深度2 mm,打击角度垂直于脑皮质表面,速度2 m/s,接触时间100 s,打击头直径4 mm。打击致伤后还纳骨瓣,缝合创口。Sham组钻开骨窗后即还纳骨瓣。模型建立6 h后,SS组给予5 ml参芍口服液灌胃干预,Sham组和TBI组用等量0.9%氯化钠溶液灌胃,各组均持续7 d。
1.2.3 mNSS神经功能评分:于处理后第1、3、7天,对小鼠神经功能进行mNSS评分,依次进行运动、感觉、反射和肌张力实验,分数越低则说明该小鼠的神经功能缺损程度越轻。
1.2.4 ELISA检测炎症因子的含量:模型建立后第7天,取小鼠损伤区脑组织,低温下加入PBS溶液匀浆,以适量超纯水制备肿瘤坏死因子-α(TNF-α)、白介素1β(IL-1β)、IL-18的标准品溶液,进行样品稀释,预实验后按梯度将样品加入酶标板,室温孵育1 h后洗涤3次。加入适宜量的对应二抗,室温孵育1 h。加入Sterptavidin-HRP室温避光孵育30 min,加入TMB Substrate室温避光孵育30 min,最后加入Stop solution终止反应,在试剂盒指示波长处进行OD值检测。用全波长扫描式读数仪进行检测。用Skan It软件读取样品光吸度收原始数据,处理得脑组织中炎症因子TNF-α、IL-1β、IL-18的含量。
1.2.5 TUNEL染色检测神经元凋亡:选用4%多聚甲醛为固定液,室温下对小鼠损伤区脑组织切片进行固定,弃去甲醛。选用3%过氧化氢-甲醇为封闭液,室温封闭10 min。滴加0.5% Triton X-100完全覆盖于切片上,孵育5 min。根据试剂盒说明书滴加适量的TUNEL反应液,37 ℃避光反应30 min。用DAB显色后在镜下观察,检测手术损伤后第7天各组小鼠神经元凋亡情况。
1.2.6 蛋白印迹法检测:于处理后第7天,以Western blot方法检测小鼠皮层损伤区脑组织中NRLP3、Caspase-1的表达水平。小鼠麻醉后断头取脑,冰上分离目标脑组织。用加有蛋白酶抑制剂的PBS清洗组织,完全弃去PBS后加入裂解液,冰上静置30 min裂解。将裂解后的细胞匀浆后,按BAC法测蛋白浓度,取适量且等量的蛋白进行SDS-PAGE电泳,再转膜至聚偏氟乙烯膜,切膜后用商品化封闭液封闭。再加入一抗如下:NLRP3(1∶1000)、Caspase-1(1∶2000),4 ℃过夜。用TBST洗去未结合的一抗3次,用HRP 标记的相应山羊抗兔二抗 IgG(1∶3000)作为二抗孵育1 h。再次用TBST洗去未结合的二抗3次。加入显影液,用Image J软件计算Western blot图片灰度值,再用Graphpad Prism数据量化作图及对各灰度值进行统计分析。
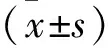
2 结 果
2.1 参芍口服液减弱小鼠脑损伤模型的神经功能损伤 于小鼠脑损伤模型制作后的第1、3、7天,分别对小鼠进行mNSS评分,相较于Sham组,TBI组小鼠的评分平均值明显升高,具有统计学差异(均P<0.05)。对比TBI组,SS组小鼠的评分的平均值明显下降,具有统计学差异(P<0.05)。见图1。

注:与Sham组比较,*P<0.05,**P<0.01,***P<0.001
2.2 参芍口服液降低脑损伤小鼠脑组织内炎症因子表达水平 在小鼠伤后的第7天,用ELISA法分别测得Sham组、TBI组和SS组伤处脑组织的炎症因子含量。经比较可知,TBI组的小鼠组织中的TNF-α、IL-1β、IL-18表达水平均高于Sham组(均P<0.05);而对比TBI组的炎症因子水平,SS组的TNF-α、IL-1β、IL-18浓度均明显下降(均P<0.05)。见图2。

注:与Sham组比较,*P<0.05,**P<0.01
2.3 参芍口服液抑制小鼠脑损伤模型的细胞凋亡 对术后第7天的小鼠损伤处脑组织TUNEL染色,相较于Sham组,TBI组小鼠皮层损伤区的神经元凋亡率升高明显(P<0.05)。对比TBI组,SS组脑组织神经元凋亡率明显下降(P<0.05)。见图3。
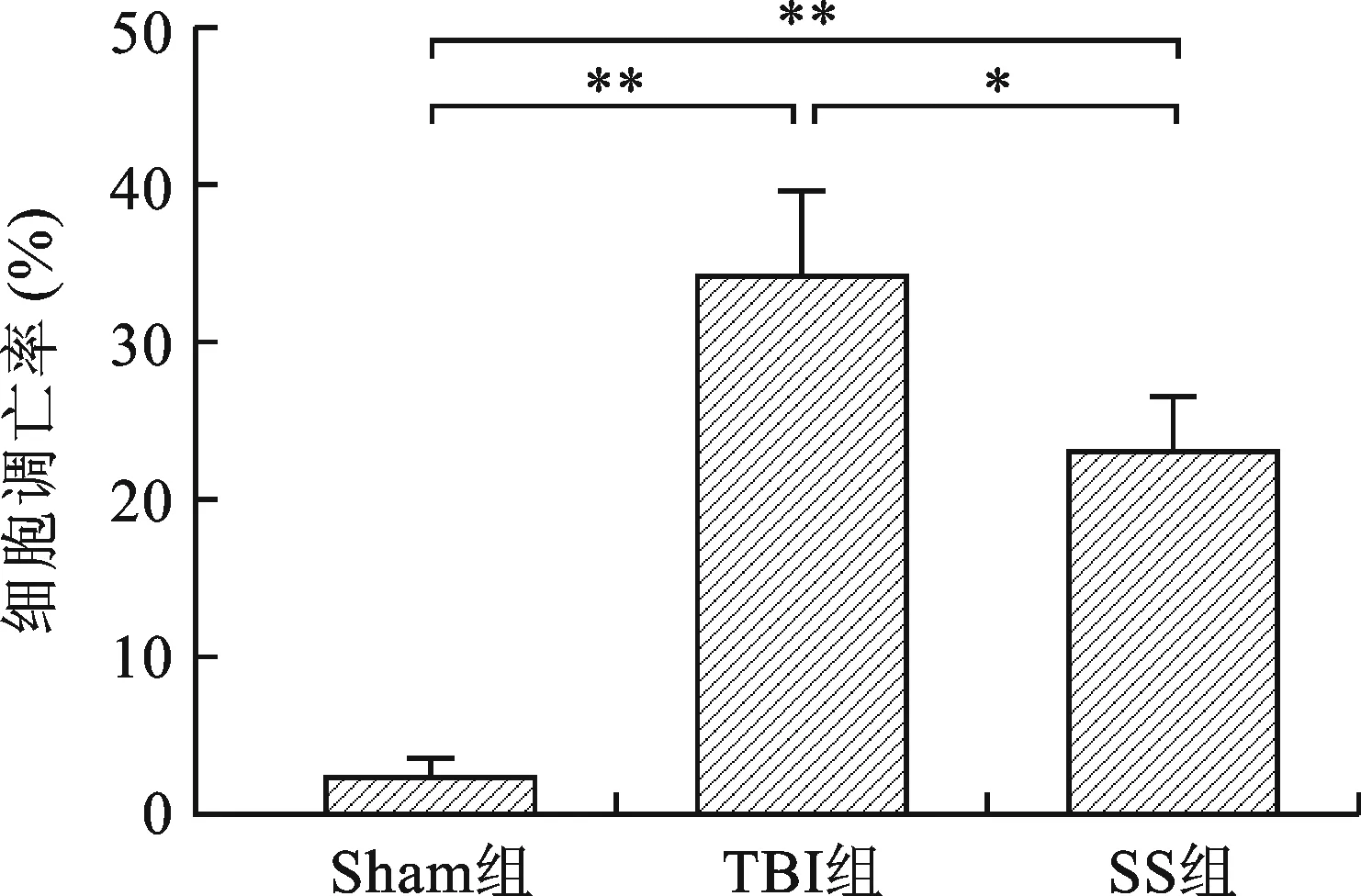
注:与Sham组比较,*P<0.05,**P<0.01
2.4 参芍口服液下调创伤性脑损伤小鼠模型NLRP3炎症小体的表达 以Western blot方法检测损伤手术后第7天各组小鼠皮层组织的NRLP3和Caspase-1蛋白含量;比较各组数据后发现,相比于Sham组,TBI组小鼠的皮层组织中NRLP3和Caspase-1蛋白表达显著上升,差异有统计学意义(均P<0.05);而SS组较之于TBI组,小鼠皮层组织的NRLP3和Caspase-1蛋白表达明显下降,差异有统计学意义(均P<0.05);表示参芍口服液能够抑制TBI小鼠的NLRP3炎症小体表达,有减轻炎症损伤的作用。见图4。

注:与Sham组比较,*P<0.05,**P<0.01
3 讨 论
作为创伤性脑损伤的继发损伤中的重要一环,神经炎性反应的病理机制复杂,且炎性反应与脑水肿、颅内压上升等继发性损伤的其他症状的逻辑关系仍未知;研究显示患者炎性反应的剧烈程度与其预后水平有直接关系,因此对创伤性脑损伤后炎性反应相关的诊疗方法的研究仍具有较强的现实意义。目前研究显示神经炎性反应主要由小胶质细胞引发;原发性损伤中脑组织产生的损伤因子激活小胶质细胞,小胶质细胞活化后,主要表型最初为M2后向M1转变,时间与继发性损伤进程相符[8]。小胶质细胞的活化会加强血脑屏障通透性,募集免疫细胞,上调组织中细胞因子和炎性介递表达[9]。有研究表明细胞因子TNF-α、IL-18等对创后神经组织的恢复具有双重效应,随着其浓度在组织中逐渐升高,其作用也从促进神经损伤恢复转变为引起并加重炎性反应[10]。
参芍口服液是含有丹参、赤芍等成分的中药复方制剂,临床上对于冠心病心绞痛有显著疗效;目前有研究显示,参芍口服液通过对TLR4/MyD88炎症诱导通路的调控,可以改善糖尿病小鼠的心肌功能和炎症损伤情况[11];另有研究表明,参芍口服液能够抑制CD4/TLR4通路,下调IL-8 的表达,从而减轻脑出血后的神经炎症[12];相关研究提示参芍口服液能够减少IL-1β、ICAM-1、VCAM-1 的表达水平,发挥抗炎作用,进而阻碍冠状动脉粥样硬化的病程进展[13];但有关参芍口服液在创伤性脑损伤后炎性反应的治疗作用仍然缺少相关研究,因此本研究就此进行讨论并尝试解释相关机制。实验结果显示参芍口服液对治疗创伤性脑损伤后的炎性反应有效用。
本研究中采用小鼠限制性皮层损伤模型检验参芍口服液对创伤性脑损伤后的炎性反应的作用。运用CCI模型,对皮层进行精确损伤,可重复性强,且模型的创伤反应与人类TBI的形态学表征较为类似,较其他模型制作的方式有更高的临床意义[14];且根据mNSS评分结果可知TBI组的神经功能明显受损,TBI模型建立成功。随着实验进行,通过对比各组小鼠的mNSS评分和TUNEL染色结果可知,使用参芍口服液后小鼠的神经功能恢复情况较TBI组有明显改善,说明参芍口服液对小鼠的创伤性脑损伤有治疗作用;根据ELISA实验得到各组炎症因子的表达水平,检测结果显示SS组的细胞因子IL-18、TNF-α、IL-1β均明显低于TBI组,显示参芍口服液可以通过减缓炎性反应保护小鼠的神经功能。NLRP3在机体的免疫系统中有调节作用,广泛表达于单核巨噬细胞、小胶质细胞、血管平滑肌细胞等,NLRP3可感知由多种炎症激活剂引发的细胞内信号,进而上调NLRP3炎症小体的转录水平,推动NLRP3炎症小体的组装[15];相关实验证明,NLRP3炎症小体可以参与创伤性脑损伤、阿尔茨海默症、缺血性脑卒中等中枢神经系统疾病的病程进展,且有临床研究显示,TBI患者脑脊液中的NLRP3浓度有指示预后的潜在效用;NLRP3炎症小体的激活过程为大量实验证明,创伤性脑损伤后6 h至伤后第7天,甚至伤后6个月NLRP3炎症小体的表达都属上调状态[16],同时,靶向创伤性脑损伤后NLRP3炎症小体激活的各步骤抑制剂能够有效减轻脑组织的炎症损伤[17];相关研究指出,NLRP3炎症小体能够促进Pro-caspase1的自我剪切形成Caspase-1蛋白,Caspase-1蛋白又可以剪切IL-1β和IL-18的前体蛋白,产生大量的炎症因子IL-1β和IL-18,进而加剧炎性反应[18-20];相应地,在本实验中,以Western blot法检测小鼠组织中NLRP3、Caspase-1蛋白的表达情况,结果显示,TBI组的NLRP3、Caspase-1含量明显较Sham组高,而SS组的NLRP3、Caspase-1蛋白含量又明显低于TBI组,说明参芍口服液抑制TBI后炎性反应,改善小鼠的伤后神经功能,可能与下调NLRP3炎症小体表达相关。
综上所述,本实验通过TBI模型建立,对比研究了参芍口服液对创伤性脑损伤小鼠的治疗作用,发现TBI组IL-18、TNF-α、IL-1β、NLRP3及Caspase-1等蛋白的表达较Sham组均有增加,而SS组较TBI组又有所下降,且SS组小鼠的mNSS评分、受创组织凋亡比例均明显低于TBI组,提示参芍口服液可能通过抑制NLRP3炎症小体表达的机制,减少组织炎症因子含量,提高小鼠的创伤性脑损伤的恢复水平,改善神经功能,降低神经元死亡比例,进而实现对小鼠创伤性脑损伤继发损伤的治疗。

