黄芪甲苷脂质聚合物纳米粒对缺血再灌注损伤诱导大鼠模型的影响
赖志昆 冯其茂 王 骕 胡晓贞
上海市中医医院心内科,上海 200071
缺血所引起的组织损伤是致死性疾病的主要原因,如冠状动脉硬化导致的心肌梗死、脑卒中等。有研究发现[1],对组织造成损伤的主要因素并非缺血本身,而是恢复血液供应后,过量的自由基攻击这部分重新获得血液供应的组织内的细胞所造成的。黄芪甲苷(astragaloside Ⅳ,AA)是传统中药黄芪的重要活性成分之一,具有多种药理活性,如提高损伤心肌细胞的存活率[2]、抗病毒、心脏保护[3]、抗氧化、抗老化[4]等作用。AA 在多种溶剂中溶解度较差[5],这限制了其临床应用。脂质聚合物纳米粒(lipid polymerhybrid nanoparticles,LPNs)作为一种新型给药系统,可以提高难溶性药物的溶解性及生物利用度[6],近年来备受关注。本研究通过构建缺血再灌注损伤诱导的大鼠模型,评价AA-LPNs 对缺血再灌注损伤诱导大鼠心肌细胞凋亡的抑制作用。
1 材料与方法
1.1 主要试剂
AA、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA](购自大连美仑生物科技有限公司,货号:MB1955、MB5649);肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒(购自南京建成生物工程研究所,批号:20200103、20200407、20200206、20200216);TUNEL 检测试剂盒(购自美国罗氏公司,货号:11684795910)。
1.2 主要仪器
低温离心机(湖南湘仪实验室仪器开发有限公司,H2050R);旋转蒸发仪(上海亚荣生化仪器厂,R206 型);全自动血生化分析仪(深圳迈瑞生物医疗电子股份有限公司,BS-220);透射电子显微镜(日本JEOL,JEM-2100);高效液相色谱仪(美国安捷伦科技有限公司,Agilent 1260)。
1.3 实验动物
SD 大鼠,清洁级,体重(180±20)g,购于北京华阜康生物科技有限公司。动物许可证号:SCXK(京)2019-0008。合格证号:SYXK(京)2019-0024。大鼠在标准化条件下适应性饲养1 周,实验前自由饮水和进食。本研究遵循了上海市中医医院(以下简称“我院”)实验动物保护和使用指南,并经我院实验动物伦理委员会批准。
1.4 实验方法
1.4.1 制剂制备及表征 参考文献[7]制备AA-LPNs。将20 mg AA 溶于20 ml 丙酮,加入100 mg PLGA 作为油相。将15 mg 合成磷脂和15 mg 大豆卵磷脂用无水乙醇溶解(100 mg/ml),加入到40 ml 超纯水中,65℃加热至脂质充分分散均匀,作为水相。将油相边搅拌边倒入水相中,涡旋3 min。磁力搅拌器(300 r/min)室温下搅拌2 h,旋转蒸发除去丙酮。经0.8 μm 滤膜滤过,得到AA-LPNs。用透射电子显微镜及粒径仪对其形态和粒径分布进行测定。
1.4.2 药代动力学研究 选取16 只大鼠按随机数字表法将其分为常规组(8 只)和研究组(8 只)。实验前,大鼠禁食不禁水过夜。将AA 和AA-LPNs 以40 mg/kg的剂量灌胃给药,给药体积1.5 ml。于灌胃0.50、0.75、1.00、1.50、2.00、4.00、6.00、8.00、12.00、24.00、48.00 h后分别从眼球静脉丛中取血0.3 ml,分离血浆,采用高效液相色谱法分析两组药代动力学参数[药物半衰期(t1/2)、药峰时间(Tmax)、药峰浓度(Cmax)、浓度-时间曲线下面积(area under the curve,AUC)(AUClast、AUCall)、平均滞留时间(mean residence time,MRT)(MRTlast、MRTall)],数据采用winNonlin(6.1)软件进行处理,并绘制浓度-时间曲线。
1.4.3 模型构建及给药 选取60 只大鼠,从中随机选取15 只作为假手术组,其余构建缺血再灌注损伤大鼠模型,造模成功后按随机数字表法将其分为模型组、AA 组、AA-LPNs 组,每组15 只。参考文献[8]进行动物模型建立:实验前进行大鼠麻醉,随后以仰卧位进行固定,开胸暴露出心脏,用无创缝合丝线穿过左心耳廓下方2 mm 处进行缝合结扎,30 min 后结扎下方的心肌呈现灰白色,心电图出现S-T 段抬高后释放缝合丝线,心脏再灌注2 h,构建大鼠缺血再灌注损伤模型。造模成功标准为缺血再灌注后,心肌舒缩功能出现障碍,形态上出现心肌梗死。缝合消毒后放回笼中饲养。假手术组除不进行结扎外其余操作与模型组完全相同。造模24 h 后,AA 组和AA-LPNs 组以40 mg/kg 剂量灌胃给药,假手术组和模型组给予等量0.9%氯化钠溶液,给药1 次/d,连续给药4 周。
1.4.4 观察指标 实验结束后,采集四组动脉血,分离上层血清,通过全自动血生化分析仪对血清中CK、LDH、SOD、MDA 进行检测,然后每组选取5 只大鼠处死并快速剖取心脏组织,采用4%多聚甲醛溶液固定,用于TUNEL 检测心肌细胞凋亡情况[9]。
1.5 统计学方法
采用SPSS 18.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,比较采用t 检验;多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 AA-LPNs 表征
制备的AA-LPNs 呈类球形,均一圆整,平均动态直径为(180±23)nm。见图1。

图1 黄芪甲苷脂质聚合物纳米粒表征
2.2 常规组和研究组药代动力学参数比较
常规组和研究组浓度-时间曲线见图2。研究组的t1/2、Tmax、AUClast、AUCall、MRTall均高于常规组,差异有统计学意义(P <0.05)。见表1。
表1 常规组和研究组药代动力学参数比较()

表1 常规组和研究组药代动力学参数比较()
注 AUC:曲线下面积;MRT:平均滞留时间
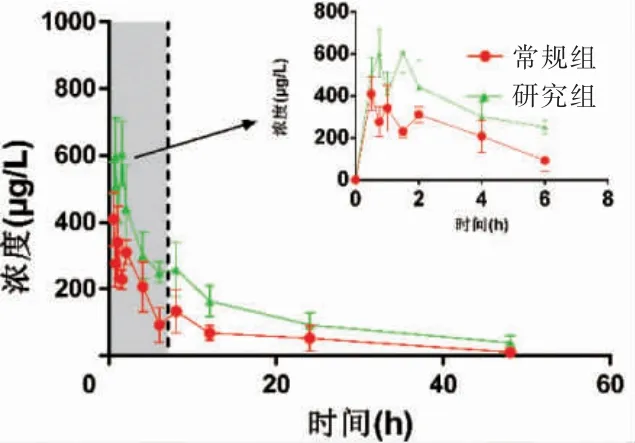
图2 常规组和研究组浓度-时间曲线(n=8)
2.3 假手术组、模型组、AA 组和AA-LPNs 组血生化指标比较
模型组血清CK、LDH、MDA 含量均高于假手术组,SOD 含量低于假手术组,差异有高度统计学意义(P <0.01)。AA 组 和AA-LPNs 组血清CK、LDH、MDA 含量均低于模型组,SOD 含量高于模型组,差异有统计学意义(P <0.05 或P <0.01)。AA-LPNs 组血清CK、LDH、MDA 含量均低于AA 组,SOD 含量高于AA 组,差异有统计学意义(P <0.05 或P <0.01)。见表2。
表2 假手术组、模型组、AA 组和AA-LPNs 组血生化指标比较()
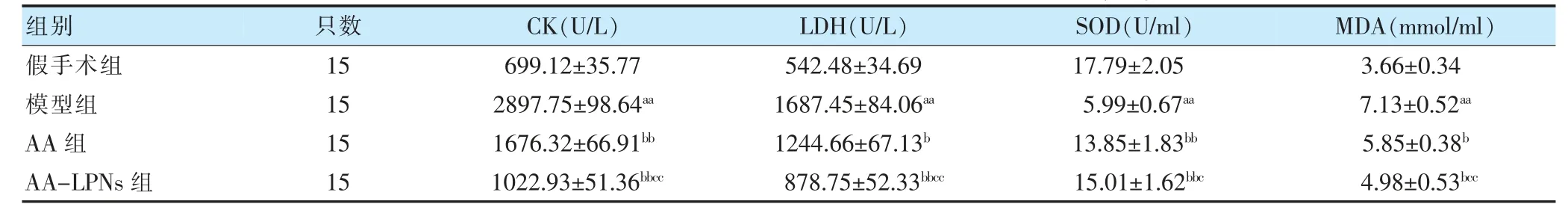
表2 假手术组、模型组、AA 组和AA-LPNs 组血生化指标比较()
注 与假手术组比较,aaP <0.01;与模型组比较,bP <0.05,bbP <0.01;与AA 组比较,cP <0.05,ccP <0.01。AA:黄芪甲苷;AA-LPNs:黄芪甲苷脂质聚合物纳米粒;CK:肌酸激酶;LDH:乳酸脱氢酶;SOD:超氧化物歧化酶;MDA:丙二醛
2.4 假手术组、模型组、AA 组和AA-LPNs 组心肌细胞凋亡比较
假手术组、模型组、AA 组和AA-LPNs 组中均可见凋亡细胞,见图3。模型组的细胞凋亡率高于假手术组,差异有高度统计学意义(P <0.01)。AA 组和AA-LPNs 组的细胞凋亡率均低于模型组,且AA-LPNs组低于AA 组,差异有统计学意义(P <0.05 或P <0.01),见图4。
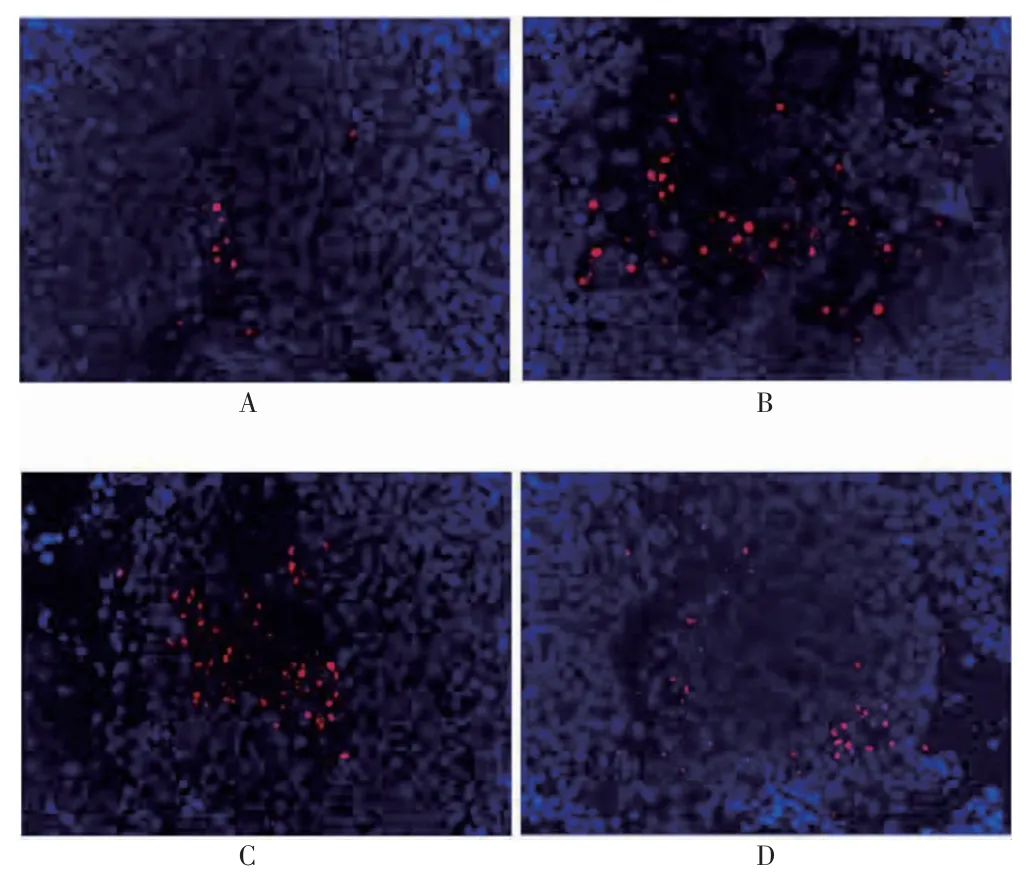
图3 四组心肌细胞凋亡(200×)
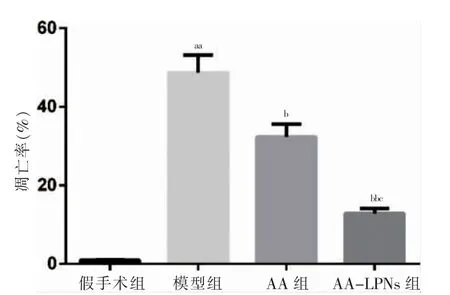
图4 四组心肌细胞凋亡率比较(n=5)
3 讨论
难溶性药物的低生物利用度对药物的临床应用产生不利影响。近年来,AA 已应用于各种新型药物递送系统,例如纳米乳[10]、纳米结构脂质载体[11]和自微乳[12]。上述新型药物载体可在一定程度上提高AA 的溶解度和生物利用度,但仍然存在一定问题,如药物易泄露、体内循环时间短等。本研究构建的AA-LPNs作为新的药物递送系统,旨在提高AA 的生物利用度,增强其对于缺血再灌注损伤诱导的大鼠心肌细胞的保护作用。药物被LPNs 包载后可提高小肠上皮细胞的摄取[13],一方面是由于增大了AA 的溶解度,另一方面表面修饰增强了其在胃肠道的黏液层扩散,实现药物的持续缓慢释放[14]。
LPNs 具有核-壳结构,核通常由可生物降解的材料如PLGA[13]和聚乳酸[15]形成,而壳通常由脂质材料如磷脂酰胆碱和甲氧基(聚乙二醇)-二硬脂酰基磷酸乙醇胺[16]组成。PLGA 对疏水性药物具有很高的包载能力,可以控制药物的释放速率[17]。磷脂层的壳在生理功能上类似于细胞膜的表面,其可以增加纳米颗粒的生物相容性,同时减缓药物的泄漏[18]。LPNs 的双层结构不仅可以包载单一药物,而且可以实现不同性质药物的共递送[19]。此外,纳米粒子的表面还可以被官能团修饰[20-21],进一步促进细胞吸收并增强药效。
基于上述理论,本研究制备的AA-LPNs 不仅可以提高AA 的溶解度,还可以提高其生物利用度,且对心肌细胞的保护作用。缺血再灌注损伤重要的病理机制之一是氧化应激[22-23],血清中CK 和LDH 含量降低,会造成体内的氧化和抗氧化的平衡被打破,导致心肌功能损伤及细胞死亡。氧化应激过程中,有大量MDA 产生,抗氧化物酶SOD 被消耗[24]。因此,SOD 活性可间接反映心脏损伤程度[25-26]。综上所述,AA-LPNs对缺血再灌注损伤诱导大鼠的心肌细胞具有保作用,其机制可能为AA-LPNs 提高大鼠SOD 含量,降低MDA含量,通过抑制氧化应激实现的。因此,AA-LPNs 作为抑制缺血再灌注损伤诱导的大鼠心肌细胞凋亡是一种很有前途的纳米递送系统。

