以金纳米粒子为指示剂的法扬司法测定氯离子
张远馥,张金荣,任姿静,张熙芳,商冬丽,魏琳洁,李睿,李霞,薛庆旺,张伟,王术皓
聊城大学化学化工学院,山东 聊城 252000
分析化学是一门以多学科为基础的综合性学科,是化学的重要分支学科。基础分析化学实验是化学、化学工艺、应用化学、材料科学、生命科学、环境科学等专业的必修基础课程之一,在专业人才培养中特别是实验操作技能培养方面起着极其重要的支撑作用[1-3]。滴定分析是主要的化学分析法,具有简便、快速、准确度高的特点,故常作为标准方法使用。目前,我国对水中氯化物含量的测定主要是以K2CrO4为指示剂的银量法。但是,采用的指示剂为重金属盐,具有毒性,使用量大。法扬司法(Fajans)是利用吸附指示剂确定滴定终点的银量法[1]。目前比较常用的指示剂有荧光黄、曙红等阴离子染料[4]。然而该方法受到不同因素的影响。例如,溶液的浓度不能太稀,否则沉淀太少,观察终点困难,若用荧光素作为指示剂测定氯离子,其浓度不能低于5 mmol·L-1。所以,有必要引入一种新型的指示剂。
金纳米粒子(AuNPs)是指粒径在100 nm范围内的金纳米颗粒,因其表面效应、小尺寸效应、量子尺寸效应等纳米效应,在宏观上呈现出与众不同的性质[5,6]。其中,AuNPs具有独特的局部表面等离子体共振(LSPR)特性。当光照射在纳米金表面上时,分散纳米金(10-50 nm)呈酒红色,在520 nm处出现LSPR特征吸收。当纳米金发生聚集,纳米金溶液呈蓝色,LSPR吸收峰发生较大的红移,基于此建立了纳米金比色法[7,8]。由于纳米金的摩尔吸光系数远远大于传统的有机分子,所以纳米金比色法具有高的灵敏度,它已广泛用于DNA[9,10]、蛋白质[11,12]、金属离子[13,14]等方面的测定。然而,在滴定分析作为指示剂的应用并不多见。法扬司法是基于化学计量点前后电荷的变化,吸附指示剂,造成指示剂颜色变化而建立的分析方法。也就是说指示剂需带电荷,而纳米金由于包被试剂的不同可带有不同的电荷。研究者曾以半胱胺盐酸盐为稳定剂,制备了带有正电荷的纳米金,加入聚阴离子(肝素)后,由于静电引力的作用,拉近了纳米金间的距离,溶液由红色变为蓝色,进而可以快速、灵敏地检测肝素[15]。研究表明,纳米金非交联团聚的过程就是分子间作用力平衡被打破的过程。那么,能否将此过程引入到法扬司法,将纳米金作为吸附指示剂呢?
本工作将利用还原法制备纳米金,在中、碱性环境下,纳米金粒子带有负电荷,在化学计量点前,由于AgCl胶体吸附过量的Cl-而带负电荷,排斥纳米金,溶液显红色;滴定至化学计量点后,AgCl吸附过量Ag+而带正电荷,吸附带负电荷纳米金,纳米金粒子表面电荷被中和,双电层遭到破坏,发生团聚显蓝紫色,据此可以利用溶液的颜色变化来确定滴定终点。由于本工作整个过程都使用的是无机盐,所以可通过络合反应、沉淀反应和氧化还原反应等简单反应,将金和银进行回收,这一环节中充分体现了绿色化学的理念。
1 实验目的
(1)通过文献调研,了解纳米金颗粒的制备方法及显色原理。
(2)理解纳米金颗粒作为吸附指示剂的原理及变色原理。
(3)熟练掌握沉淀滴定基本操作及紫外-可见分光光度计的使用。
(4)通过探索不同实验条件对滴定分析的影响,培养学生的科研逻辑思维,提升学生的综合运用的能力。
(5)通过废液的回收再利用,拓展绿色化学在本科教学中的应用,培养学生绿色化学的理念。
2 实验部分
2.1 实验原理
本工作采用的法扬司法是利用纳米金作为吸附指示剂确定滴定终点的银量法。纳米金是通过还原法制备得到的。如图1所示,在化学计量点前,AgCl胶体吸附过量的Cl-而带负电荷,形成AgCl·Cl-。进而不易被吸附,纳米金溶液为红色。在化学计量点时,AgCl吸附Ag+而带正电荷,吸附纳米金,造成纳米金团聚,溶液颜色发生变化,变为蓝紫色。所以,可利用溶液的颜色变化来确定滴定终点。
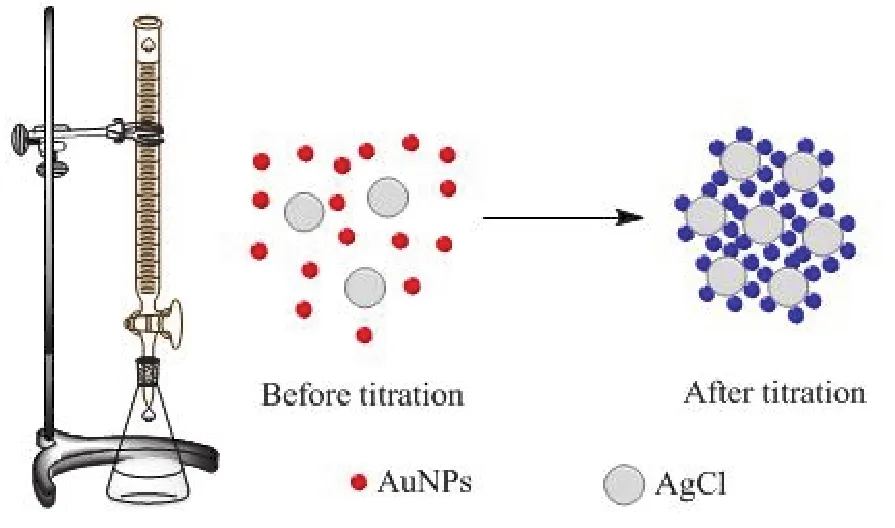
图1 以AuNPs为吸附指示剂,法扬司法检测氯离子
在准确滴定Cl-的同时,产生了大量的AgCl沉淀。由于Ksp(Ag2S)远远小于Ksp(AgCl),所以,如图2所示,当加入过量的Na2S溶液后,AgCl可转化为Ag2S,Ag2S与HNO3发生氧化还原反应,生成AgNO3、NO和S单质。将得到的产物利用滤膜进行过滤,得到AgNO3滤液。此外,向滤渣滴加王水,生成H[AuCl4],待收集的溶液达到一定量后,置换得到金。
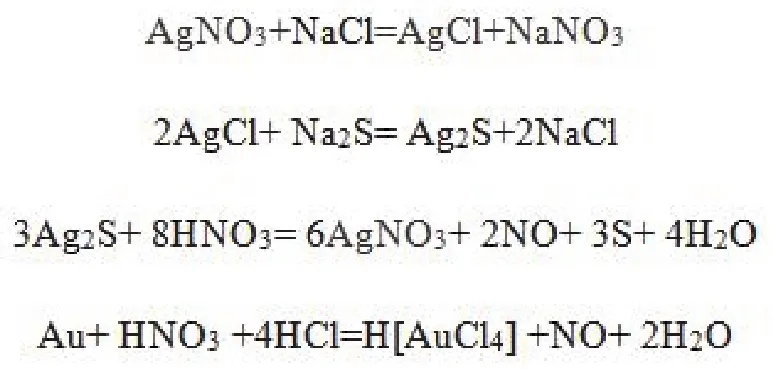
图2 本实验中所涉及的有关反应方程式
2.2 试剂和仪器
氯金酸购于天津金铂兰精细化工有限公司,柠檬酸钠、硼氢化钠、硝酸银、氯化钠、淀粉均购于国药集团化学试剂有限公司,所用试剂均为分析纯。实验用水为超纯水(Millipore 18 MΩ·cm)。
紫外分光光度计(UV-2550,Hitachi,日本),电子天平(梅特勒-托利多仪器有限公司),高速冷冻离心机(Himac CR 22G,Hitach,日本),棕色滴定管(江苏泰州市高港区腾飞教学仪器厂)。
2.3 实验步骤
2.3.1 纳米金胶体的制备
所有玻璃器皿在使用前用王水浸泡24 h,水洗、晾干备用。
13 nm、20 nm、40 nm纳米金胶体的制备。本工作采用还原法制备纳米金。以13 nm纳米金为例,首先,配制50 mL质量分数为0.04%氯金酸溶液;然后,将此溶液加热、搅拌至沸腾;再快速加入5.6 mL质量分数为1%柠檬酸三钠,溶液由黄色变为酒红色后,继续搅拌、加热至颜色纯正;最后撤去热源,继续搅拌至室温,置于冰箱中冷藏保存,备用。对于20 nm和40 nm的纳米金来说,其制备方法与13 nm纳米金制备方法类似,只是氯金酸的量为100 mL 0.01%,柠檬酸钠溶液分别为2 mL和0.65 mL。
2.6 nm纳米金胶体的制备。100 mL 0.01%氯金酸溶液加入1 mL 1%柠檬酸钠溶液,在搅拌下,缓慢滴加1 mL含质量分数0.075%硼氢化钠的1%柠檬酸钠溶液,当溶液的颜色变为红色,继续搅拌30 min,最后,将该溶液离心、水洗,装入棕色细口瓶,置于冰箱保存备用。
根据在UV-Vis光谱图上520 nm处的吸光度值和纳米金的摩尔吸光系数为2.7×108mol·L-1·cm-1,得知此法制备的13 nm的纳米金粒子的浓度粒子的浓度为17 mol·L-1。
2.3.2 以纳米金为吸附指示剂,标定硝酸银
准确称取约0.0060 g氯化钠固体于锥形瓶,溶于20 mL水中,加入0.5 mL质量分数为1%淀粉溶液,加入200 μL纳米金,用0.01000 mol·L-1硝酸银标准溶液避光、慢速滴定,至溶液颜色呈紫色,平行三次测定,计算硝酸银的含量。
2.3.3 以纳米金为吸附指示剂,测定水样氯离子含量
首先,将地下水样品离心、过滤。然后,取10 mL样品溶液于锥形瓶,加入0.5 mL 1%淀粉溶液和200 μL纳米金,再用硝酸银标准溶液逐滴滴定,溶液由酒红色变为蓝紫色即为终点,平行三次测定,计算地下水样品中氯离子的含量。
2.3.4 金和银回收
向滴定完成的混合液中加入过量的硫化钠溶液,溶液迅速由紫红色变为灰黑色沉淀。然后将溶液静置20 min,去除上清液,反复水洗多次后,加入过量6 mol·L-1硝酸,加热,沉淀由灰黑色变成棕色后,再继续加热1 min后停止加热。将得到的溶液过滤,得到硝酸银溶液。重复上述步骤多次,将滤液收集于试剂瓶,最后将滤液冷冻干燥,得到硝酸银固体。另一方面向滤渣滴加王水,得到氯金酸溶液。
3 结果与讨论
3.1 纳米金的紫外-可见吸收光谱图
本工作采用柠檬酸三钠还原法,制备得到纳米金胶体,呈稳定的酒红色,ζ-电位为-21.6 mV,在520 nm处有一最大吸收峰(图3A)。由于AgNO3的ζ-电位为-2.05 mV,所以,AgNO3滴加于锥形瓶中时,不易吸附纳米金。在化学计量点前,AgCl胶体吸附过量的Cl-而带负电荷,形成AgCl·Cl-,ζ-电位为-2.33 mV,溶液为红色,吸收峰的位置无变化。如图3所示,在化学计量点时,颜色变为紫色(图3B),吸收峰发生了红移,吸光度降低,半峰宽变大(图3A),这表明纳米金发生了交联和聚集。这是因为AgCl吸附Ag+而带正电荷,ζ-电位为34.8 mV,吸附纳米金,造成纳米金团聚,颜色发生变化,变为紫色。所以,可利用溶液的颜色变化来确定滴定终点。

图3 化学计量点前后吸收光谱(A)及溶液颜色变化(B)的比较
3.2 透射电镜表征
为了进一步说明纳米金作为吸附指示剂的变色原理,我们用透射电镜(TEM)来直接表征化学计量点前后纳米金的聚集状态。如图4所示,纳米金平均粒径为~13 nm,且大小均匀(图4A),在化学计量点后,发现纳米金团聚,形状呈不规则状,粒径从几百纳米到微米级(图4B)。并且还可观察大颗粒的晶体(AgCl)出现。

图4 纳米金的TEM图
3.3 淀粉含量对该方法响应信号的影响
由于该方法颜色的变化发生在沉淀的表面,为此应使AgCl沉淀比表面大一些,所以要加入淀粉溶液保护AgCl胶体阻止其凝聚。我们考察了淀粉溶液对该体系在520 nm处的吸光度的差值ΔAbs(ΔAbs=A0-As,A0,As表示化学计量点前后的吸光度值)的影响。如图5所示,在未加入淀粉溶液时,吸光度变化值(ΔAbs)为最小,这是因为在没有淀粉的存在下,AgCl易发生聚沉,造成AuNPs不易变色。随着淀粉的加入,ΔAbs逐渐增大,当淀粉浓度为50 μmol·L-1,ΔAbs达到最大,而当淀粉浓度大于50 μmol·L-1,ΔAbs趋于平衡且有下降的趋势,这是因为淀粉含量多造成强背景信号。所以淀粉浓度为50 μmol·L-1。
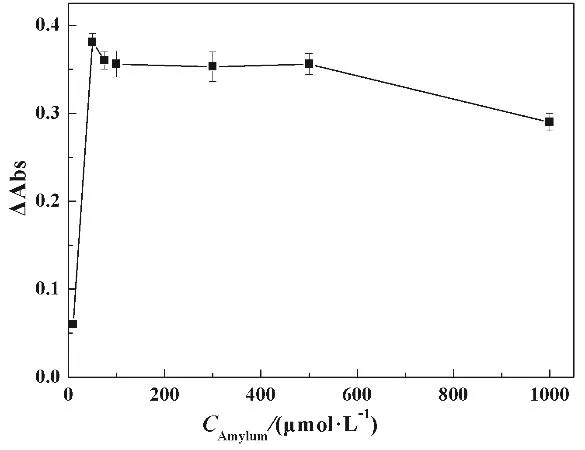
图5 淀粉含量对该方法响应信号的影响
3.4 纳米金对该方法响应信号的影响
本工作中,纳米金作为指示剂,对该方法灵敏度起到至关重要的作用。我们从纳米金的粒径和浓度两方面同时考察了纳米金对体系的影响。如图6所示,以粒径为2.6、13和20 nm的纳米金作为指示剂,其变化趋势基本一致,都是先随着纳米金的浓度增加,ΔAbs增大,然后,随着纳米金浓度增加,ΔAbs反而减小。但是,对于40 nm纳米金来说,ΔAbs随着浓度增加反而下降,这是因为40 nm纳米金背景信号大,进而ΔAbs减小。从图6可知,当13 nm纳米金为0.010 μmol·L-1时,ΔAbs达到最大。所以,选择0.010 μmol·L-1,13 nm纳米金为指示剂。
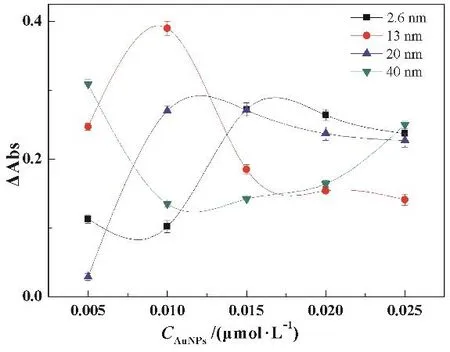
图6 纳米金对该方法响应信号的影响
3.5 pH对该方法响应信号的影响
pH不仅影响滴定反应,而且影响纳米金的指示作用。比较了本方法和莫尔法在不同pH环境下的响应信号(V/VGB,V:滴定体积,VGB:国标法滴定体积)。如图7所示,在强碱性环境下,Ag+与OH-反应,析出Ag2O沉淀。莫尔法在pH为3.3-5.8和8.7-10.0时,V/VGB大于1,说明指示终点的Ag2CrO4沉淀出现晚,导致测定误差。然而,本方法在pH在5.8-10.0时,V/VGB约为1,说明该方法在中性或弱碱性环境下测定的结果都比较准确。这是因为制备纳米金由柠檬酸包被,只有在中性或或弱碱性环境下显负电荷,在酸性环境下不显电荷,不利于相互作用。所以我们选择了0.05 mol·L-1PBS缓冲液(pH 7.7)为最佳介质环境。
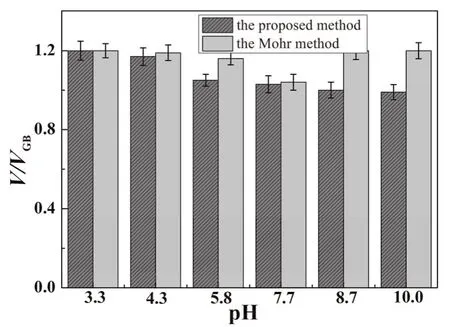
图7 pH对该方法响应信号的影响
3.6 该方法适用范围
每种分析方法都有一定的使用范围,沉淀滴定法适用于常量分析,具有准确度高的特点。如图8所示,对于莫尔法来说,NaCl在5×104-1×105μmol·L-1范围内,可被准确滴定。对于本方法来说,实验表明,氯离子的含量在1×103-5×103μmol·L-1,V/VGB接近于1,但当NaCl为1×105μmol·L-1,V/VGB为0.320,这是因为随着NaCl浓度的增加,离子强度增大,破坏了纳米金的稳定性,导致纳米金团聚,所以该方法不适用于离子强度大的介质。总之,该方法相比于传统的沉淀滴定法,具有高灵敏性,但不适用于离子强度大的介质。

图8 本法与莫尔法灵敏度的比较
3.7 样品测定
我们将这种方法应用于水样中氯离子含量的测定。将水样进行过滤、浓缩或稀释,按照本实验方法对水样中氯含量进行测定,如表1所示,每个样品测三次取平均值,测定回收率,通过t检验,在95%的置信水平上,回收率无显著性差异。与国标法(莫尔法)[4]相比,测定结果和回收率令人比较满意。

表1 水样中氯含量的测定
3.8 废液回收
随着环保意识的增强,废液回收再利用已成为热点问题,在实验教学中,如果不重视药品的回收再利用,不仅会造成资源和能源的浪费,还会造成环境污染。本实验中所用试剂为无机盐,所以可以通过简单的反应,将金属进行循环再利用。如图9所示,向废液中加入过量Na2S溶液,因为Ag2S溶解度比AgCl小很多,所以生成更加难溶的Ag2S。在这一过程中要加入过量的Na2S溶液,保证AgCl完全转化为Ag2S,反应结束后将沉淀静置,随后在洗涤沉淀的过程中,要用玻璃棒将沉淀充分碾碎,保证沉淀表面和沉淀包裹的杂质离子能够洗涤干净,最终得到纯净的Ag2S。然后,Ag2S与HNO3在加热下发生氧化还原反应生成AgNO3、NO和S单质。将得到的产物进行过滤,得到AgNO3溶液。剩下的固体残渣用王水溶解得到氯金酸。

图9 金和银的回收
4 实验注意事项
(1)制备金纳米粒子前,须将所有玻璃器皿用王水浸泡24 h,提醒学生在通风柜中操作,戴好护目镜及手套。
(2)滴定速度影响滴定结果。学生在滴定时,应缓慢滴定,快速摇动锥形瓶。
5 实验组织运行方式和教学方法
(1)本实验是一个涉及到无机纳米材料合成和表征、实验条件探究以及分析检测等内容的综合实验,适用于化学专业高年级本科生开设。建议2人一组开展实验。
(2)实验学时为18学时,分3周完成,每周6个学时。建议教师在实验前,引导学生进行文献调研,并做好预备实验。第一周,先给学生介绍纳米材料的性质、制备及应用等方面的背景知识。然后,制备不同粒径的纳米金。第二周,讲解以纳米金为吸附指示剂,法扬司法测定氯离子的原理,介绍用到的仪器(紫外-可见分光光度计、透射电镜、酸度计、粒度仪)的测定原理、操作方法和注意事项。开展滴定分析操作,探究实验条件对滴定终点的影响,并收集废液。第三周,开展废液回收实验,分组分析讨论实验数据。
(3)教学过程中,主要采用启发式和互动式教学形式,在整个过程中,通过学生之间、学生与教师之间的提问,引导学生深入思考,鼓励学生一起学习,共同探讨,互相启发。激发学生学习兴趣,培养自学能力和创新意识。
6 结语
纳米材料是当下科学研究的热点之一,本工作将金纳米粒子引入到沉淀滴定分析教学之中,以纳米金为吸附指示剂,建立了检测氯离子的新方法。与传统的法扬司法相比,该方法不仅具有高灵敏度,而且适用范围广。更重要的是,废液可通过简单反应,将金和银回收再利用,既降低成本又减少污染。本实验是一个研究探索型的综合性实验,综合了无机合成、滴定分析和仪器分析等知识,使学生能够得到综合性的锻炼,提高其实验操作技能。本实验内容操作简单、现象明显,易于学生掌握和理解,具有较好的教学推广价值。

