酯酶荧光探针的研究现状与进展
温莹,景宁,阴彩霞
山西大学分子科学研究所,太原 030006
动物、植物和微生物体内广泛存在着可以将酯类物质水解为羧酸和醇的酯酶。但许多酯酶不仅作用于酯类,还会作用于其他含羰基物质,如酰胺、硫酯、磷酸酯、酸酐,甚至是氨基甲酸酯[1]。基于酯酶的水解特性,许多酯前药策略被开发出来,比如将细胞通透性差的羧酸盐类药物以酯的形式进行预包装以使其可以顺利地透过细胞膜,最终经酯酶的水解释放出有效的药物。此外,酯酶还可以调节各种代谢功能如酯类物质的代谢、基因表达、物质运输和解毒,这些都归因于它具有高催化效率和高特异性[2-7]。按照底物的不同可以将酯酶分为羧酸酯酶、硫酯酶和磷酸酯酶等不同的类别,其中,羧酸酯酶(carboxylesterase,CES)对生物体的影响较为深远,因此对它的研究也相对较多。如无特殊说明,本文中的“酯酶”一词泛指羧酸酯酶。羧酸酯酶分为CES1、CES2、CES3和CES4四个亚型,大多数羧酸酯酶属于CES1和CES2家族。图1所示为CES1的晶体结构[8]与Alphafold2预测的CES2空间结构比较图,由此可见:它们在结构上相似度极高。在体内分布上,CES1主要集中于肝脏、单核巨噬细胞和肺上皮细胞,在肠道中的含量极低;而CES2则集中于肠道,在肝脏也有分布[9]。作为一种发挥重要功能的代谢酶,酯酶的缺失或过量表达往往可以直接导致许多疾病,如动脉粥样硬化、癌症和高血脂症等[10],因此许多策略已经被开发出来用于酯酶的监测。随着成像设备和荧光探针的迅速发展,荧光技术在酯酶检测中发挥着越来越重要的作用。相对于PCR、比色法、分光光度法、平板分析法和色谱法等检测方法,荧光探针检测酯酶具有成本低、响应快、灵敏度高和实时无损成像等优势[11,12]。因此,近些年荧光成像技术在检测酯酶方面取得了快速发展。本文主要综述了检测酯酶的荧光探针,这个领域在不断发展,因此这篇综述的目的是总结已有文献中的策略和最新进展。
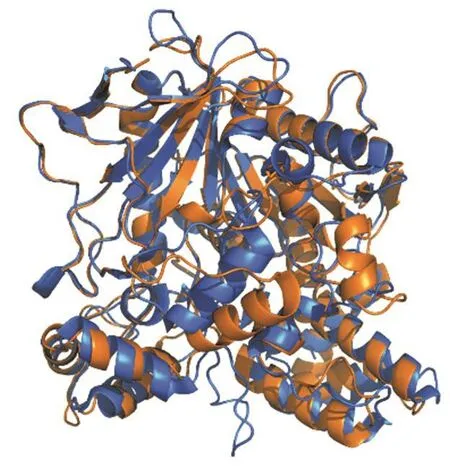
图1 CES1的晶体结构(PDB ID:5A7H[8])与Alphafold2预测的CES2空间结构比较图
1 检测酯酶的短波荧光探针
Wang课题组[13]基于共激发态分子内质子转移(excited state intramolecular proton transfer,ESIPT)荧光团2-(2-羟基苯基)-苯并噻唑(HBT)设计了三个用于检测酯酶的同系列荧光探针(1,2,3)(图2为探针1–11的结构式)。探针中作识别基团的是乙酰氧基甲基醚,其中的乙酰氧基可以特异性识别酯酶并与之反应释放荧光团和甲醛。值得一提的是,作者对HBT荧光团的羟基邻位进行了修饰以扩展其共轭体系,因此上述三个探针的发射波长依次向长波方向移动。在体外实验和HeLa细胞成像实验中这三个探针显示出了对酯酶的高特异性高灵敏度检测。Obika课题组[14]设计并合成了一种基于邻硝基苯并恶二唑(O-NBD)单元的显色荧光探针(4)。探针由一个带有甲酸酯的三甲基锁和O-NBD基团通过乙醇胺连接而成。此外,作者还合成了一个长链乙醇胺探针以及一个无酯酶识别位点的探针,荧光实验显示后两者均对酯酶无响应。这说明4的荧光开启依赖于酯酶活性,同时也验证了适当长度的连接体在分子内O-到N-NBD的快速迁移中有重要作用,能够在合理的时间范围内监测酶促反应。Hu等人[15]以黄酮类化合物衍生物作荧光团合成了一种荧光核磁双信号通道的探针(5)。探针在检测酯酶时可以明显地释放出荧光开启和19F的化学位移信号。作者用5对HeLa细胞或MCF-7细胞进行成像,也能在细胞内明显地观察到两种信号的变化。Morisseau课题组[16]开发了一种可以选择性检测人羧酸酯酶1(hCE1)的荧光探针6。它以吡啶衍生物作荧光团,长链酰胺基团为识别基团,对hCE1的响应信号强度远高于其他酶。6对hCE1的高选择性使hCE1可以作为一种生物标志物用于预测新药的药代动力学及患者某些相关疾病的状态。Wang等人[17]开发了一种基于四苯乙烯衍生物的具有聚集诱导发射特性的新型羧酸酯酶荧光探针7。探针中含有四个羧酸基团,因此具有很好的水溶性;当其被酯酶分解后,释放出相对疏水的荧光团,使探针析出并产生聚集,进而导致探针分子产生聚集诱导发射效应,荧光信号增强。Jung课题组[18]以单分子芘为基础设计出了具有逻辑门正交检测磷酸酶和羧酸酯酶功能的荧光探针8。探针通过在芘支架上修饰上一个羧酸酯和一个磷酸单酯基团得到。羧酸酯酶和/或碱性磷酸酶的存在与否可以正交组合出4种不同的荧光输出模式,这些不同的荧光模式通过发射波长的差异表现出来。作者通过猪肝酯酶和碱性磷酸酶的不同添加组合进行了体外荧光实验,结果与预期一致。用探针8对L929成纤维细胞瘤细胞和T84人结直肠癌细胞进行成像,只需用肉眼就可观察到不同的颜色变化,这为活细胞的磷酸酶和羧酸酯酶检测提供了有价值的工具。
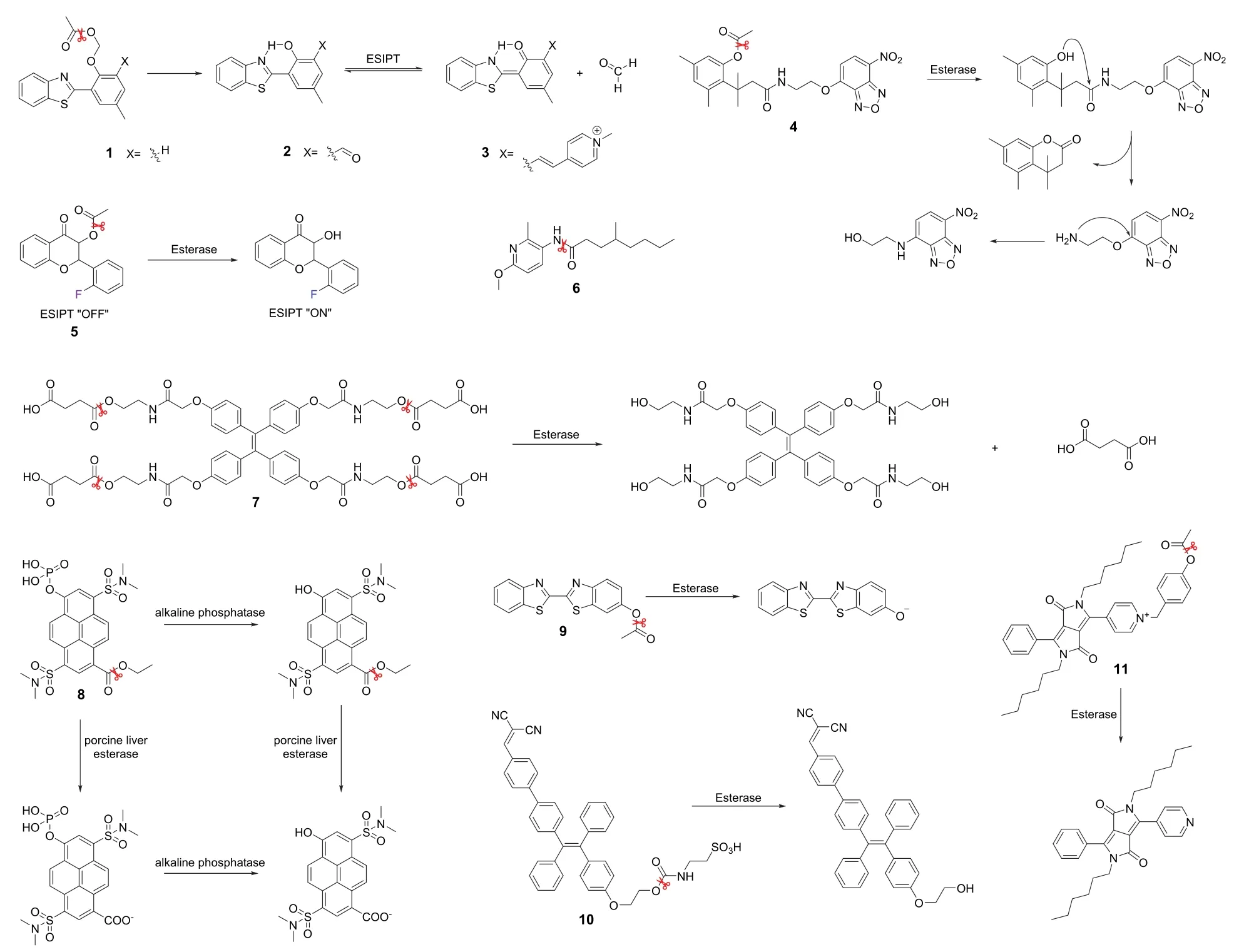
图2 探针1–11的结构式
合理范围内的酯酶活性是细胞存活或死亡的重要标志之一,因此通过检测酯酶的活性可以间接判断细胞的生存状态[19]。Yi课题组[20]以苯并噻唑为基本骨架合成了一种通过检测酯酶活性来鉴别细胞生存状态的荧光探针9。探针在体外荧光和细胞成像实验中均表现出了对酯酶的高特异性和低检测限,可以实现对活细胞和死细胞的鉴别。异常表达的酯酶活性往往伴随着炎症的发生,也意味着过量活性氧的表达[21]。通过识别过量的酯酶活性水平可以达到炎症靶向的效果。Wu课题组[22]基于聚集诱导发射效应建立了一个诊疗一体的荧光探针(10),它由亲水性牛磺酸和聚集诱导发射荧光团通过酯键结合。10可以作为一种既具有成像酯酶激活牛磺酸释放,又具有ROS清除的治疗能力,是由于过量的酯酶可以断裂酯键从而激活牛磺酸并释放荧光团,其中牛磺酸具有清除活性氧特别是清除HOCl的作用,荧光团具有发射荧光跟踪目标物的功能。10可以成功地用于成像RAW 264.7巨噬细胞中过量的酯酶和清除细胞内异常水平的活性氧。Hua课题组[23]设计并合成了一种新型二酮吡咯基荧光探针(11),用于酯酶的定量检测和细胞存亡的鉴别。起初,由于探针的分子内电荷转移(intramolecular charge transfer,ICT)过程从二酮吡咯部分转移到吡啶阳离子而呈现红色荧光,当用酯酶处理后,分子内电荷转移过程被破坏,探针发出的荧光由红色变为黄色,荧光比率发生显著变化(图3)。此外,通过检测不同通道的荧光强度,11可以达到鉴别TPC1人乳头瘤状甲状腺癌细胞生存状态的目的。为检测活细胞中的Fe(II),Lin课题组[24]设计出了一种只有在酯酶和Fe(II)同时存在的情况下才可被顺序激活的荧光探针(12)(图4为探针12–19的结构式)。该探针的精巧之处在于它被酯酶激活后可以对Fe(II)响应,而在没有酯酶存在的情况下则不会响应Fe(II)。12由Fe(II)和酯酶的识别位点以及一个荧光团组成。HeLa细胞成像和活体实验表明,它可以作为活细胞特异性Fe(II)和酯酶探针,也可用于生物体内Fe(II)和酯酶活性的检测和评估。
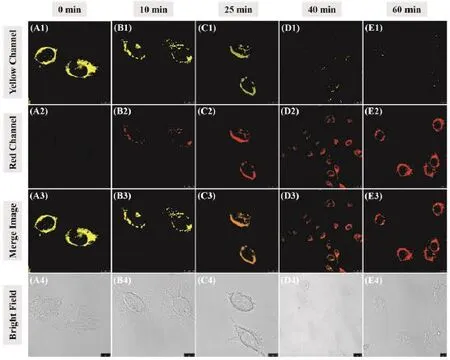
图3 经不同时间紫外线预处理的TPC1人乳头瘤状甲状腺癌细胞的荧光图像[23]
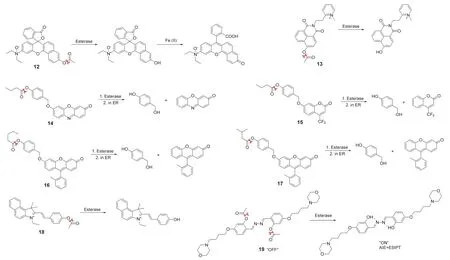
图4 探针12–19的结构式
酯酶在生物体内的分布位置略有不同,但主要分布在肝脏和肠道组织细胞中的内质网内腔和线粒体中[25,26]。对不同亚细胞的酯酶含量进行靶向检测也是研究其功能发挥和作用的必然要求。Jing课题组[27]开发了一种比率型荧光探针(13),用来定量检测线粒体中酯酶的活性。该探针由4-羟基萘酰亚胺支架、反应性乙酰氧基和靶向线粒体的甲基吡啶阳离子部分组成。在工作时,随着酯酶对吸电子乙酰氧基部分的裂解,探针分子内的电荷转移可以有效地被增强,从而导致其光谱模式的变化[28,29],体外实验结果表明,荧光发射从428 nm红移到555 nm。此外,作者还对HeLa细胞进行了线粒体酯酶检测,结果表明该探针具有良好的激发/发射波长、对内源性线粒体酯酶具有高灵敏度和高选择性以及低细胞毒性等优点。Hakamata课题组[30]开发了一系列靶向内质网酯酶的荧光探针(14,15,16,17)。对羟甲基苯酚的酚羟基被修饰为酯基,酯基的羧基端连接不同的内质网特异性荧光团,以此合成了探针14-17。不同的探针由于荧光团不同而对内质网酯酶的发射波长也不同,可以对其实现多色成像。实验证明,这一系列荧光探针可以实现对HT-1080人纤维肉瘤细胞、SK-N-SH人神经母细胞瘤细胞和HeLa细胞的内质网酯酶进行靶向检测。Zhou课题组[7]以半菁骨架为荧光信号单元,乙酰基为猝灭识别剂合成了靶向溶酶体检测羧酸酯酶的荧光探针(18)。对溶酶体的靶向功能可能归因于探针分子中的吲哚结构,由于吲哚的质子受体特性,使其倾向于对溶酶体的特异性定位。细胞成像和亚细胞共定位实验表明,18可以实现检测溶酶体中羧酸酯酶的功能。Liu课题组[31]报道了一种用于溶酶体酯酶活性原位检测的荧光探针19。探针以水杨醛嗪为荧光团,并分别以乙酰氧基和吗啉基团为酯酶反应性基团和溶酶体靶向部分。探针可以通过形成聚集体的方式来防止水的高极性和氢键对其荧光性能的破坏,从而有利于ESIPT的发射。MCF-7细胞成像和亚细胞共定位实验表明,19可以被用于活细胞溶酶体酯酶活性的特异性检测,此外,它还可以用于监测溶酶体的运动。
2 近红外(NIR)荧光探针
近红外荧光成像的组织吸收度和自体荧光大大降低,从而导致更高的组织穿透率和成像分辨率[32]。因此近红外荧光成像已经成为近些年组织成像技术中非常有前景的手段。Guo课题组[33]开发了一系列不同环结构的用于检测酯酶的近红外荧光探针(典型地,如20,其酯基羧酸部分为三元环)(图5为探针20–27的结构式)。这一系列探针的发光基团均为半花菁,而识别基团(酯基)中的羧酸部分则依次为三元环至六元环。环的大小不同可以改变分子中平面扭曲的偏转,以此来探究探针荧光发射特性的相应变化规律,作者发现从三元环到六元环,探针的发射波长逐步红移且荧光量子产率(φf)也逐步增加。作者通过细胞实验发现,它还可以靶向至线粒体进行酯酶的原位成像。而小鼠和斑马鱼的抑制剂和时间序列成像则证明20可以被用于检测生物体内的酯酶含量(图6)。Li课题组[34]开发了一种用于检测羧酸酯酶的水溶性近红外荧光探针(21)。作者以IR-783染料(一种近红外荧光染料)不稳定前驱体的分解产物为荧光团,其优良的水溶性和近红外发射特性分别来自于磺酸基和大的共轭体系。体外实验显示出了探针对羧酸酯酶的高灵敏度和高特异性,乙酰胆碱酯酶和丁酰胆碱酯酶也无法触发其荧光发射。此外,作者对HeLa细胞进行的细胞成像实验表明,21可以被用于检测细胞内源性的羧酸酯酶,这归因于其具有良好的细胞相容性和细胞膜通透性。
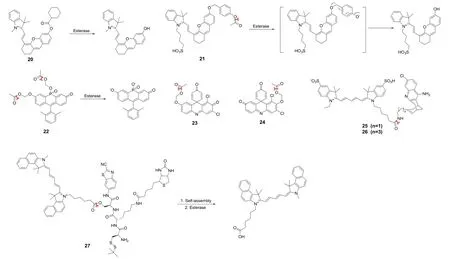
图5 探针20–27的结构式
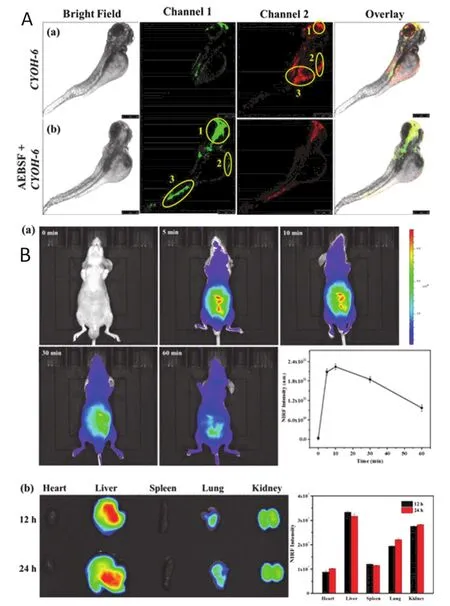
图6 (A)探针20在活斑马鱼中的荧光成像,其中:(a)斑马鱼在荧光前用探针20预处理1 h后成像;(b)在斑马鱼中加入AEBSF 30 min后,将20加入斑马鱼中孵育1 h进行成像。(B)20在小鼠中的荧光成像,其中:(a)腹腔注射探针孵育0、5、10、30和60 min后的体内成像;(b)将20静脉注射到小鼠体内,12 h和24 h后对小鼠的心脏、肝脏、脾脏、肺脏和肾脏进行成像[33]。通道:705–750 nm(λex=690 nm)
Stains课题组发明了一系列含膦酸盐的罗丹红和荧光素染料,这些荧光染料被用来产生一种灵敏的细胞酯酶活性成像探针[35]。其中,作者在保留罗丹明支架亮度和光稳定性的基础上对其进行修饰,得到了内布拉斯加州红(NR)荧光团家族。用乙酰氧基甲基醚(AME)基团对基于二甲基膦酸盐的荧光素NR600上的苯酚和膦酸盐进行掩蔽,从而使荧光团猝灭得到目标探针22。作者对HeLa细胞、NIH-3T3成纤维细胞和RAW 264.7细胞进行了细胞成像,结果表明,在细胞胞浆中可以清楚地观察到NR600的形成并产生比背景高10倍的荧光信号。Levine等人[36]开发了一种卤代螺环氨基甲酸酯荧光团,并利用可特异性识别酯酶的AME基团对其进行掩蔽,合成了两种检测酯酶的近红外荧光探针(23,24)。其中,24可以实现对活细胞进行酯酶荧光成像,但由于细胞摄取性差及溶解性低等原因导致成像效果不尽如人意。Chao等人[37]开发了两种基于石杉碱支架和花菁5荧光团的乙酰胆碱酯酶近红外荧光探针(25,26)。25和26可以在不同组织中对乙酰胆碱酯酶进行原位检测。相比之下,由于26中石杉碱基团和花菁5荧光团之间的间隔更长,它表现出比25更强的信号和稳定性。在复杂的生物体内环境中,往往多种生物物质同时参与一个生物事件,如果只检测其中某一种物质有可能会出现假阳性或假阴性的情况。而设计同时报告两种关联物质的探针则可以大大降低这种可能性。为克服肿瘤复杂的微环境而对其进行精准诊断,Liang课题组[38]开发了一种可以同时靶向生物素受体和酯酶的近红外荧光探针(27)。它由一个用于识别生物素受体过度表达生物素基团、一个用于提供近红外荧光和酯酶识别位点的Cy5.5荧光团(以酯基相连)以及一个用于自组装27纳米粒子的2-氰基-6-氨基苯并噻唑组成。该探针可以识别生物素受体过表达的HepG2癌细胞,并通过细胞内的酯酶水解来开启荧光,用于肿瘤的双靶向成像。肝癌小鼠的活体成像实验也显示出了探针对癌变组织的精准靶向能力。该课题组还报道了一种可以同时响应酯酶和组蛋白去乙酰化酶的生物发光探针,用于对恶性肿瘤的快速精准诊断[39]。此探针由生物发光的D-荧光素和6-乙酰氨基己酸部分通过酯键连接,用于对酯酶和组蛋白去乙酰化酶的识别,由于它并非荧光探针,因此就不做过多赘述。
3 双光子(TP)型荧光探针
双光子荧光成像技术以其高光稳定性,低光损伤,高时空分辨率等优势成为一种有吸引力的生物成像方法[40]。基于小分子的双光子荧光探针已被广泛开发用于检测和成像生物系统中的各种生物分析物[41]。Kim课题组[42]报道了一种可用于活体肝细胞和肝组织中酯酶活性定量分析的比率双光子荧光探针(28)(图7为探针28–32的结构式)。探针由基于乙酸苯酯的三甲基锁、作为酯酶水解位点的3-(2-乙酰氧基-4,6-二甲基苯基)-3-甲基丁酸衍生物和含有增溶基团的双光子荧光团组成。用28预孵育的HepG2细胞双光子成像显示出细胞中有不均匀的TP激发荧光信号,这说明该探针不仅可以响应酯酶,还能对酯酶在不同亚细胞的分布水平做出反应。此外,利用28对鼠肝组织切片进行比率双光子成像得到比HepG2细胞更强烈的荧光发射比,这说明其可以定量检测酯酶的活性,因为有报道证明人类和大鼠之间的酯酶激活水平不同[43]。如前所述,CES2是羧酸酯酶的一种亚型,也是许多抗癌前药的关键介质,许多癌症的发生往往也与其异常的CES2水平有关。Choi课题组[44]设计并合成了一种用琥珀酸酯作CES2识别单元的双光子比率型荧光探针(29)。用29对CES2进行定量分析,作者首次发现乳腺癌细胞中的CES2活性明显地低于正常细胞。总之,该探针可以为定量测定CES2活性以及预测抗肿瘤药物的疗效提供辅助信息。Tang课题组[45]开发了一种基于半菁和萘衍生物的D-π-A结构的双光子酯酶荧光探针(30)。在检测酯酶时探针会被水解并释放出半花菁荧光团,从而观察到明显的荧光变化。体外实验和HeLa细胞成像实验均表明,30具有出色的荧光增强和光稳定性。
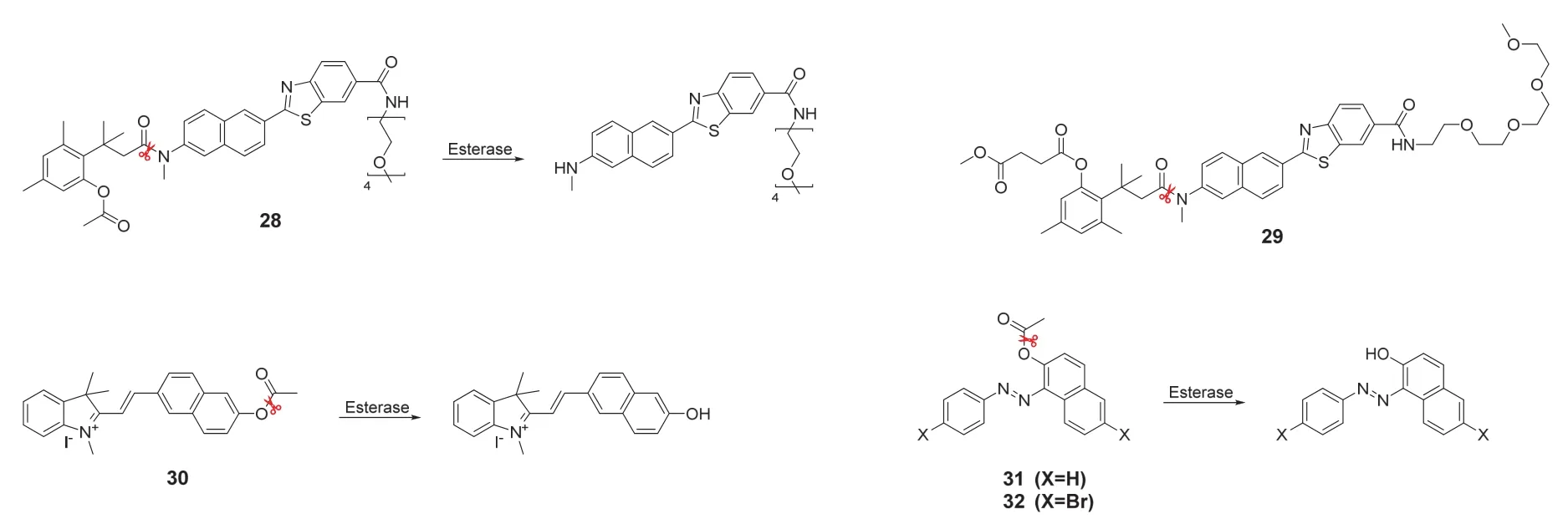
图7 探针28–32的结构式
许多传统的生色团在形成聚集体时通常会有严重的荧光猝灭现象。为了克服这种现象,可以使用具有聚集诱导发射效应的荧光团,这样不仅可以在聚集体中发出明显的荧光,还可以改善双光子特性。Lee课题组[46]通过重氮化和相应芳香胺与萘酚之间的偶氮偶联反应合成了邻苯偶氮萘酚衍生物AN-OH和AN-Br-OH,再利用乙酰基对其羟基进行保护,得到了响应酯酶的聚集诱导发射-双光子荧光探针(31,32)。由于羟基提供的电子是发射荧光所必须的,因此31和32在固态和液态情况下均保持荧光静默。识别酯酶后,探针中酯基被切断从而暴露出羟基,显示出聚集诱导发射的双光子荧光效应。两个探针分别对HepG2细胞进行单光子/双光子荧光成像,结果均显示双光子成像分辨率优于单光子成像,可以作为酯酶检测的候选。
4 总结和展望
在过去的几年中,用于酯酶传感和成像的分子荧光探针的发展取得了相当大的进展,这些荧光探针在酯酶检测领域中占有着不可或缺的一席,促进了我们对酯酶生理及病理作用和功能的理解。这些荧光探针的应用得益于现代显微镜高分辨率技术的快速发展。目前,绝大部分酯酶荧光探针都可以达到精确地、灵敏地检测细胞内或生物体内酯酶的目的,有一些还可以完成定量检测或亚细胞定位检测。尽管如此,仍有必要进一步开发具有更优波长、更优稳定性和更优成像效果的荧光探针。为了实现这一目标,我们可能在同一探针分子中交叉使用多种形式的信号输出模式(如荧光、比色、光声和核磁等信号)。此外,在我们所收集到的有限的文献中,并没有发现可以针对酯酶水平异常相关疾病的诊疗一体型荧光探针的报道,这可能也是今后一个重要的研究方向。总之,用于酯酶检测的荧光探针将继续受到挑战,并随着需求和问题的不断深入而向前推进。

