以Orbital Viewer为辅助实施原子轨道和共价键类型的互动性课堂
余凡,韩静华,胡冰倩,李堂明,梁昊,李艾华,王亮,李宝
1江汉大学化学与环境工程学院,光电化学材料与器件教育部重点实验室,武汉 430056
2华中科技大学化学与化工学院,武汉 430074
无机化学课程作为高等院校相关专业学生进入大学后所接触的第一门基础课,,在整个化学知识体系构建中处于非常重要的地位。但是,由于高考改革导致的高中阶段化学知识储备、高中与大学阶段学习方法的巨大差异、授课内容信息量大与可自主支配时间有限等因素,导致许多本科生感觉跟不上无机化学的学习进度,甚至丧失对相关专业的学习热情[1-3]。其中较难的部分为物质结构,尤其是原子结构、分子结构章节知识点的学习,需要学生在极短的时间内充分发挥空间想象力从微观角度去认知一个全新的量子世界,这使很多学生力不从心、甚至直接放弃相关知识点的学习。如果能在微观结构教学中引入互动性教学模式,让学生亲自动手将不同理论模型呈现在眼前,将会有效提升学生的学习积极性。
为此,可以利用Orbital Viewer为辅助,在微观结构教学过程中引入互动性教学。Orbital Viewer(OV)是一款简便的化学结构学习软件,它能根据输入的不同参数绘制相应的三维原子轨道、分子轨道及成键类型示意图,能根据个人爱好调节显示效果,将结果输出为VRML格式以方便浏览。该软件可以通过输入各个量子数、原子的坐标参数等,绘制原子轨道和键合形式。总之,该软件操作非常便捷、占用资源较小,非常适合在课堂教学过程中,或者学生在课后体会学习等使用。免费下载网址为http://www.orbitals.com/[4]。
“百闻不如一见,百见不如一行”,因此,以OV为辅助在微观结构的教学过程中实施互动性课堂,将立体的结构特征呈现在学生面前,让学生亲自去绘制原子轨道、共价键形式等,使教学回归互动和实践,能有效提高学生的学习热情和积极性,在潜移默化中培养学生的科学素养[5-7]。
1 课程实施教学条件
本文介绍的互动性课堂实施主要针对材料化学专业学生,适合在30人以下的课堂实施,以保证课堂的实施效果。学生需要自带笔记本电脑以方便操作。原子轨道的知识点构建包括:教师讲解不同原子轨道的薛定谔方程的解,电子云的角度、径向函数分布,师生间互动讨论等内容,约占2学时;共价键的知识点包含共价键的成键本质,不同类型σ键、π键的成键,师生间互动讨论,约占2学时。
2 依托Orbital Viewer为辅助实施原子轨道知识点的互动式课堂
【教学实施方案】在讲解原子结构的基础认知部分之后,学生已经对原子结构有了初步的认知,但绝大部分学生对原子结构的直观认知应该还是停留在“行星模型”,对原子结构的真实模型无法进行构建。因此,需要利用专业软件将具体形象化的原子结构呈现在学生面前。但传统方法是教师在多媒体上直接给出原子轨道平面照片,介绍每一条原子轨道的概率密度、概率的分布。此教学方法收效因人而异,有的学生能够迅速了解原子轨道的真实分布情况,但绝大部分学生仍很难建立有效的结构模型。为此,在原子轨道学习过程中依托OV为辅助的互动性课堂实施过程如下:
(1)详细流程示意图如图1所示。首先回顾知识点引入新课,让学生回顾各知识点含义,理解每一个参数的意义。
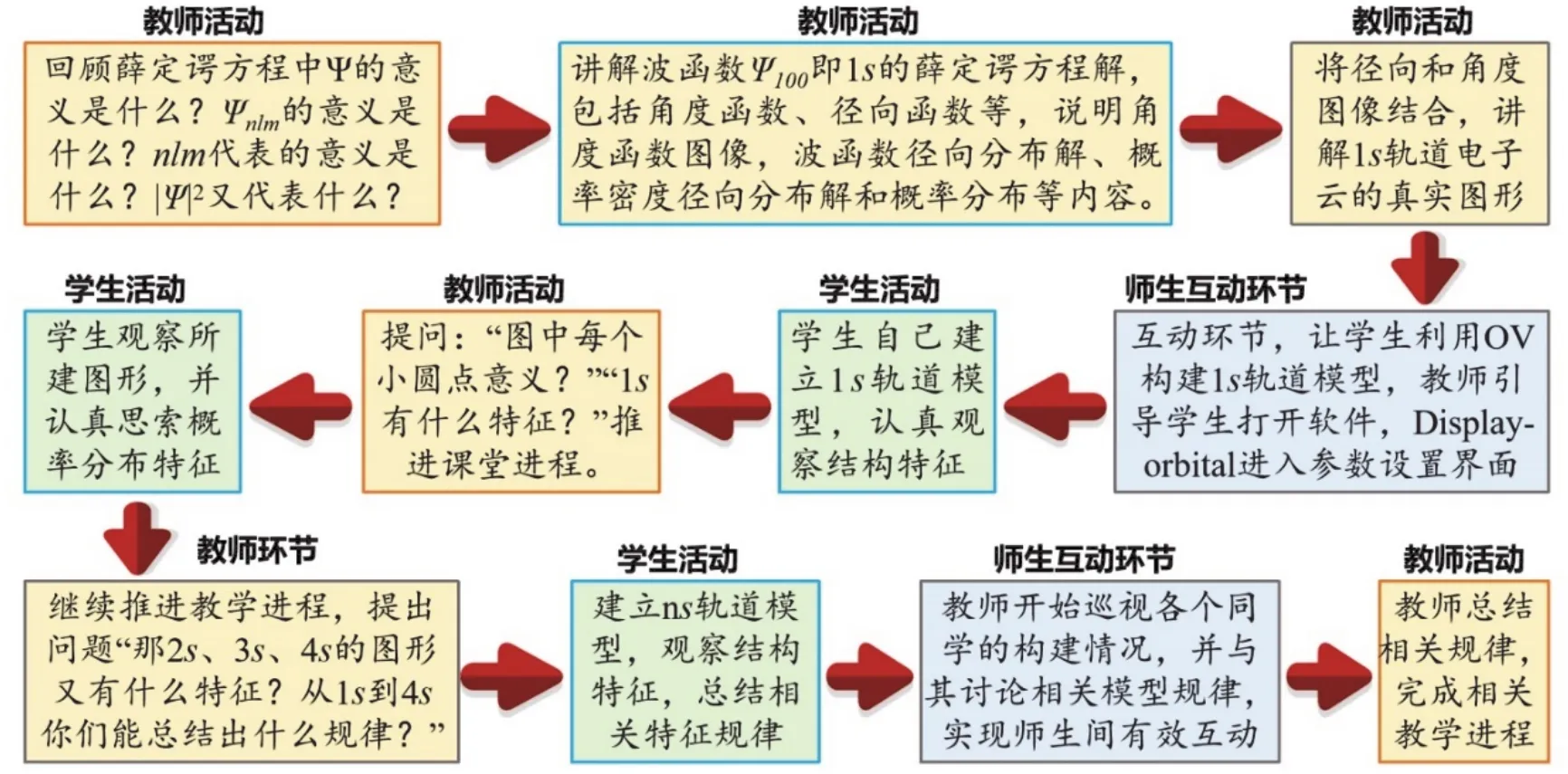
图1 ns原子轨道互动性课堂教学流程图
(2)以最简单波函数Ψ100即1s的薛定谔方程解为例,讲解包括角度函数、径向函数的意义。最后提出问题,“那氢原子真实的1s轨道应该是什么样子的呢?”接下来,引导学生利用Orbital Viewer来认知1s原子轨道的模型。教师具体介绍软件的操作界面、参数设置的意义,引导学生构建1s的轨道模型,并描述其结构特征,师生共同讨论完成1s轨道模型的建立,并进一步讨论探究图形的含义及特点。
(3)在教师问题引导下,学生修改参数去构建2s、3s、4s等轨道模型,认真观察所建模型并比较、归纳1s-4s的轨道模型的特征和规律,通过师生互动讨论得出“节面与峰值出现的规律为n-l个峰和n-l-1个节面”,建立立体原子轨道模型的正确认知。
(4)教师再通过问题引导学生自己去构建2p轨道的立体构型,观察结构特征,并继续去构建3p、4p的模型,师生互动讨论归纳节面和节点的规律。
(5)最后教师进行课堂总结,阐述原子轨道的真实模型、节面和节点的规律性等。
【教学实施重点】此教学环节实施的重点在于如何引导学生自己去创建原子轨道模型,教师要介绍OV软件的使用方法,从Display-orbital界面进入参数输入界面。在Display-orbital对话框里选择atom1,然后输入相应n、l、m和x、y、z等,便可生成相应轮廓,其中的Factor可以调整正负取值;在Polygon-Psi^2 probability设置参数,调整轮廓图中|Ψ|2的胖瘦;所画轮廓图可以另存为VRML 1.0文件以供后期查看。其中atom为所建原子,n、l、m为三个量子数,x、y、z为原子坐标。调整核外电子出现的次数点击Display-point options。在明白这些基本参数之后,学生可自行构建不同的原子轨道,并进行归纳、总结。
【教师提出的引导性问题】实施互动性课堂时,教师可以提出的引导性问题有:在构建1s轨道时,可以提问,“1s原子轨道输入的参数应该如何?1s轨道的图形是什么样子?”在构建1s轨道后,教师提问,“图形中的小圆点代表什么?其密集的区域说明什么?”继续推进其他s轨道时,提问,“2s、3s、4s轨道建立的参数如何设置?它们和1s一起有什么规律吗?”
【学生的学习活动】学生在整体教学活动中会保持较高的参与感,积极思索相关问题、模型构建的方法,并建立如图2所示原子轨道模型。但在归纳、总结2s、3s轨道时,对逐渐增加的层数理解不够彻底,此时需要教师去详细说明,指出概率分布的不同,有效实施互动性讨论。整体而言,学生普遍反映通过互动式教学模式实施能激发学生的学习兴趣,使用OV软件建立原子轨道还能在呆板的知识点体系中引入可视化元素,建立有效的科学模型。

图2 利用软件构建的不同原子轨道示意图
3 依托Orbital Viewer为辅助实施共价键知识点的互动式课堂
【教学实施方案】通过原子结构互动性课堂实施,学生已建立了正确的原子轨道模型,理解共价键的形成、电子云的重叠时就会有一定的理论基础。但由于高中阶段的学习基础,即对共价键的理解仅限于八隅律规则,学生一般很难理解相邻两个原子间共用一对自旋方向相反的电子、电子云发生重叠这一成键本质。而如何建立合理的共价键模型,对于学生理解后续的杂化轨道、价层电子对互斥理论、分子轨道理论等就显得尤为重要。为此,可尝试以OV为辅助实施互动式教学模式,具体实施如下:
(1)首先以H2为例,讲解共价键的本质,阐述两个自旋方向相反的电子和两个自旋方向相同的电子导致的异同,强调电子云或轨道的重叠,讲解σ键1s-1s的成键形式。引导学生去建立两个氢原子及其之间的σ键相互作用。引导学生观察两个电子云重叠的理论模型。
(2)教师讲解1s-1s之间排斥态的形式,即两个电子自旋方向相同时会导致两个原子核间电子云重叠情况的差别,并引导学生利用OV去建立相应排斥态模型,比较重叠和排斥两种状态的差异。
(3)继续引导学生构建1s-2p、2p-2p的σ键成键模型,同样比较重叠、排斥两种不同状态的差别,归纳总结相关规律。
(4)教师进行三种σ键成键形式总结,如图3,并依照此方式进行p-p、p-d等π键的学习及模型建立,如图4所示。
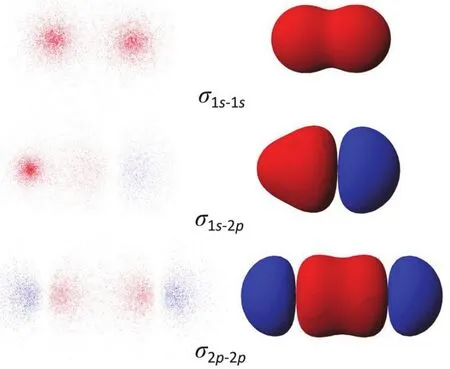
图3 s–s,s–p和p–p原子轨道形成σ键示意图
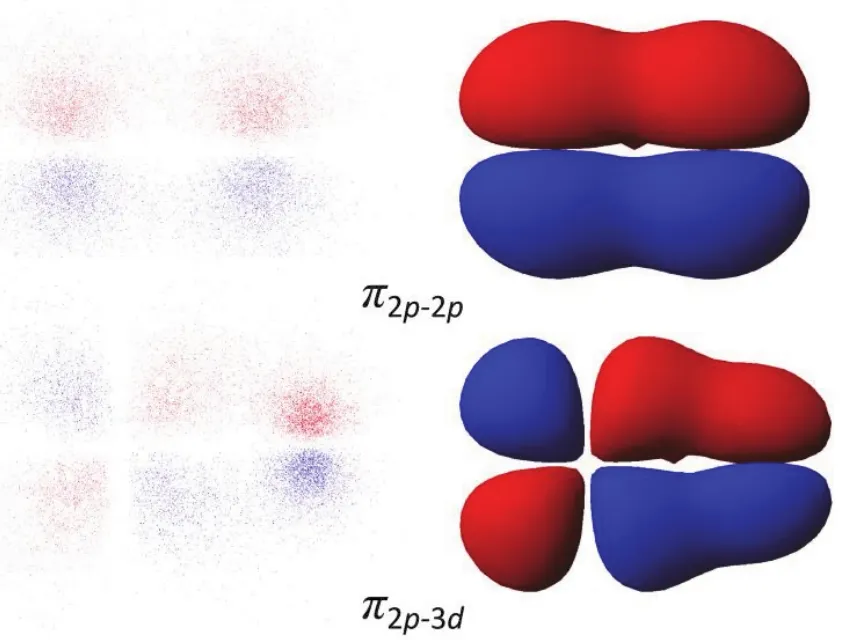
图4 p–p和p–d原子轨道形成π键示意图
【教学实施重点】此部分实施的难点在如何有效建立两个相互作用的原子。一般学生会在Display-orbital界面直接点击add按钮添加新原子,但最终结果会导致两个氢原子重叠。少数同学会知道需要输入新的氢原子坐标,将两个氢原子分隔开来。因此,教师在学生建立模型失败后,要引导提示学生建立坐标的概念,设置第二个原子xyz参数为(1,0,0),会出现两个独立的1s轨道,并没有发生相互重叠;再观察(1/2,0,0)、(1/3,0,0)形式,再思索出现这些差异的原因是什么,最终建立如图3所示正确成键形式。
为了说明排斥态的模型,告诉学生在atom2栏中的factor代表的意义为同号叠加,异号排斥。因此将输入值改为-1,得到新的排斥模型,如图5所示,引导学生比较其与重叠态的不同。
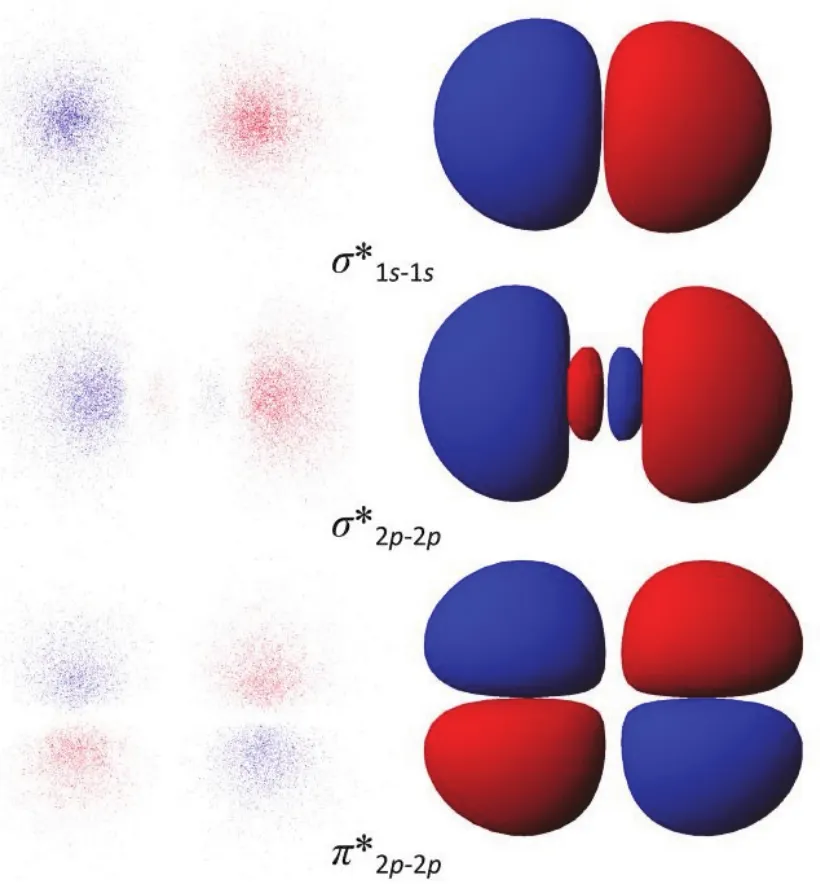
图5 s–s和p–p原子轨道形成σ*,π*键分子轨道示意图
【教师提出的引导性问题】在构建两个氢原子重叠模型时,提问“氢气分子中,每一个氢原子具有什么原子轨道?有几个电子?如何在OV里建立两个独立的氢原子?”在成功建立氢气分子模型后,再提问“既然已经清楚了1s-1s轨道的不同重叠形式,那是否有其他形式的σ键呢?比如1s-2p?2p-2p?下面请同学们自己建立相关模型,看看是否可以形成σ键?”
【学生的学习活动】共价键的理论模型的构筑相比原子轨道知识点的学习,难度更大。因此,很多同学面对两个原子的构建成键理解上有一定的难度,很多同学不能理解参数factor的意义,不知如何区分重叠态和排斥态。因此,教师要根据实际情况注意讲解波的叠加和相消等干涉内容,引导学生建立相关模型。另外,学生在构建p-pπ键时,对磁量子数1,0,-1区分上认识不足,也需要教师重点讲解。学生普遍反映通过使用OV软件,能够清晰认知两种共价键成键形式及相关模型,尤其是理解了重叠态和排斥态对于稳定体系的差异,也为后续学习杂化轨道理论、分子轨道理论等奠定了基础。
4 依托Orbital Viewer为辅助实施分子轨道知识点的互动式课堂
分子轨道理论是共价键理论当中非常重要的知识点,亦是学习上的难点。从知识储备层面上看,学生已经掌握了多电子原子核外电子排布规则、现代价键理论等,通过OV已经建立了一定的原子、分子内微观结构理论模型,均为本节课打好了学习基础。但从知识体系构建、科学能力层面来看,由于学生刚刚学习了微观物质结构,尤其是全新的分子轨道理论,会导致该部分知识点学习理解上的困境。此部分知识点教学同样可尝试以OV为辅助实施互动性课堂。教师同样可以在课堂上提出问题,让学生自己去建立相关模型(如图5所示),观察两个原子间的成键轨道、反键轨道对共价键成键的贡献,进而充分发挥学生的主观能动性,培养善于思考、严谨求实的科学素养。
5 依托Orbital Viewer为辅助讲解δ键的互动式课堂
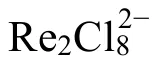
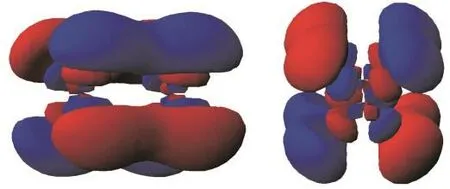
图6 5d–5d原子轨道形成δ键示意图
6 互动性课堂实施教学反馈
针对原子结构、分子结构教学过程中传统教学模式的弊端,导致教学过程封闭、内容乏味、收效较低、科学性较差,尤其是学生的主观能动性无法得到充分调动,严重影响了相关专业学生核心素养的培养。因此,在原子结构、分子结构章节中实施互动式教学,是改善相关教学现状、提高教学质量的有效措施。利用OV实施的互动式教学,能从学生的认知特点和思维模式出发,增强学生的体验感,使化学学习回归实践,尤其是能有效提高学生的学习积极性和主动能动性。此互动式教学模式针对材料化学专业学生已经实施了几届,学生普遍反映能有效提高学生对微观结构认知的直觉性,并且对化学知识点的学习产生了浓厚的兴趣,极大增强了学生的主观意识,提高了学生的学习积极性和学习效率。因此,互动式教学模式是符合当前大学生学习习惯的一种有效模式,这也要求任课教师开发更多的互动式教学模式以适应当前教学模式的需求。

