镓元素在医疗卫生领域的应用:以抗癌与抗菌为例
彭信心,许李智,张佳仪,景彦博,田松林,吴颖涵,曹润禹,张俊龙
1北京分子科学国家研究中心,北京大学化学与分子工程学院,北京 100871
2北京大学医学部药学院,北京 100191
1 引言
金属及其化合物在医药学中的应用已有几千年的历史,在现今医药领域中占据着不可忽视的地位[1]。与传统有机小分子药物相比,金属药物有着更丰富的光、电、磁和放射化学性质,有望被开发为多功能诊疗试剂[2]。此外,其中心金属独特的配位化学性质,有望打破有机小分子药物的“锁钥原理”,并以多种作用方式达到疾病治疗的目的[3]。目前,多种金属药物在临床诊断和治疗中得到了广泛的应用,如金属钆(Gd)配合物作为磁共振成像(MRI)造影剂用于诊断各脏器病变[4];顺铂(cisplatin)作为临床抗癌药物,具有广谱的抗癌活性[5];准金属药物三氧化二砷(As2O3)近来被用于治疗急性早幼粒细胞白血病(APL)[6];铋(Bi)剂药物在治疗幽门螺杆菌(H.pylori)引起的急慢性胃炎和胃溃疡中表现出色[7]。然而,目前临床使用的金属药物中也存在一定的安全隐患,如:顺铂在临床使用中表现出一定的肾毒性[8]、耳毒性[9]、神经毒性[10]和消化道毒性[11];而Gd造影剂则容易引起肾功能衰竭患者产生肾源性系统纤维化(NSF)。所以,开发适应症广、特异性好、副作用小的新型金属药物势在必行。
镓(Ga)位于元素周期表中的第四周期第IIIA族,在化合物中通常以+3价稳定存在,下文中以Ga(III)代表三价镓化合物。Ga(III)化合物在临床上有着广泛的应用[1,12]:放射性同位素67Ga在衰变过程中捕获电子释放γ射线,用于临床淋巴瘤的分期诊断[13];68Ga则能释放正电子,用于临床正电子断层扫描成像造影剂[14];硝酸镓(Ga(NO3)3)更是被用于临床肿瘤相关的高血钙症的治疗[15]。在治疗过程中,并未报道有明显的毒副作用。因此,Ga(III)化合物作为诊疗药物的开发具有重大应用前景。本文从化学原理出发,对Ga(III)在抗癌和抗菌方面的相关研究进行了简要总结,并对未来Ga(III)基药物的开发进行了展望。
2 Ga(III)的化学

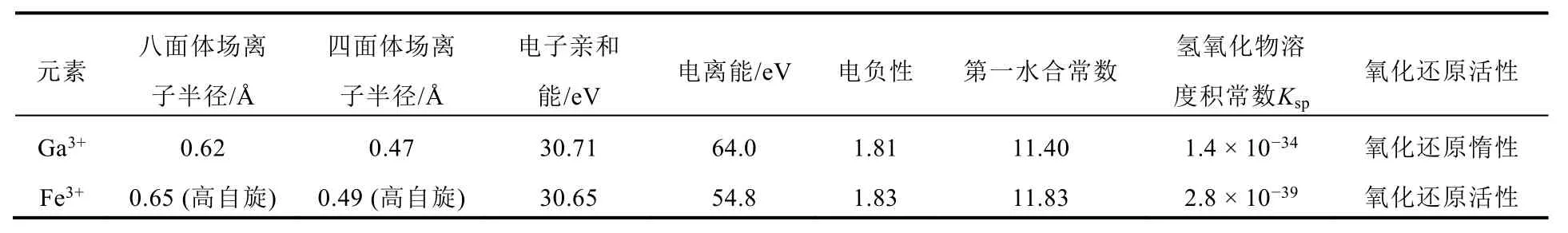
表1 Ga3+和Fe3+化学性质对比
3 Ga(III)用于肿瘤成像:68Ga(III)用于正电子发射断层扫描成像(PET)
正电子发射型计算机断层显像,即PET,是目前广泛应用于肿瘤诊断的显像技术。临床上,以18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG,图1)为显影剂的PET显像技术在淋巴瘤诊断上具有高灵敏度和高精确度被广泛应用[17]。而68Ga(III)由于具有较短的半衰期(68 min)和较高的正电子衰变率(89%)从而被用作PET成像试剂。近年来,在68Ga(III)-DOTA的基础上衍生出连有各种靶向小分子或靶向肽而设计出的不同功能的新型PET显影剂(图1)正在研发,并走向应用。

图1 18F-FDG和68Ga-DOTA衍生物的结构
传统PET显影剂18F-FDG会在高葡萄糖消耗的组织中大量积聚,由于恶性肿瘤生长活跃、代谢旺盛,对葡萄糖呈现高摄取,因此用18F-FDG作为显影剂可以进行肿瘤的显像。但也由于18F-FDG依赖于葡萄糖的作用机理,使得18F-FDG PET检查对患者血糖水平的控制要求很严格。且脑部组织代谢也比较活跃,对葡萄糖的摄取高,因此18F-FDG在脑组织本底高,难以对脑部肿瘤进行显像。而围绕68Ga(III)研发的新型显影剂68Ga(III)-FAPIs以成纤维细胞激活蛋白(FAP)为靶点,选择性地靶向FAP阳性的组织。基于这种靶向性作用原理的68Ga-FAPIs显影剂相对于18F-FDG具有本底低的优势,因此也拥有着更高的检出率(图2)[18]。

图2 在9天内对6名患者(6个不同的肿瘤实体)进行18F-FDG PET和68Ga FAPI PET显像的个体内比较
此外,18F-FDG在前列腺癌诊断中的应用有局限性,相比之下,另一种新型显影剂68Ga(III)-PSMA-11在前列腺癌显像方面有着显著优势。前列腺特异性膜抗原(PSMA)在前列腺癌细胞表面高表达,靶向PSMA的放射性药物可以与PSMA结合并在前列腺癌细胞中积累。因此68Ga(III)-PSMA-11可以应用于前列腺癌早期诊断、术前分期等[20]。支气管肺类癌(Broncho-pulmonary carcinoids)细胞表面高表达生长抑素受体,因此68Ga(III)-DOTATOC、68Ga(III)-DOTATE等用68Ga标记生长抑素类似物的药物成为了诊断支气管肺类癌的有效工具,其诊断性能优于18F-FDG。特别地,与18F-FDG相比,68Ga(III)-DOTATOC在典型类癌的诊断中表现最佳,而18F-FDG在非典型类癌的诊断中表现较好[21]。
4 Ga(III)的抗癌作用
1931年,Levaditi等[22]发现酒石酸镓可能对患梅毒的兔子和被伊氏锥虫感染的小鼠有治疗作用,从这时起人们便意识到Ga(III)可能有药用价值。之后,科研人员发现Ga(III)的放射性同位素67Ga(III)可以在肿瘤部位聚集,并发生衰变放出γ射线,67Ga(III)显像技术开始被应用于癌症诊断,以非放射性Ga(III)的肿瘤治疗作用为核心的药物研发也不断发展。
4.1 Ga(NO3)3及其抗癌机制
硝酸镓(Ga(NO3)3)是第一个获批进入临床使用的Ga(III)的化合物,最初被用于治疗癌症诱发的血钙过高。同时实验室和临床研究表明,Ga(NO3)3对膀胱癌和非霍奇金淋巴瘤也有一定的治疗作用。相比于传统的化疗药物,Ga(NO3)3不会抑制骨髓的造血作用,患者用药后仍可以正常产生白细胞和血小板,副作用相对较小[23]。
Ga(NO3)3的抗癌机制研究由来已久。由于硝酸根离子的弱配位性,Ga(NO3)3在体液环境中被认为完全电离。电离出的Ga3+发生水解,与磷酸根结合或与其他生物分子相结合,因此Ga(NO3)3的药效主要来自于游离Ga3+及其衍生物种。考虑到与Fe3+的相似性,Ga3+在体内的转运和细胞摄取等一系列行为与铁相关蛋白有关。
4.1.1 Ga(III)的转运和细胞摄取
人体内的转铁蛋白约有30%与Fe3+结合,仍有70%左右游离在内环境中[23]。这为Ga3+与内源转铁蛋白结合提供了条件。由于Ga3+与Fe3+在原子半径、电荷量和配位方式上都很相近,早先认为,Ga3+与Fe3+共用一条依赖转铁蛋白进入胞内的途径。
转铁蛋白是一种大小约为79 kD的双叶蛋白,两个叶中分别有一个Fe3+的结合位点。这一结合位点高度保守,是由两个酪氨酸残基,一个组氨酸残基、一个天冬氨酸残基和两个生物体内的碳酸根离子(或碳酸氢根离子)构成的变形八面体。结合了铁的转铁蛋白与细胞表面的转铁蛋白受体(TfR)结合,经受体介导的胞吞过程进入细胞内[24]。
Fe3+运输过程中,胞吞产生的囊泡会与细胞内的酸性核内体(endosome)融合。随着pH的降低,Fe3+从转铁蛋白的铁结合位点中释放出来[25],被铁还原酶还原成亚Fe3+后,经二价金属转运蛋白1(Divalent Metal Transporter 1,DMT1)运送出内体。Ga3+与Fe3+主要的不同在于Ga3+具有氧化还原惰性。这一区别使得Ga3+在体内不能被还原,也就不能由DMT1运出内体。需要更多的实验来阐明Ga在细胞内的运输途径。对肝癌模型鼠的一些研究显示,代谢旺盛的癌细胞中存在着一种大小约为45 kD的Ga(III)结合蛋白[26]。由此猜测Ga3+进入细胞后的囊泡很可能被溶酶体处理,从大小为79 kD的转铁蛋白上脱离,与细胞内的其他蛋白结合。Harris和Sephton[27]的实验表明,向体外培养的小鼠骨髓瘤细胞中添加外源转铁蛋白能促进其Ga(III)摄取。转铁蛋白受体单克隆抗体实验也表明阻断转铁蛋白与转铁蛋白受体的结合后,细胞的Ga(III)摄取量减少[28]。由于癌细胞对铁需求旺盛,在癌细胞中转铁蛋白受体的基因高度表达[29,30]。这一途径在癌细胞吸收Ga3+的过程中起主要作用。

4.1.2 抑制核糖核苷酸还原酶(RR)
大部分高校医院领导对全面预算管理工作缺乏必要的认识,认为编制预算的目的和需求主要是申请经费和完成学校上级部门布置的预算任务,没有认识到预算是一种管理的手段。预算工作基本是医院财务科室根据学校上级部门的要求编制来年的预算上报,学校上级部门下达预算拨款额度后,年末根据财务核算结果进行对比分析。
核糖核苷酸还原酶(RR)是一种异二聚体,包含M1和M2两个亚单位。当细胞进入S期时,M2亚单位的表达增加。此亚单位包含双核铁中心和酪氨酸自由基,这两种自由基对其活性都至关重要。细胞增殖需要稳定的铁供应,以维持新合成的M2亚单位的活性。
Chitambar[23]指出,Ga(NO3)3通过两种不同的途径影响核糖核苷酸还原酶的活性。一方面Ga3+作为Fe3+的竞争性抑制剂,抑制细胞铁摄取同时占据核酸还原酶的活性中心,从而抑制核酸还原酶的活性。与Ga(III)结合的转铁蛋白共同培养6-24 h的人类HL60白血病细胞在EPR光谱上显示核糖核苷酸还原酶M2亚基中的酪氨酸自由基信号减弱,伴随着脱氧核糖核苷三磷酸(dNTP)池的减少[37]。这与M2亚基活性的丧失是一致的。通过向细胞裂解液中添加硫酸亚铁铵,该信号在10 min内恢复至正常水平。此研究表明,核糖核苷酸还原酶M2亚基活性的减小不是由于它数量的减少,而是该蛋白缺乏发挥生理作用所必须的铁中心。另一方面Ga3+与底物(CDP和ADP)结合形成复合物,从而抑制酶与底物的结合。无细胞直接酶测定的实验结果显示,Ga(NO3)3抑制了CDP和ADP还原酶的活性[38]。实验表明,由于核苷酸可以与Ga结合形成复合物,Ga对核糖核苷酸还原酶的活性抑制可以解释为Ga(III)-核苷酸复合物形成[39]。
4.1.3 诱导线粒体功能损伤
线粒体是维持细胞能量代谢的重要的亚细胞结构。研究表明Ga(NO3)3能通过诱导细胞过表达促凋亡蛋白Bax,从而诱导线粒体途径的细胞凋亡。将Ga(NO3)3与急性T淋巴细胞白血病细胞CCRFCEM和弥漫大B细胞淋巴瘤细胞DoHH2细胞一起孵育后,发现两种细胞的凋亡率提升。加入Bax抑制肽可以保护细胞减少凋亡,同时蛋白质印迹显示活性Bax水平随着Ga(NO3)3浓度的增加而增加,可知Ga(III)激活Bax这种促凋亡蛋白。Bax在线粒体外模寡聚形成孔导致外膜通透性增加,使细胞色素c从线粒体中释放流失。细胞色素c是线粒体电子传递链的重要组成部分,它的缺乏会导致其对氧自由基调控受阻,造成ROS产生量增加,引起氧化应激[40-44]。
除此之外,Ga(III)的配合物还能直接抑制线粒体呼吸链中的复合物,从而诱导产生氧化应激。实验中将麦芽糖酸镓(GaM)与胶质母细胞瘤细胞共同孵育,发现细胞线粒体功能特别是其上复合物I功能受阻,引起氧化应激造成细胞凋亡。Ga3+与Fe3+具有相似性,而且它能更容易地代替Fe与Fe-S簇支架蛋白IscU结合,从而干扰Fe-S簇组装机制。实验通过检查添加的Ga(III)对体外簇组装反应的影响证明了Ga(III)抑制Fe-S簇组装速率。而Fe-S簇是线粒体电子传递链以及三羧酸循环的重要组成部分,于是Ga(III)就通过抑制铁硫簇组装来破坏线粒体结构,导致有氧呼吸过程受阻从而引起细胞凋亡[45,46]。
4.2 新型Ga配合物
Ga(NO3)3的口服生物利用度很低,一般只能通过静脉注射给药。实验结果显示,通过静脉注射持续低剂量给药5-7天可以使血浆中的Ga(III)浓度维持在0.9-1.9 μg·mL-1,停止给药4天后降至0.45-0.7 μg·mL-1[47]。但这样的给药条件较高,操作较复杂,需要有相应设备和医疗条件。除此之外,硝酸在体液中电离后,游离的Ga3+能发生水解、与磷酸根等阴离子沉淀以及与其他生物大分子结合等化学过程,导致其物种分布十分复杂,故其有效作用浓度较低,且作用机制十分复杂。为了解决这些问题,人们采用配位化学的手段,开发具有生物活性的配体。通过配体的螯合大大简化了Ga(III)的物种分布,有效提高了有效浓度。
4.2.1 二齿配体和三齿配体
例如,KP46的配体具有极强的金属螯合性,因此其化学性质更为稳定,口服后可以通过肠胃吸收进入血液。且大部分KP46在血液中可以保持其结构和性质,不与运铁蛋白等生物分子结合,药物在人体内的有效浓度得以增加。近期研究还表明,KP46的细胞毒性可能与替换细胞骨架蛋白有关。KP46可以抑制细胞中整合素β1和该酶催化的一种细胞粘附性蛋白的表达,从而抑制细胞生长并降低定位于膜上的整合素β1的数量[23]。
再例如Ga(III)的苯胺硫脲类药物(Ga-thiosemicarbazones,图3),这种配体与一般的配体相较而言,对核糖核酸还原酶的抑制效果更强,其细胞毒性也显著提高[48-50]。吡多醛异烟肼腙(Pyridoxal isonicotinyl hydrazone,PIH,图3)及其类似物是可以阻碍多种恶性肿瘤细胞的增殖的亲脂性铁的螯合物[51,52]。PIH可以向细胞运送铁来促进细胞生长并维持其正常功能[53],同时可以结合并运输Ga(III)进入细胞。而PIH结合Ga(III)之后形成的Ga(III)-PIH可以不通过转铁蛋白进入细胞,并且能展现出比单纯的PIH更强的细胞毒性[51,54,55]。
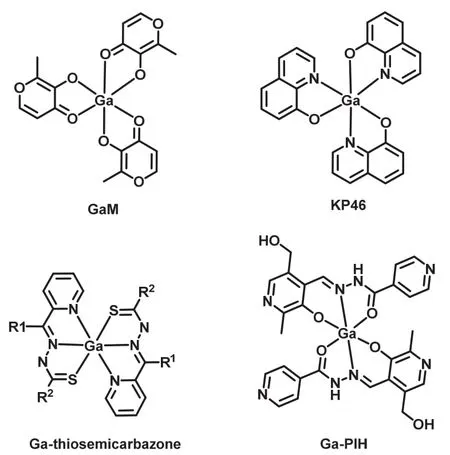
图3 被评估用于临床应用的Ga(III)化合物的化学结构
4.2.2 四配位平面配体
过于稳定的六配位结构可能会阻碍金属和生物分子之间的相互作用。受顺铂的两个好离去基团的启发,近来,以卟啉和Salen(N,N’-双水杨醛缩乙二胺)为代表的平面四齿配体配合物发挥的抗癌活性被广泛研究,并展现出临床应用前景。这类配合物具有一个平面方形的四齿配体和两个不稳定的轴向溶剂配体,两轴向配体在接触生物分子时可被取代,加强了与生物分子的相互作用,提高了药物活性。
近年报道的Ga(III)-salen配合物(Ga-1),表现出比顺铂更强的抗肿瘤活性(图4)。该化合物通过被动扩散途径进入细胞,定位于内质网、线粒体和溶酶体中,诱发内质网应激和线粒体功能损伤。机制研究指出,Ga-1通过靶向蛋白质二硫键异构酶(PDIA3),一种催化底物蛋白形成二硫键而正确折叠的酶,从而诱发错误折叠蛋白的累积和未折叠蛋白反应,致使细胞发生内质网相关的死亡[56]。

图4 Ga(salen)Cl的结构示意图
活体实验表明(图5),在使用Ga-1、PBS或顺铂处理肿瘤小鼠21天后,Ga-1组小鼠肿瘤的肿瘤体积和重量均较小,肿瘤内肿瘤细胞坏死程度较高,且小鼠的肾脏和肝脏都并未受到太大损伤,可见Ga-1是治疗效果较好、生物安全性较高的抗癌物质。
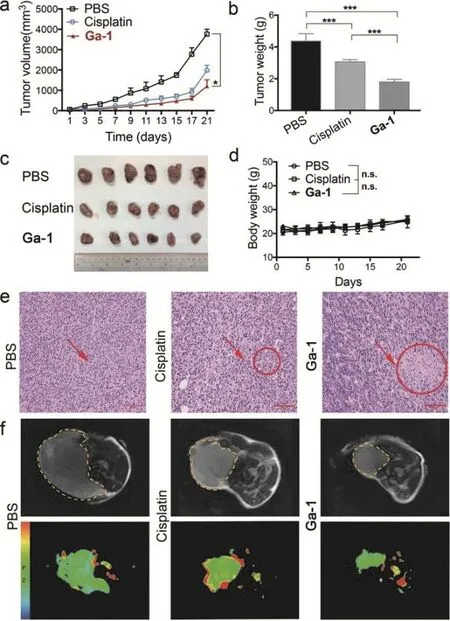
图5 以PBS为对照的Ga-1和顺铂对载有HeLa细胞小鼠的治疗作用[56]
目前,这些新型的Ga(III)配合物药物还有待进一步的研究以决定它们是否可以进入临床试验。
5 Ga(III)的抗菌作用
镓元素抗菌隶属于金属抗菌的范畴,由于金属抗菌具有广谱抗菌且抗菌性能优良、不产生耐药性的特点而受到人们的青睐,已经成为目前研究的重要方向。每一种抗菌金属元素都有其特殊的一种或多种抗菌机理,通常在不同的环境影响下,选择相应的方式来抑菌[57]。在众多的同类抗菌剂中,Ga(III)表现出抗菌谱广、抑菌性高等特点。不同环境下对不同Ga(III)化合物对不同种细菌的抑制性进行大量研究和对比[58],发现Ga(III)的抗菌能力具有普适性,Ga(III)作为无机抗菌剂将在人类的生产生活中发挥更大的作用。
抗菌机制表明,镓元素卓越的抗菌能力与细菌的生物被膜有紧密关系。细菌生物被膜(biofilm)附着在生物或者非生物表面,由细菌及其分泌的糖、蛋白质和核酸等多种基质组成,是造成病原细菌持续性感染、毒力和耐药性的重要原因之一[59]。
由于镓元素与铁元素具有相似性,在细菌相关的生化反应中可能会形成竞争关系。而Fe(III)在生物被膜的形成过程中有重要作用,例如生物体内Fe(III)作为辅酶参与了细胞中众多氧化还原相关的酶。这部分Fe(III)含量极少,其功能大多是可逆的转运或接受电子(这就体现了铁变价的作用),对每一个细胞的代谢至关重要[60]。而Ga(III)在替代Fe(III)之后无法起到相同的作用,所以生物被膜的形成受到阻滞,细菌的侵染能力也由此受到抑制。
Kaneko等人[61]开展的实验中,在细菌体内表达绿色荧光蛋白,可以直接地看到这种竞争导致阻滞的过程。图6A中在加入Ga(III)后细菌群落明显出现了裂解,且细菌总体数量大幅度减少;图6B中在一定Ga(III)浓度的基础上,递增加入Fe(III)的浓度,发现细菌群落和生物被膜有逐渐恢复的趋势[62]。上述实验说明了Ga(III)能通过抑制细菌对Fe(III)的利用从而破坏生物被膜,抑制细菌群落的形成。

图6 Ga(III)可防止铜绿假单胞菌生物膜的形成[61]
除此之外,2019年孙红哲课题组[63]报道了新的镓的抗菌机制。作者通过将金属蛋白质组学与转录组学和代谢组学相结合的方法,首次探测到了铜绿假单胞菌中Ga(III)的结合蛋白:RNA聚合酶的两个亚基RpoB和RpoC,并证明了Ga(III)通过靶向细菌必需的RNA聚合酶来抑制细菌RNA的合成,从而降低代谢率和能量利用率。值得注意的是,外源性醋酸盐的加入能够大大增加Ga(III)的抗菌活性。作者将其归因于醋酸盐增加了细菌对Ga(III)的摄取,从而降低细菌三羧酸循环(TCA)的速率,起到持久的抑菌作用。
6 总结与展望
本文介绍了Ga(III)化合物在生命医学领域的应用:包括PET肿瘤组织成像、抗肿瘤和抗菌等方面。重点从化学原理出发,介绍了Ga(III)与Fe(III)的相似性和不同点,以及由此衍生出来的抗癌抗菌活性:即Ga(III)作为Fe(III)的竞争性抑制剂,取代病灶(肿瘤或感染)部位的Fe(III),从而干扰病灶部位的铁稳态,达到抗肿瘤或抗菌活性。
简单Ga(III)盐在体内具有物种分布复杂、生物相容性差、利用效率低等缺陷。人们提出了通过配位化学的手段,使用具有一定生物活性的配体来稳定中心Ga3+离子,从而达到提高药物有效作用浓度和生物相容性的目的,同时还提供了新的抗菌或抗癌机制。而这些新型Ga(III)配合物的开发和研究为后续镓基药物的发展提供了不一样的思路,并奠定了一定的理论基础。未来Ga(III)基药物的开发,应注重新型配体的设计和新机制的探寻,着眼于配合物构效关系的研究。相信在未来对其构效关系进行深入研究后,能够指导Ga(III)基药物的设计,使Ga(III)基药物在临床使用时提供更多选择,取得更好的效果。

