石膏热分解性质及硫化反应行为
祁永峰, 代文彬, 王 云, 苟海鹏, 陈学刚, 裴忠冶, 陈宋璇
(中国恩菲工程技术有限公司, 北京 100038)
目前,国内脱硫石膏(CaSO4·2H2O)年产量达到8 000万t以上[1-2],利用率在80%左右,主要以水泥添加剂和石膏建材方式应用[3],与先进国家利用率100%还有一定的差距。近年来,石膏的高温热解技术一直是理论研究的热点,主要围绕将石膏中CaSO4分解成CaO和SO2,达到CaO组分的化学循环利用和SO2烟气制酸目的[4-5]。研究者[6-8]发现焦炭能降低硫酸钙的分解温度,且反应温度、碳硫比以及氧化铁含量均对硫酸钙分解产物的物相生成有明显的影响。韩翔宇[9]、郑绍聪[10]等利用热重分析仪研究可控气氛条件下,不同温度对硫酸钙的分解温度影响规律,发现随着温度的升高,硫酸钙的反应速率明显加快,分解速度显著提高,且石膏的还原分解存在生成CaO和CaS的竞争关系。孟令佳等[11]对比研究了微波加热相对于常规加热还原分解石膏的优势,分析了不同反应条件下CaSO4与C/CO的反应机理模型,提出了微波加热分解石膏是未来工业化的一个重要发展方向。
通过前人的研究可知反应气氛、反应温度、配料碳硫比及掺杂氧化铁等因素对石膏分解脱硫的影响规律,但以上都是围绕固体石膏脱硫产出CaO循环利用和SO2烟气制酸方面开展的相关研究,均未涉及有色冶炼熔融条件下,石膏作为硫化剂参与冶炼的物理化学反应机理。本文主要围绕石膏作为硫化剂参与有色造锍熔炼过程中的硫化反应机制,系统介绍石膏热分解机制及固硫的调控因素,揭示提高熔融还原条件下石膏硫化剂硫利用率的关键因素。
1 试验介绍
1.1 试验原料及试剂
试验原料采用分析纯CaSO4·2H2O (纯度≥99%),将其在350 ℃下煅烧4 h制得无水CaSO4,以无水CaSO4作为实验原料,从而避免高温下H2O对试验的影响。固- 固碳热分解试验中的还原剂为分析纯石墨粉(纯度>99.9%)。气- 固碳热分解试验中的还原剂为气瓶高纯CO与气瓶高纯CO2的混合气体,其中,气瓶CO纯度≥99.99%,气瓶CO2纯度≥99.99%。
1.2 试验设备
1)采用卧式管炉设备完成高温试验,设备型号为科晶GSL- 1600X- Ⅱ双温区管式电炉。
2)采用热重分析仪检测硫酸钙的热分解反应性质,设备型号为美国TGA55。
3)采用碳硫红外分析仪分析反应物料中碳、硫含量,设备型号为EMIA- 920V27。
4)采用X射线衍射仪分析反应物物相,设备型号为日本Rigaku SmartLab 9 kW XRD。
5)采用扫描电镜观察渣中元素分布情况,设备型号为美国MLA250。
1.3 试验方法及步骤
1.3.1 碳热还原试验
利用热力学软件Fact- Sage理论分析CaSO4的热分解行为。将无水CaSO4与石墨粉按照C/CaSO4摩尔比分别为4、3、2、1.5、1、0.5进行配比,不同摩尔比对应C的质量分数如表1所示。将物料充分混匀后,压制为直径10 mm的圆饼并称重,记录反应前质量。试验加热设备为卧式管炉,如图1所示。

表1 不同C/CaSO4摩尔比反应后的残余碳含量
1.3.2 气体还原试验
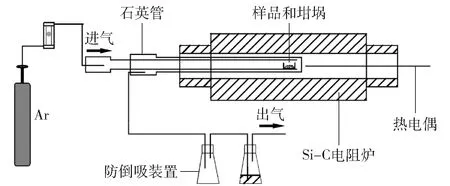
图1 碳热还原试验设备示意图
将压制好的圆饼放入刚玉坩埚,并置于卧式管炉进行加热,加热速度为10 ℃/min,加热过程采用氩气保护,氩气流量为400 mL/min,反应温度分别设置为900 ℃、950 ℃、1 000 ℃,保温时间为1.5 h。
利用热重分析仪,如图2所示。将3组试验样品分次放入坩埚内,以加热速度15 ℃/min升温至1 000 ℃,整个过程中通入40 mL/min的氩气进行保护,待样品温度稳定在1 000 ℃后,开始保温,并关闭氩气,同时通入CO和CO2开始还原反应。试验通过控制CO/(CO+CO2) (摩尔比)来控制反应过程中的氧势,分别设置CO/(CO+CO2)的摩尔比为0.25、0.50和0.75,试验过程中使用热重分析仪的数据采集系统记录反应失重和吸放热情况。

1-质量流量计;2-空白坩埚 (热分析参比);3-样品盛放坩埚;4-支撑架及热电偶和差热检测装置;5-差热分析仪主体;6-程序操作和数据采集电脑图2 气体还原试验设备连接图
1.3.3 检测方法
通过XRD (X- Ray Diffraction 7000) 对还原产物的物相进行分析,使用碳硫红外分析仪对还原产物的硫含量进行分析,并通过相应公式计算CaS转化率。试验通过对反应前后的样品失重率来研究碳热反应的进程。
2 石膏分解热力学分析
硫酸钙的热分解过程中的主要化学反应见式(1)~(7)。
CaSO4+2C=CaS+2CO2
(1)
3CaSO4+CaS=4CaO+4SO2
(2)
CaSO4+3CaS=4CaO+2S2
(3)
CaS+2SO2=CaSO4+S2
(4)
C+CO2=2CO
(5)
CaSO4+4CO=CaS+4CO2
(6)
CaSO4+CO=CaO+SO2+CO2
(7)
使用热力学软件Fact- Sage绘制C/CaSO4的二元平衡相图,如图3所示。由图3可知,在一定范围内CaSO4的完全分解温度随着C含量的增加而降低。在A点之前反应产物只有CaS与CaSO4,但当C/CaSO4接近2时(对应B点),反应产物主要为CaS。

图3 不同C/CaSO4二元相图
3 试验结果与讨论
3.1 固- 固碳热分解试验
3.1.1 高碳配比石膏分解试验C/CaSO4摩尔比(简写为C/S)为4、3、2时,石膏热分解试验样品的失重率如图4所示。图4表明,在相同的反应时间内,随着反应温度的升高,样品失重率增加,反应速度加快;当反应温度为1 000 ℃时,C/S比为4、3的样品30 min反应完全;当反应温度为950 ℃时,样品完全反应需要的时间在90 min以上;当反应温度为900 ℃时,相同时间内,样品的失重率远低于1 000 ℃和950 ℃下的反应速度。
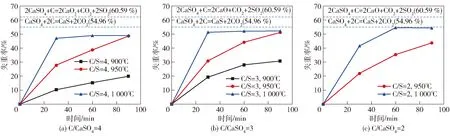
图4 样品失重率随时间的变化
反应产物的XRD图谱如图5所示。当反应温度为1 000 ℃,反应产物中没有CaSO4的衍射峰,表明CaSO4已充分分解。当反应温度为900 ℃,反应产物中仍存在未反应的CaSO4和石墨,证明在900 ℃下分解反应未完成,这与此温度下失重率较低的结果相吻合。

图5 反应产物XRD图谱
当C/S=1.5,反应产物主要为CaS、CaO和剩余的石墨,未发现CaSO4,表明石膏分解反应已完成。当C/S≤1时,反应时间延长至180 min,反应产物中除CaS、CaO和剩余的石墨外,还存在CaSO4的衍射峰,表明石膏分解尚未完成。
因此,当C/S≥2时,且反应温度为1 000 ℃时,CaSO4热分解反应完全,反应产物主要为CaO、CaS,以及剩余石墨碳。
3.1.2 配碳比对硫酸钙分解转化率的影响
CaSO4热分解转化为CaS的转化率ηCaS的定义见式(8)。
(8)
式中:ηCaS为CaS的转化率;MCaSO4和MS和分别为CaSO4的相对分子质量和S的相对原子质量;产物S含量由碳硫分析仪进行检测。
无水CaSO4固- 固碳热分解的CaS转化率的计算结果如图6所示。图6表明,随着C/S比的增大,CaS转化率增大;当C/S增加到3时,CaS转化率达到最大值81.33%;继续增加碳配比对CaS的转化率影响不大,当C/S增大至4时,CaS转化率与C/S为3时保持在相同水平。

图6 不同碳配比下的CaS转化率(1 000 ℃)
不同碳配比下的样品中CaO、CaS、C含量如图7所示。由图7可以看出,当C/S=3时,产品中CaS含量达到最大,约为71.19%。虽然C/S=4时的CaS转化率与C/S=3相同,但因为C/S=4时的残余C含量较高,因此C/S=4时的CaS含量低于C/S=3。此外,C/S=1时的C和CaS含量最低,CaO含量最高,这与其较低的CaS转化率相对应。

图7 不同碳配比下反应产物含量(1 000 ℃)
3.2 气- 固还原热分解试验
3.2.1 还原度对石膏分解的热重试验
不同CO/(CO+CO2)摩尔比下的失重及吸放热曲线如图8所示。物料失重情况及CaS转化率情况如表2所示。其中,第一次失重为脱除结晶水失重,第二次失重为完成CaSO4的热分解反应失重。

图8 不同还原度条件下的热重分析曲线
3.2.2 还原度对石膏分解转化率的影响
试验通过控制CO/CO2流量比调控氧势PO2,CO还原CaSO4存在反应式(6)和反应式(7)两个反应,反应式(6)的理论失重率为L1=47.02%(CaSO4→CaS),反应式(7)的理论失重率为L2=58.82%(CaSO4→CaO)。实际失重率Lsum应介于两者之间,如表2所示。基于两个反应对应的失重率差异和实际产物失重率Lsum,可以根据公式计算出两个反应的比例,从而确定CaS的转化率。设CaS转化率为ηCaS,其值可以通过式(9)计算。

(9)
式中:Lsum为CaSO4热分解实际产物失重率;L1为CaSO4转化成CaS的理论失重率,%;L2为CaSO4转化成CaO理论失重率,%;ηCaS为CaS的转化率。
由图9可知,当CO含量从25%增加至75%时,CaS转化率由39.78%增加到94.55%。从热力学角度分析,高CO/CO2属于低氧势状态,产物CaS更加稳定,反应更倾向于生成CaS。由图10可知,不同CO配比下,产物中CaS与CaO的含量,其变化趋势与CaS转化率相一致:随着CO配比增加,产物中CaS的含量增加,CaO含量减小。

图9 不同CO浓度下CaS与CaO的转化率(1 000 ℃)
由图6和图9对比可知,在1 000 ℃下,CO还原CaSO4得到的CaS转化率比碳热还原高。主要原因为是CO还原具有更好的气- 固反应条件以及更低的氧势,促进了CaSO4转化为CaS的反应。
4 石膏造锍熔炼硫化行为
4.1 模拟物料造锍熔炼
使用纯试剂模拟CuO- Fe2O3- SiO2- CaO体系的含Fe- Cu物料,模拟成分如表3所示。硫化剂CaS的添加量为理论量的1.0倍、1.15倍、1.3倍和1.6倍,反应温度1 450 ℃。

表3 模拟含铜物料的成分 %
造锍熔炼的金属回收率及硫利用率的计算公式见式(10)。
(10)

CaS加入后,铜锍与渣的分离情况如图11所示,经过硫化反应后,铜锍和渣相分离效果明显,熔渣玻璃化。在玻璃化条件下,熔渣具有良好的重金属固化能力。硫化反应产物铜锍物相XRD分析见图12所示。由图12可知,不同硫化剂CaS的配比条件下,均可获得铜锍产物,且铜锍品位可通过CaS配入比例进行调控。

图11 硫化分离结果(1 450 ℃,1.5 h,Cu/Fe=1,CaS加入量1.15倍)

图12 不同CaS加入量下分离出的铜锍XRD图谱
通过式(10)计算硫化钙的利用率及有价金属的回收率,具体结果如表4所示。由表4可知,将硫化钙作为硫化剂进行有色造锍熔炼,其中硫化钙的利用率大于75%,铜回收率可达98%,铁回收率低于23%,从而达到选择性还原硫化制备铜锍的目的,有效富集回收有价金属。

表4 硫化钙利用率及有价金属回收率
4.2 石膏造锍熔炼的拓展
目前,有色冶炼存在大量富含有价金属固废渣、镍/钴/铜吹炼渣及低品位氧化矿(如红土镍矿),为进一步的富集提取有价金属,可采用石膏造锍熔炼方式。石膏造锍熔炼选择性还原硫化有价金属的反应机理如图13所示,该熔炼方式既可富集回收固废渣/低品位原矿中的有价金属,还可以充分利用石膏渣的全组分,达到石膏渣“变废为宝”资源化利用的目的。

图13 石膏造锍熔炼选择性还原硫化反应机理
5 结论
本文通过热力学分析和还原分解试验系统地研究了石膏固- 固碳热分解反应情况和石膏气- 固热分解反应情况,掌握了石膏作为硫化剂固硫时转化为CaS的转化率及提高转化率的控制参数。
1)当C/S<3时,CaSO4转化为CaS的转化率随着C/S比的增大而增加;当C/S比为3时,CaSO4转化为CaS的转化率达到最大值,为81.33%,且热分解反应产物中CaS含量最高,为71.19%。
2)当CO(CO+CO2)≥50%时,CaSO4转化为CaS的转化率达到91.80%,且随着还原气体浓度的增加而增大。同时,热分解反应产物中CaS含量大于93.51%。
3)将CaS作为硫化剂进行铜渣造锍熔炼,硫化剂的利用率大于75%;通过控制硫化剂的添加量可以控制有价金属铜、铁的硫化反应程度,达到铜回收率大于98%,铁回收率小于10%,实现选择性还原的目的。
上文试验及分析表明采用石膏造锍熔炼选择性还原硫化有价金属,可以充分利用石膏渣的全组分,达到石膏渣“变废为宝”资源化利用的目的。本文试验结论及石膏造锍熔炼选择性还原硫化有价金属的反应机理可为石膏造锍熔炼技术在有色冶炼领域的应用提供理论依据。

