再认识快速眼球运动睡眠及相关谱系疾病
程岳阳综述,詹淑琴审校
已知人类睡眠主要分为非快速眼球运动睡眠(non rapid-eye-movement,NREM)和快速眼球运动睡眠(rapid-eye-movement,REM)两种模式,REM睡眠的发现是改变科学届与医学界对沉睡大脑的认识的重要里程碑,经过70多年的探索,人类对REM睡眠的生理特点和功能的认识在不断加深,但与REM睡眠相关的现象和相关疾病的认识还仍然不足。近年来又有新的关于REM睡眠的研究及认识取得了巨大的进展,本文将就REM睡眠及相关疾病的研究成果进行总结和梳理,根据其发病机制和临床特征的相似性提出快眼动睡眠期谱系障碍疾病的概念,以加深读者对REM睡眠及相关疾病的认识。
1 REM睡眠的起源
1953年Kleitman和Aserinsky首次在人类婴儿身上发现了以快速眼球运动为特征的活跃睡眠期,这种活跃睡眠期与静止睡眠期交替出现[1]。1959年Kleitman和Dement 发现,成年人中这些快速的眼球运动与特定的脑电波模式相关,受试者在此时被唤醒时正在做梦[2]。同年,Jouvet对猫的睡眠进行了研究,结果发现猫和人类一样也经历着快速眼球运动睡眠期,伴有肌肉张力的丧失、肌肉颤搐和类似觉醒的皮质电活动[3]。由此提出REM睡眠的定义总结REM睡眠有以下3个特征:(1)海马θ节律(hippocampal theta rhythm),该节律是持续时间为0.125~0.25 s的一种脑电波,是啮齿类动物REM睡眠的标志[4];(2)脑桥-膝状体-枕叶皮质波(pontogeniculo-occipital waves,PGO波),该皮质波是脑干、脑桥、背外侧膝状体及枕叶皮质产生的场电位,并标志REM睡眠的启动[5];(3)肌张力消失,该现象是一种脊髓前角运动神经元兴奋性下行传导通路被抑制的表现,主要原因在于下行的抑制性神经递质γ-氨基丁酸(γ-aminobutyric acid,GABA)和甘氨酸(glycine,Gly)水平的升高导致肌肉张力消失[6]。
2 REM睡眠的跨物种现象
几十年来,研究人员分别对鸟类、爬行动物和各种哺乳动物的睡眠行为及电生理特征进行了观察和分析。研究发现,REM睡眠在不同物种之间差异很大。不同物种每天的REM睡眠总量、REM睡眠次数和每次持续的时间均不同,大型动物如马和大象每天在REM睡眠中花费的时间很少,小于1 h,而小型动物雪貂和鸭嘴兽每天在REM睡眠花费时间可达3~8 h,小鼠每15 min一次REM睡眠,人类REM睡眠90~120 min发生一次[7,8]。同一物种,每天的REM睡眠量也不恒定,REM睡眠量根据动物的发育年龄、环境和生态压力相应增减,发育尚不成熟的哺乳动物大部分时间都处在REM睡眠中,在发育过程中REM睡眠量下降,成熟后趋于稳定[9]。有些物种没有REM睡眠的经典行为特征和脑电图特征,但脑干细胞活动仍表现出 “REM样”模式[10]。
3 REM睡眠的微结构及生理特点
Moruzzi于1963年首次提出区分REM睡眠微观状态的必要性[11],认为REM睡眠生理上大体可分为紧张性和时相性两大类。紧张性生理现象指在一定过程中持续存在的现象,而时相性生理现象则指间断或周期性出现的现象。研究表明,时相性REM(tonic REM,tREM)睡眠和紧张性REM(phasic REM,pREM)睡眠生理特征具有矛盾性。一方面,时相性REM睡眠期间皮质、精神和自主神经活动处于高度激活状态[12],而tREM睡眠更多时间处于相对静止态。但实际上,pREM睡眠期间生物对环境警觉的反应能力低于tREM睡眠。给予200~400 ms的声刺激并对事件相关电位进行量化分析,发现tREM睡眠可诱发电位峰 (potential peak),而pREM睡眠则无显著变化[13]。Wehrle和他的同事应用fMRI分别对觉醒状态、pREM睡眠和tREM睡眠大脑对声音刺激的反应进行分析,发现tREM睡眠时血氧水平依赖(blood oxygenation level dependent,BOLD)略低于觉醒状态,但高于pREM睡眠[14]。由此可见,就大脑皮质对环境警觉的反应能力及外部信息处理能力而言,tREM睡眠是pREM睡眠和觉醒状态的中间状态。
4 REM睡眠的功能
REM睡眠主要的两大功能是巩固记忆和情绪调节,近年研究发现REM睡眠还有促进大脑皮质的可塑性和调节去甲肾上腺素能受体敏感性的功能[15]。
巩固记忆:研究显示当选择性剥夺REM睡眠会引起程序性视觉辨别能力、情绪性词语记忆能力和情感故事记忆能力下降[16]。Boyce团队在小鼠模型中使用最先进的光遗传学技术,在不干扰睡眠行为的情况下,通过沉默内中隔γ-氨基丁酸(GABAergic neurons of the medial septum ((MSGABA)神经元,选择性靶向衰减与记忆相关的REM期θ节律,发现小鼠对新物体位置识别的空间记忆以及在恐惧条件下的记忆能力受损,首次直接证明REM睡眠对空间记忆及情感记忆的形成和巩固至关重要[17]。
情绪调节:REM睡眠第二个重要作用是情绪调节。研究发现,REM睡眠能够减少负面情绪反应,增强人们对积极情绪的认知[18]。REM睡眠期间,去甲肾上腺素能和5-羟色胺能神经递质活性降低,大脑边缘叶对恐惧相关的负面情绪减少,与奖励相关的积极情绪增加[19]。
5 REM睡眠的神经调控环路
调节REM睡眠神经环路的神经元及相应的神经递质广泛分布在脑干和下丘脑。
5.1 脑干REM睡眠神经调节环路 脑干是REM睡眠触发和维持的重要部位。其中,按照REM睡眠启动时的发放频率将调控REM睡眠的神经元分为REM-on神经元和REM-off神经元,REM-on神经元位于脑桥与中脑连接部位的背外侧被盖核、脑桥桥脚被盖核的胆碱能神经元和背外侧下核的谷氨酸能神经元,作用是启动REM睡眠,该组核团发出纤维向上可引起脑电的去同步化快波,诱发PGO波和快速眼球运动,向下通过抑制延髓GABA能的中间神经元兴奋,抑制脊髓前角运动神经元,使REM睡眠期骨骼肌肌张力消失。REM-off神经元主要组成是5-羟色胺能、去甲肾上腺素能神经元,胞体位于脑干的背侧中缝和蓝斑核,发出的神经纤维向大脑皮质广泛投射。
5.1.1 背外侧下核 背外侧下核(sublaterodorsal nucleus,SLD)位于导水管和蓝斑核的腹侧,由谷氨酸能、γ-氨基丁酸能(γ-aminobutyric acid,GABA)和胆碱能神经元组成。SLD接受从中脑导水管周围腹外侧灰质、中脑深部网状核、初级运动皮质、纹状体的床核 (the bed nucleus of the stria terminalis,BNST)和杏仁核中央核谷氨酸能兴奋性输入;也接受来自中脑、桥脑网状细胞核的GABA能抑制性输入。SLD谷氨酸能神经元是REM-on神经元,投射到腹侧延髓中的甘氨酸/GABA能神经元,进而抑制了脊髓运动神经元,导致肌张力弛缓[20]。
5.1.2 中脑导水管周围腹外侧灰质和中脑深部网状核 中脑导水管周围腹外侧灰质(ventrolateral periaqueductal gray matter,vlPAG)和中脑深部网状核(deep mesencephalic nuclei,DpMe)位于中脑腹外侧,由谷氨酸能、GABA能和多巴胺能(dopaminergic,DA)神经元组成,接收来自前脑、下丘脑和脑干的输入[21]。大多数GABA能神经元是REM-off神经元。Jouvet和他的同事认为vlPAG的GABA能神经元抑制REM睡眠[22],使用光遗传技术激活vlPAG和DpMe GABA能神经元,可抑制REM睡眠的产生并促进NREM睡眠的维持[23]。vlPAG内的DA能神经元具有促觉醒作用[24],但vlPAG谷氨酸能神经元的功能作用仍不清楚。
5.1.3 腹侧延髓 腹侧延髓(ventral medulla,vM)位于脑干腹尾,包括中缝大核(raphe magnus,RMg)、腹侧巨细胞核(ventral and alpha gigantocellular nuclei,GiA and GiV)、外侧旁巨细胞核 (the lateral paragigantocellular nucleus,LPGi)。vM主要包含GABA /甘氨酸能神经元,接受SLD谷氨酸能输入,下行支配脊髓运动神经元[25]。最新研究表明vM (LPGi)GABA能神经元的激活可维持REM睡眠,但对肌张力没有影响[26];而vM(GiV,GiA和RMg)GABA能神经元的失活则不会影响REM睡眠结构,但会导致肌张力失弛缓[27]。
5.1.4 脑桥被盖核和背侧被盖核 脚桥被盖核(the pedunculopontine tegmental nucleus,PPT)和背侧被盖核 (laterodorsal tegmental nucleus,LDT)包含胆碱能、谷氨酸能和GABA能神经元群体[28],接收来自中缝背核和蓝斑神经元的输入,向丘脑、基底神经节、基底前脑、下丘脑脑桥网状结构、中脑腹侧被盖区(ventral tegmental area,VTA)输出[29]。PPT胆碱能神经元优先支配与运动相关的区域如基底神经节;而LDT胆碱能神经元优先支配与边缘相关的神经区域如 VTA。最新研究发现,PPT谷氨酸能神经元激活增加了觉醒的持续时间;而GABA能激活则减少了REM睡眠的持续时间[30];胆碱能神经元的激活对REM睡眠无影响,但可促进NREM睡眠;而LDT神经元的激活则增加REM睡眠发作的次数[31]。
5.1.5 蓝斑 蓝斑核(locus coeruleus,LC)位于脑桥背侧区域、LDT侧面、SLD的尾侧背部。LC神经元通过多巴胺-β-羟化酶(dopamine-beta-hydroxylase,Dbh),使多巴胺转化成去甲肾上腺素(norepinephrine,NE)。LC神经元是促觉醒核,其发出纤维通过觉醒系统接上行向整个大脑皮质广泛投射,促进觉醒。LC也是REM-off神经元,在REM睡眠中起拮抗作用[32],通过NE抑制PPT / LDT胆碱能神经元[33],以抑制REM睡眠。然而,使用光遗传方式抑制LC神经元并不会改变REM睡眠[34],科学家推测这可能和LC神经元中NE神经递质的数量有关。
5.1.6 中缝背核 中缝背核(dorsal raphe nucleus,DRN)位于脑干的中线、脑导水管的腹侧。DRN神经元由5-HT能,谷氨酸能和GABA能神经元组成,表达多种神经肽,例如甘丙肽和P物质[35],DRN接受vPAG、DPGi和LPGi的GABA能抑制性输入,发出纤维支配广泛区域[36]。大多数DRN 5-HT既是促觉醒核,也是REM-off神经元,具有促进觉醒和抑制REM睡眠的作用,与其中5-HT受体亚型的表达有关[37]。
5.2 下丘脑REM 睡眠调节环路
5.2.1 下丘脑分泌素 下丘脑分泌素(hypocretin)又称为食欲素(orexin)是一种神经肽,由食欲素A和食欲素B组成,通过与两种G蛋白偶联受体—食欲素A型受体(OX1R)和食欲素B型受体(OX2R)结合,发挥相应生理功能。食欲素神经元位于下丘脑外侧(lateral hypothalamus,LH),从促觉醒核团接收输入,激活包括LC-NE,VTA-DA,DRN-5-HT神经元和组胺能细胞的单胺能系统[38]。食欲素A可以促发LDT胆碱能神经元兴奋,增加觉醒时间,还可以通过激活网状黑质中的PPT GABA能神经元间接抑制PPT胆碱能神经元,抑制REM睡眠[39]。
5.2.2 黑色素浓缩激素 黑色素浓缩激素(melanin-concentrating hormone,MCH)由称为prepro-MCH的前原蛋白产生,编码神经肽-谷氨酸-异亮氨酸(neuropeptide-glutamic acid-isoleucine,NEI)和神经肽-甘氨酸-谷氨酸neuropeptide glycine-glutamic acid,NGE),与G蛋白偶联受体MCHR1(或GPR24)和MCHR2结合[40]。MCH通过抑制REM-off核团间接兴奋SLD,促进REM睡眠的发生,在MCHR1基因敲除小鼠中观察到REM睡眠发作增加,认为补偿机制正在发挥作用[41],MCH神经元的慢性缺失则可导致昼夜节律紊乱[42]。
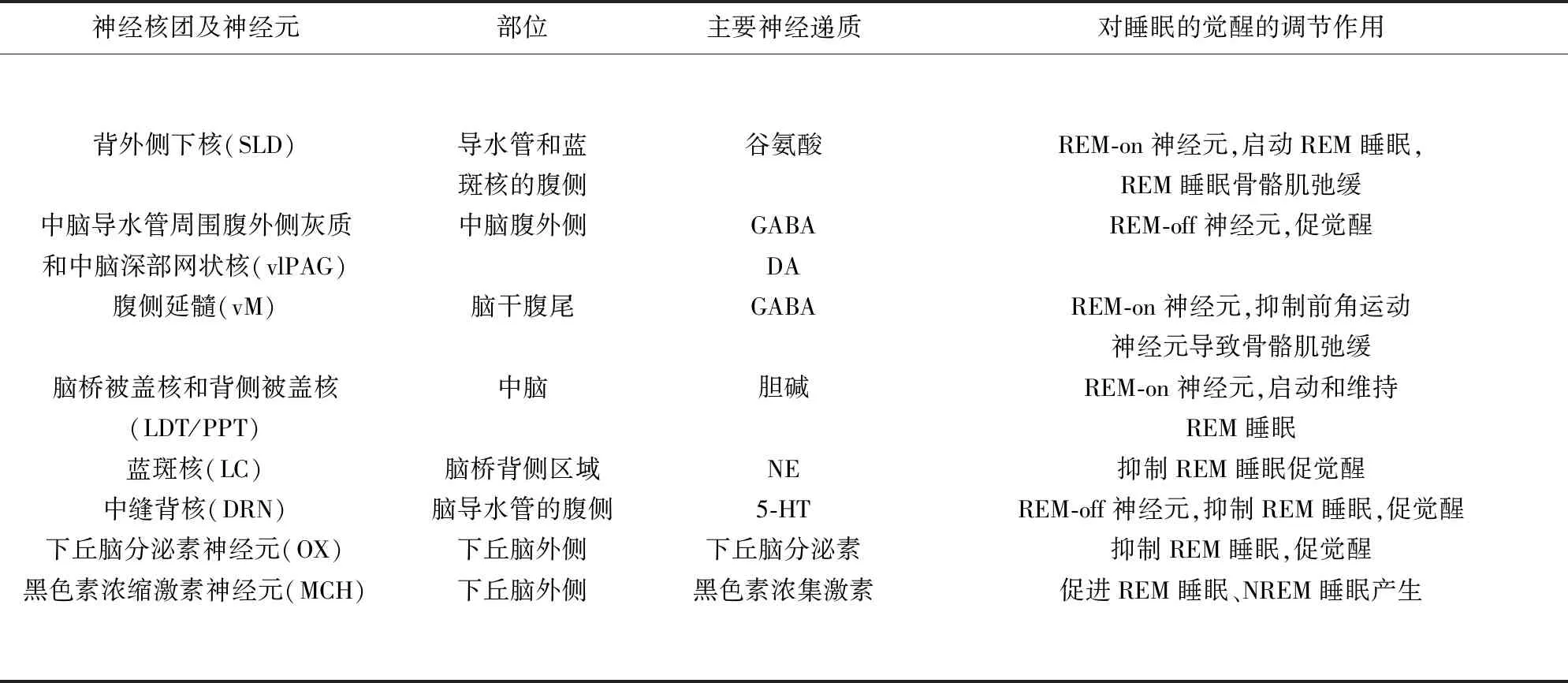
表1 调节REM睡眠的核团和神经元
5.3 REM睡眠神经环路的调控模式
5.3.1 交互作用模式 1975年McCarley和Hobson最早提出了一个相互作用模式(reciprocal interaction model,RI)来解释REM开启(REM-on)和REM关闭(REM-off)之间的状态转换[43]。在这个模式中,LDT和PPT中的胆碱能神经元被认为是REM-on神经元[44],而去甲肾上腺素能和5-羟色胺能神经元是REM-off神经元[45]。LDT/PPT胆碱能神经元作为REM-on神经元与PRF中的谷氨酸能神经元表现出兴奋性相互作用,兴奋GABA 能中间神经元,向DRN 5-HT能和LC NE能REM-off神经元发送抑制性冲动,当REM-off 神经元的放电减少时,REM-on神经元解除抑制,下游效应器受到刺激,产生REM 睡眠,REM-on神经元活动可通过正反馈增强以稳定REM睡眠状态。而随着REM 睡眠向觉醒状态及NREM睡眠状态的交替,发挥负反馈作用的REM-off神经元被激活,以维持NREM睡眠及觉醒。该模式假定REM睡眠相关神经元活动与睡眠状态的交替保持同步[46]。
5.3.2 触发转换模式 2006年Lu和Fuller提出了触发转换模式(flip-flop switch model),认为脑桥顶部被盖功能相反的神经核团相互抑制,形成一个双稳态反馈环路[24]。在这个模式中,位于中脑水管周围灰质腹外侧区vlPAG和LPT的REM-off神经元与位于SLD的REM-on GABA神经元相互抑制[47]。LDT/PPT向REM-off神经元发放抑制性冲动,vlPAG和LPT中的GABA 能神经元抑制SLD中的 REM-on 神经元,负向调节 REM 睡眠[26]。LPT的GABA 能神经元投射到下丘脑外侧区 (lateral hypothalamus,LH)和DRN,后者可调节REM 睡眠和肌肉张力[6],REM 睡眠期间,食欲素能神经元受到抑制,该过程中食欲素的缺失可能是发作性睡病的原因[48]。
5.3.3 整合模式 Tamakawa提出了一个协调睡眠和觉醒的整合模型[49],涉及基底前脑、下丘脑和脑干的多个神经核团,分为四个功能部分:睡眠激活、觉醒激活、REM激活和觉醒-REM激活,尝试对睡眠觉醒的动态过程中的生理性放电和突触连接进行定量分析。REM睡眠的神经调控是一个极其复杂的过程,其中涉及的核团突触之间的连接和定量关系仍有待进一步深入研究[50]。
6 与REM睡眠相关疾病与症状
目前确定与REM睡眠期相关的典型疾病包括快眼动睡眠期行为障碍、发作性睡病、复发性孤立睡瘫和梦魇障碍,尽管这类发生机制都与REM睡眠的调控环路受损有关,但临床表现异质性很大。因此我们首次将这些与REM睡眠调控环路紊乱相关的疾病归类在一起,提出快眼动睡眠期谱系障碍疾病的慨念,希望从中寻找这类疾病的共同特征进行识别和有效干预靶点。
6.1 快眼动睡眠期行为障碍 快眼动睡眠期行为障碍(REM sleep behavior disorder,RBD)是一种以REM睡眠期肌张力失弛缓(REM sleep without atonia,RSWA)及梦境演绎行为(dream enactment behavior,DEB)为特征的异态睡眠[51]。DEB是指患者出现生动、充满暴力行为的梦境及与梦境一致的行为,如拳打脚踢、大声尖叫等,可伤及自己或同床者。RBD是典型的REM睡眠期谱系疾病,有研究证实其病理机制与SLD及与之联络的相关核团受损有关。SLD神经元通过激活延髓腹侧vM的甘氨酸能/GABA能神经元抑制脊髓前角运动神经元,导致REM睡眠期的骨骼肌张力消失;当SLD受损不能激活位于vM的甘氨酸能/GABA能神经元,导致骨骼肌张力失弛缓,导致 RBD[52]。根据国际睡眠障碍分类第三版(International Classification of Sleep Disorders,ICSD-3),RBD的诊断包括反复发作的DEB及REM睡眠期出现RSWA[53]。RBD可以分为原发性和症状性RBD。原发性RBD(idiopathic RBD,iRBD)则是指不伴其他神经疾病、孤立存在的RBD;症状性RBD是指与α-突触核蛋白病,尤其是帕金森病(Parkinson’s disease,PD)、路易体痴呆(dementia with Lewy bodies,DLB)、多系统萎缩(multiple system atrophy,MSA)、其他神经疾病(如脑干肿瘤、血管病、脱鞘病或发作性睡病1型),或者由抗抑郁药诱发的RBD。RBD对α-突触核蛋白病有重要的临床预警意义。最新的横断面研究显示16%~47%的PD患者、80%的DLB患者以及多达100%的MSA患者合并有RBD[53]。而对51项纵向研究进行的荟萃分析发现:iRBD患者在约14 y后发生神经退行性疾病的风险可达96.6%,几乎半数(43%)的iRBD 患者发展为 PD,25%的转化为DLB,其余的转变为其他痴呆症或MSA[54]。伴有RBD的PD患者往往运动症状更重、出现症状波动等运动并发症的发生率更高、长期生活质量更差[55]。
6.2 发作性睡病 发作性睡病(narcolepsy,NT)是一种觉醒睡眠维持能力受损导致的以白天嗜睡、猝倒发作、睡眠瘫痪、入睡幻觉和夜间睡眠障碍为主要临床特征的慢性神经系统疾病,也是另一种与REM睡眠相关的睡眠障碍,发病可能与免疫、遗传、环境、感染、中枢神经系统退行性病变等其他因素有关。NT由法国医生 Gelineau于1880 年首次报道,人群患病率估计在0.02%~0.18%,通常在10~20岁开始起病,男性和女性患病率大致相当。ICSD-3将发作性睡病分为1型发作性睡病(NT1)和2型发作性睡病(NT2)。NT1是由于下丘脑神经元的大量丢失引起的该下丘脑神经元产生食欲素明显减少,临床症状特征表现白天嗜睡伴有猝倒。猝倒发作、睡眠瘫痪、入睡前和觉醒后的幻觉和RBD被认为是与REM睡眠相关的临床症状。猝倒发作通常由强烈的情感刺激触发,发怒、大笑、高兴可诱发短暂的随意肌肌张力部分或全部丧失。正常情况下,食欲素神经元通过激活促觉醒相关核团维持觉醒,食欲素神经元也通过激活REM-off神经元(vlPAG-LPT),抑制SLD从而抑制REM睡眠。在发作性睡病中,食欲素缺乏导致兴奋性驱动缺失。积极的情绪激活了杏仁核中的GABA神经元,抑制了LC、LPT和vlPAG中的REM-off神经元,导致SLD兴奋并激活vM GABA能神经元,使脊髓前角运动神经元被抑制,在觉醒状态下出现肌张力消失,即猝倒发生[56]。对发作性睡病患者脑部尸检结果发现 85%~95%的食欲素神经元缺失[57]。而结构影像学发现了伴有猝倒的NT1患者双侧下丘脑、伏隔核、丘脑以及额颞叶皮质区灰质体积减小[58],进一步证实食欲素能神经元缺失是NT1发病的关键标记物,由于食欲素的“多功能”特性,故食欲素缺乏的NT1患者除了表现出睡眠觉醒障碍外,还表现出广泛的、多系统的功能异常,NT1患者往往会出现更显著的情绪障碍、认知障碍、肥胖和代谢紊乱等[59]。
6.3 发作性睡病和快眼动睡眠期行为障碍的联系 RBD和发作性睡病均是由REM睡眠的调控障碍引起的,RBD是REM睡眠期间骨骼肌失张力的结果,而发作性睡病的猝倒则是由于觉醒期插入了REM睡眠,这两个疾病存在关联。实际上,发作性睡病是继发性RBD的第二大最常见原因,大约有50%的发作性睡病存在RBD(RBD linked to narcolepsy,N-RBD)[60],研究表明,治疗猝倒发作的抗抑郁药,尤其三环类或选择性5-羟色胺再摄取抑制剂的应用与撤药均可诱发 RBD[61]。有研究表明,在 SLD 区域注射微量食欲素可诱导 REM 睡眠和肌张力失弛缓;而抑制 SLD食欲素信号转导后,SLD-GiV-atonia 通路受损,可观察到脑电图θ振荡不足和肌无力,均提示食欲素功能障碍可能是 RBD 发生的直接因素[62]。与iRBD及其他神经退行性变引起的RBD不同的是,N-RBD 患者夜间发作的形式主要以发声或颜面部及肢体动作为主,而较少出现暴力激烈的防御或攻击行为,伴猝倒的发作性睡病更易合并RBD[63]。儿童发作性睡病的症状不如成人典型,有时RBD是NT患儿的首发症状。多导睡眠监测中的RWA指数(REM sleep without atonia index,RWAI)被认为是诊断发作性睡病的有效生物标志物。羟丁酸钠(sodium oxybate)是一种静脉用麻醉药,被用于治疗发作性睡病的EDS和猝倒和夜间睡眠紊乱,据报道小剂量羟丁酸钠可以缓解iRBD患者夜间运动发作[64]。最新研究发现6-8g的羟丁酸钠可使NT儿童的RBD发作减少,RWAI显着降低,表明羟丁酸钠还可以改善REM睡眠期间的肌张力障碍[65]。
7 展 望
本综述首次提出快眼动睡眠期谱系障碍疾病的概念,以REM睡眠为基点来认识其相关睡眠疾病,寻找此类疾病的共同规律。这些疾病临床异质性大,临床症状与电生理表现高度提示REM睡眠不稳定,病理机制可能与REM睡眠神经调控环路异常有关,该环路涉及复杂的核团及神经递质相互作用,更详细机制仍有待进一步研究。睡眠领域的科学家们正通过构建动物模型,研究神经元的解剖学结构及量化突触连接,了解REM睡眠的稳定性特征及动态变化,进一步明确其功能,为疾病可能的治疗方法寻找更多理论基础。

