依地酸钙钠与小剂量二巯丙磺酸钠在脑型Wilson病中的驱铜疗效对比研究
李 俊,陈怀珍,胡亚飞,朱四欢,韩 超,许二赫,杨文明
Wilson病(Wilson’s disease,WD),又称肝豆状核变性,是由ATP7B基因突变引起,目前已经报道超过800个相关的突变[1],该基因编码一种跨膜铜转运ATP酶,引起血清铜蓝蛋白(Ceruloplasmin,CP)合成减少以及胆道排铜障碍,导致肝脏、脑和其他器官铜超载,以病理性铜蓄积为特征,是一种潜在的可治性的神经遗传病之一[2]。不同WD的临床病程严重程度不同,临床表现为进行性加重的肝硬化、神经症状、精神症状、骨关节变形及角膜K-F环等;然而,如果不治疗,WD通常是致残和致命的[3]。可用的治疗方法包括螯合剂和锌剂,它们通过不同的机制逆转铜超载。其中,2,3-二巯基-1-丙烷磺酸钠(Sodium 2,3-dimercapto-1-propane sulfonate,DMPS)[4,5]和依地酸钙钠(Calcium sodium edetate,EDTA)[6]是目前应用于WD的两种静脉铜螯合剂,可与各种重金属形成络合物,促进铜的排出。EDTA适应症主要应用于铅中毒,但对镉、锰、铬、镍、钴、铜等中毒也有一定疗效,而排铜在国内外研究较少[7],临床应用较少。既往国内研究认为EDTA静滴治疗WD 有一定的临床疗效,排铜作用仅次于青霉胺,不良反应少[8]。2021年中国肝豆状核变性诊治指南中指出服用青霉胺患者10%~50%发生神经功能加重,静脉应用DMPS患者10.5%发生神经功能加重,故推荐脑型WD患者采用小剂量DMPS逐渐加量的方案[3]。而对于EDTA与DMPS这二种静脉铜螯合剂在脑型WD中的驱铜作用,从未有过比较,故本研究旨在调查EDTA与小剂量DMPS治疗在脑型WD病中驱铜作用的比较。
1 资料与方法
1.1 研究对象 回顾性选取2019年2月-2021年9月安徽中医药大学第一附属医院脑病科(肝豆状核变性重点专病建设单位)接受EDTA(n=39例)或小剂量DMPS(n=41例)治疗的住院WD患者共80例,纳入标准:(1)均符合WD诊断《肝豆状核变性的诊断与治疗指南2021》[3],莱锡比评分≥4分[8];:①神经和(或)精神症状。②原因不明的肝脏损害。③血清铜蓝蛋白降低和(或)24 h尿铜升高。④角膜K-F环阳性。⑤经家系共分离及基因变异致病性分析确定患者的2条染色体均携带ATP7B基因致病变异。符合(①或②)+(③和④)或(①或②)+⑤患者。(2)脑型或肝-脑型,表现为神经系统症状的WD患者;(3)研究期间坚持低铜高蛋白饮食。排除标准:(1)中重度抑郁症、近期有过自杀想法或者行为、有严重的精神症状;(2)重症的肝型WD患者:失代偿性肝硬化或合并肝癌、食管静脉曲张、消化道出血、中重度贫血或肝性脑病;(3)合并严重疾病如经检查证实的脑肿瘤、脑外伤、血液病、心源性疾病、HIV等;(4)认知功能障碍MMSE≤24分;(5)孕妇及哺乳期妇女;(6)无神经系统症状者。本研究本研究符合《世界医学协会赫尔辛基宣言》相关要求,经过本院伦理委员会(伦理号:2021AH-60)批准。
1.2 研究方法
1.2.1 治疗方法 所有入组患者均严格执行低铜高蛋白饮食,EDTA组予以EDTA注射液(天津金耀药业有限公司,生产批号:2003211,国药准字:H12020890)1.0 g+5%葡萄糖注射液250~500 ml,静脉滴注,每日给药1次,连用6 d后停药2 d予以补钙补锌治疗;DMPS组予以DMPS注射液(上海禾丰制药有限公司,生产批号:31210403,国药准字:H31021514)5 mg/(kg·d)+5%葡萄糖注射液100~250 ml,静脉滴注,每日给药1次,连用6 d后停药2 d予以补钙补锌治疗。
1.2.2 WD患者神经功能评价方法 所有患者于治疗前3 d内及治疗后1 w采用统一肝豆状核变性量表第一部分(UWDRS Ⅰ)评价神经功能状态。
1.2.3 血清铜蓝蛋白(CER)的检测 所有患者于治疗前清晨空腹时抽取静脉血,血标本装于真空抗凝管外送至安徽中医药大学第一附属医院实验室检测。
1.2.4 24 h尿铜水平测定 所有患者于驱铜治疗过程中留取24 h尿,采用火焰原子吸收分光光度法测定24 h尿铜水平。
12.5 驱铜恶化评估及不良反应评估 所有患者于驱铜治疗过程中及治疗后1周内记录是否存在神经症状加重,即驱铜恶化表现及不良反应。
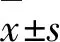
2 结 果
2.1 PSM匹配后WD患者的一般资料 为使两组的混杂因素趋于均衡可比,应用PSM得到匹配结果为:EDTA治疗组35例患者,其中男性19例,女性16例;小剂量DMPS治疗组35例患者,其中男性21例,女性14例;匹配后两组患者在性别、年龄、病程、CER、及其治疗前UWDRS Ⅰ神经症状评分差异无统计学意义(均P>0.05),具有可比性(见表1)。

表1 PSM匹配后WD人口学和临床基线资料
2.2 EDTA与小剂量DMPS驱铜比较 统计结果表明,治疗后EDTA组UWDRS Ⅰ评分较治疗前差异有统计学意义(P<0.001),小剂量DMPS组UWDRS Ⅰ评分均较治疗前差异无统计学意义(P>0.05)(见表2)。

表2 EDTA组与DMPS组驱铜分别前后UWDRS Ⅰ评分比较
2.3 EDTA与小剂量DMPS驱铜恶化比较 经治疗后,两组24 h尿铜无明显差异,EDTA组与小剂量DMPS相比,未见驱铜恶化,驱铜恶化呈显著统计学差异(P=0.025)(见表3),部分病例神经症状出现了加重,具体表现为肌张力障碍加重、吞咽困难等球麻痹加重等,驱铜恶化率低于小剂量DMPS组(17.14%)。
2.4 EDTA与小剂量DMPS驱铜不良反应比较 不良反应中EDTA组出现头晕3例,乏力3例,恶心1例,小剂量DMPS组出现乏力5例,关节酸痛4例,瘙痒2例,皮疹、口唇肿胀及发热各1例。相比之下,EDTA组更为安全。

表3 EDTA组与DMPS组驱铜疗效及驱铜恶化现象比较
3 讨 论
本研究旨在调查EDTA与对照组小剂量DMPS在Wilson病中作用的比较,结果显示,EDTA与小剂量DMPS驱铜中尿铜排泄无明显差异,但治疗后神经症状评分比较有显著性差异,驱铜恶化率方面EDTA组明显低于小剂量DMPS组,短期治疗不良反应方面提示EDTA组更安全。
据流行病学统计,WD脑型患者最多可占WD患者中的比例为68%,最小的为6岁,最大的为72岁[3],常见的症状有不自主运动、震颤、肌张力障碍、吞咽困难和构音障碍等[9]。WD患者的脑铜浓度比健康对照组高10~15倍[2]。铜毒性是WD脑变性的主要因素[10],Cu作为维持机体正常生理功能的必要成分,以各种酶的形式参与机体的各种物质的氧化还原反应,调节脂质和糖代谢,维护中枢神经系统稳定,过多的游离Cu会产生自由基并增加氧化应激[11],因而精准驱铜,快而有效恢复机体金属Cu的内稳态是目前迫不及待需要解决的科学问题[12]。然而在各种螯合剂驱铜的过程中神经症状往往不可把控,会出现驱铜恶化[13]。DMPS是最有效的驱铜注射螯合剂,其次是二巯丙磺酸和EDTA[14]。DMPS是一种含巯基的络合物,高效低毒,对铅、汞、砷等重金属中毒具有很好的解毒功效,目前已广泛用于中国肝豆状核变性患者静脉驱铜治疗50多年,常用剂量为5~10 mg/(kg·d)[15],效果明显[16],可作为青霉胺过敏或不耐受的WD患者首选用药,因为是静脉制剂,建议DMPS与锌剂的序贯使用[4,17]。DMPS为水溶性物质,含有一个磺酸基和两个硫醇基,半衰期为20 h,可将已经与细胞酶结合的金属离子夺出,与铜离子结合形成硫醇化合物,由肾脏尿液排出[4],解除金属离子对细胞酶系统的抑制作用,临床疗效显著,但对于脑型WD患者的起始治疗中仍存在驱铜恶化,故建议小剂量起始[3]。但对于铜的排泄,EDTA与小剂量DMPS二者之间的对比未见有报道。本研究中,我们发现EDTA及小剂量DMPS这两组的在脑型WD患者中尿铜排泄无明显差异。既往有文献报道,EDTA对于重金属的排泄,如铅、汞等的排泄,比DMPS更有效[18]。EDTA,又称乙二胺四乙酸,于1935年合成,它是一种聚氨基多羧酸,无色水溶性化合物,化学式为C10H16N2O8,半衰期为24~48 h,最早为美国食品和药物管理局(FDA)批准用于铅中毒,是作为第一个临床引入的螯合剂[19]。既往研究认为EDTA驱铜有较好的疗效,治疗后驱铜量可达到治疗前的3.6倍[8]。本研究中,EDTA组在脑型WD患者中驱铜后的神经症状改善明显高于小剂量DMPS组,这可能与小剂量DMPS组部分病例在驱铜后发生了驱铜恶化-神经症状加重有关。
我们发现EDTA治疗中的驱铜恶化明显少于对照组小剂量DMPS组。在WD治疗中,Tomasz Litwin等[20]报道,总体WD驱铜恶化率超过11.1%,分析可能的原因是:大剂量快速应用螯合剂可能导致从不同组织(不与铜蓝蛋白或螯合剂结合)动员游离铜,增加了游离铜相关氧化应激导致驱铜恶化,且这驱铜恶化患者中有47%的患者其恶化的神经症状不可逆,20%的患者因为驱铜恶化而死亡,因此,螯合剂在WD中使用的规则是“小剂量慢行”,甚至有专家建议停止在WD治疗中使用螯合剂。驱铜恶化原因考虑与以下因素有关:(1)以神经症状为首发症状;(2)基线治疗前神经症状明显;(3)丘脑和脑干损伤;(4)同时使用了多巴胺受体阻滞剂[20]。故我中心现应用螯合剂包括DMPS等均小剂量起始治疗,并积极探索新型安全驱铜药物,此次EDTA为老药新用。而Fulgenzi A等[21]研究指出,有毒金属可直接损伤神经元和(或)神经胶质细胞和内皮细胞,活化的胶质细胞和内皮细胞产生活性氧(ROS)和促炎细胞因子(IL-1、TNFα),它们能够进一步损伤神经元。而EDTA本身是一种抗氧化剂,经过螯合治疗后,可具有以下作用[21]:(1)保护内皮细胞免受激活;(2)去除有毒金属;(3)抗炎功能(限病原体感染和细胞因子的产生);以及(4)抗氧化活性(降低ROS水平)。由此,我们推断EDTA的抗氧化活性可能对于游离铜相关氧化应激导致驱铜恶化产生相抗衡作用,因而减少了驱铜恶化发生率。
再者,我们发现EDTA组在脑型WD患者中与小剂量DMPS组驱铜过程中安全性更高。DMPS易出现不良反应如过敏药疹等[22],而Fulgenzi A等[21]报道,EDTA螯合疗法能够去除人体所有有毒金属,且无任何副作用。文献记载 EDTA 副反应较轻较少,既往韩咏竹等研究报道,240例WD患者使用EDTA驱铜6个疗程,其中有89例(37.08%)出现轻度的副反应,我们的研究为短期应用EDTA,安全性更高。
总之本研究中,我们对比了两组脑型WD患者,分别应用EDTA及小剂量DMPS短期驱铜,发现两组的尿铜排泄无明显差异,但驱铜后神经症状明显优于对照组小剂量DMPS组,且驱铜恶化率明显少于小剂量DMPS组,不良反应也少于小剂量DMPS组,故我们认为在脑型WD患者中可选用EDTA进行短期治疗,尤其是对于脑型WD患者DMPS治疗产生驱铜恶化者,具有较高的临床意义。同时,本研究存在一定的局限性,本研究为回顾性研究,EDTA治疗及观察周期较短,期待以后有大样本及长时间的前瞻性研究。

