JAK/STAT信号通路在风湿免疫性疾病中作用的研究进展
肖凡妮,青玉凤,张全波*
Janus激酶/信号转导和转录激活子(JAK/STAT)信号通路是近年发现的一条重要的细胞内信号转导通路,参与生长因子和细胞因子跨膜信号转导,对于启动固有免疫、协调适应性免疫至关重要[1]。目前,JAK/STAT信号通路在肿瘤、神经系统、心血管系统等疾病中已被广泛研究,其与风湿免疫性疾病的关系也受到越来越多的关注。风湿免疫性疾病是一类以关节、骨、肌肉异常为主要表现,可累及内脏器官的异质性疾病。目前改善病情抗风湿药(disease-modifying antirheumatic drugs,DMARDs)在临床治疗中应用广泛,但在用药过程中容易出现胃肠道反应、肝损害、肾损害等不良反应,且对于部分中、重度患者疗效欠佳,因此寻找新的治疗药物显得至关重要。JAK/SATA信号通路作为一些风湿免疫性疾病治疗靶点是有效的,而托法替布是一种JAK抑制剂,可通过竞争性抑制JAK的ATP的结合位点阻断下游STAT蛋白活化来抑制JAK/STAT信号通路激活,调节免疫反应,减轻炎症。有研究表明使用DMARDs及肿瘤坏死因子(TNF)抑制剂治疗中重度活动性类风湿关节炎的效果欠佳时,托法替布治疗有效[2]。另一项关于银屑病关节炎治疗的研究也显示,托法替布在降低疾病活动度方面较DMARDs及TNF抑制剂更有效[3]。在使用非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)、白介素(IL)17抑制剂、TNF抑制剂治疗强直性脊柱炎失败或出现药物不耐受时JAK抑制剂是一种有效且安全的选择[4-6]。这些研究均显示出JAK/STAT信号通路作为风湿免疫性疾病治疗靶点的潜力,因此,阐明JAK/STAT信号通路在风湿免疫性疾病中的作用,对以该信号通路为靶点治疗风湿免疫性疾病尤为重要。本文对JAK/STAT信号通路作用机制及其在常见的风湿免疫性疾病中的作用进行综述,旨在为风湿免疫性疾病的临床治疗及预防提供新思路与方向。
1 JAK/STAT信号通路的组成及其信号转导机制
JAK/STAT信号通路的发现源于对干扰素(IFN)α如何调控其基因表达的研究,随后越来越多的研究表明多种细胞因子和生长因子通过JAK/STAT信号通路传递信号,包括IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、生长激素(GH)、表皮生长因子(EGF)、血小板衍生生长因子(PDGF)、IFN等[7]。JAK/STAT信号通路由3个部分组成:信号因子受体、JAK、STAT蛋白。
在哺乳动物中,JAKs家族由4个成员组成:JAK1、JAK2、JAK3 和 TYK2,分子量为 120~140 kDa[2]。每个 JAK蛋白包含7个同源结构域,正是这些特定的结构域使得JAKs家族既能磷酸化细胞因子受体,又能将具有Src同源结构域2(Src homology domain 2,SH2)的信号分子磷酸化,从而将信号转导到胞内。
STAT蛋白是JAKs家族的下游靶标,负责将传递到胞内的信号转导至细胞核,细胞因子启动的大多数免疫应答均依赖于STAT蛋白[8]。STAT蛋白由7个成员组成,即STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和 STAT6, 分 子量为79~113 kDa,与JAK/STAT信息通路相关的多种细胞因子会激活特定的STAT蛋白(图1)。
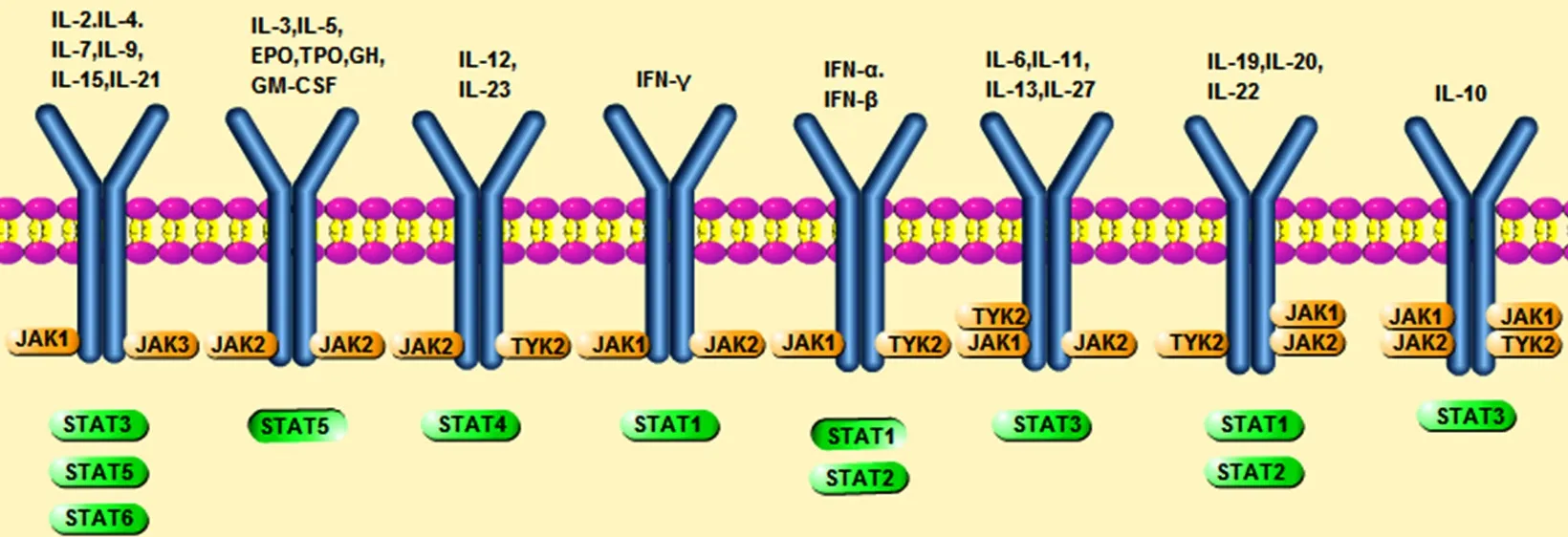
图1 与JAK/STAT信号通路相关的多种细胞因子Figure 1 Multiple cytokines associated with the JAK/STAT signaling pathway
JAK/STAT信号通路基本信号转导过程见图2:首先,细胞因子与其受体结合后引起受体分子构象改变(二聚化),使得JAKs与受体偶联并使受体磷酸化;随后,磷酸化的受体与周围氨基酸形成对接位点,使具有SH2结构域的STAT蛋白结合到对接位点上而被JAKs磷酸化,STAT蛋白被磷酸化后活化形成二聚体;最后,细胞质中二聚化的STAT蛋白被转移到细胞核中,并通过与细胞核内特定的DNA元件结合来调控相关基因的转录和表达。

图2 JAK/STAT信号通路信号转导过程Figure 2 Signal transduction of JAK/STAT signaling pathway
JAK/STAT信号通路在多个水平上受到严格调控,如JAK去磷酸化,抑制蛋白如细胞因子信号抑制物(suppressor of cytokine signaling,SOCS)、活化STAT蛋白抑制剂(PIAS)的产生,JAK 同源结构域(JAK homology domain,JH)之间相互作用通过自身抑制阻止信号通路异常激活。因此,JAK和STAT蛋白功能异常或细胞因子过度表达均会引起该信号通路失控而导致疾病发生[9]。
2 JAK/STAT信号通路在风湿免疫性疾病中的作用
2.1 JAK/STAT信号通路与类风湿关节炎 类风湿关节炎是一种累积全身多关节,以慢性进行性关节炎为主要表现的全身性自身免疫性疾病[10],主要病理变化为滑膜细胞增生、炎性细胞浸润、血管翳形成并侵蚀软骨和骨组织,滑膜的持续炎症导致关节结构的破坏、畸形和功能丧失。T淋巴细胞、B淋巴细胞、肥大细胞、中性粒细胞、巨噬细胞和抗原提呈细胞以及滑膜组织成纤维细胞的活化是类风湿关节炎活动期的主要细胞标志[11]。多种细胞因子包括TNF-α、IL-1、IL-6、IL-7、IL-15、IL-17、IL-18、IL-21、IL-23、IL-32、IL-33和GM-CSF在类风湿关节炎的发病机制中发挥着重要作用[12]。T淋巴细胞的活化、自身免疫反应的启动及致炎性细胞因子、自身抗体、氧自由基大量增多导致了关节组织的炎性损伤、滑膜增生、骨和软骨的结构破坏。全身性多关节疼痛通常是类风湿关节炎患者就诊的主要原因,疼痛多发生在手、腕和足的小关节,有时也发生在肘、肩、颈、膝、踝或髋关节[13]。炎性疼痛与TNF-α、IL-1β、IL-6、IL-10、IL-17和GMCSF等的产生相关[14-15],而这些炎性递质的信号转导则需通过JAK/STAT信号通路,因此JAK/STAT信号通路的持续激活与关节组织炎性损伤、骨质破坏密切相关。
有研究发现,在类风湿关节炎患者中,JAK/STAT信号通路负调控因子(SOCS和PIAS)功能失调使得JAK/STAT信号通路持续激活,从而引起类风湿关节炎患者体内促炎细胞因子水平显著升高,如TNF-α、IL-1β、IL-6、IL-7、IL-8、IL-12/IL-23、IL-15、IL-17、IL-18、IL-32和IFN-γ、生长因子等[10],高水平的炎性递质引起患者全身多关节疼痛,严重影响患者的生活质量和精神状态。有临床试验表明,分别给予类风湿关节炎患者JAK抑制剂、TNF抑制剂与安慰剂1周后,JAK抑制剂治疗组类风湿关节炎患者的疼痛强度显著低于安慰剂组[16],因此可以认为JAK抑制剂可能通过减轻炎性反应及降低伤害感受器的疼痛敏感性而达到缓解疼痛的效果。
趋化因子12(CXCL12)与趋化因子受体4(CXCR4)结合可启动JAK/STAT信号通路,诱导单核细胞迁移。高迁移率族蛋白B1(HMGB1)是一种高度保守的核蛋白,广泛分布于哺乳动物细胞,可与CXCL12结合形成CXCL12/HMGB1复合物。CECCHINATO等[17]通过对比单纯CXCL12诱导与CXCL12/HMGB1复合物诱导处于活动期类风湿关节炎患者的单核细胞的迁移发现,CXCL12/HMGB1复合物可以增强CXCL12对单核细胞的活性,而用JAK2选择性抑制剂处理活动期类风湿关节炎患者的单核细胞后发现,该细胞失去了对CXCL12/HMGB1复合物的增强反应,表明JAK/STAT信号通路对于CXCL12/HMGB1复合物增强诱导活动期类风湿关节炎患者的单核细胞迁移是必要的。由此可以认为,JAK/STAT信号通路参与类风湿关节炎的发病机制可能与CXCL12/HMGB1复合物引起单核细胞迁移而引发炎性反应有关,靶向复合物的形成及其活性可能是抑制细胞募集引起的炎症的新途径。
2.2 JAK/STAT信号通路与系统性红斑狼疮 系统性红斑狼疮是一种多系统、慢性自身免疫性疾病,其特征是存在针对自身抗原的抗体和广泛的免疫失调[18]。细胞因子失调也是系统性红斑狼疮的标志,参与其发病的许多关键细胞因子依赖于JAK活化进行细胞内信号转导。有学者将一种基于转录组学数据和文献检索的贝叶斯基因网络构建方法应用于系统性红斑狼疮,结果显示JAK/STAT信号通路所介导的广泛的免疫调节作用对系统性红斑狼疮至关重要,一些JAK/STAT信号通路相关基因(如JAK2、STAT1和STAT2)也可能是系统性红斑狼疮发病的核心[19]。一项使用JAK1/JAK2抑制剂治疗系统性红斑狼疮的双盲、随机、安慰剂对照的Ⅱ期临床试验发现,该抑制剂能显著改善标准治疗难以控制的活动性系统性红斑狼疮患者的体征和症状[18]。
JAK/STAT信号通路的异常表达也可能与系统性红斑狼疮的发病有关。有研究发现,PIAS在系统性红斑狼疮患者中表达降低[20]。在狼疮性肾炎患者的肾活检标本中发现,在肾小球和肾小管中STAT1表达增加,体现了JAK/STAT信号通路与狼疮性肾炎的发病相关。有研究结果显示,酪氨酸激酶抑制剂AG-490能减少小鼠狼疮肾炎模型中肾小球肾炎、间质性肾炎、血管炎、唾液腺炎的发生,并且能降低肾细胞表面趋化因子、IFN-γ、血尿素氮、血肌酐和蛋白尿水平,减少肾小球细胞中IgG和补体C3的沉积[21],提示AG-490作为JAK2/STAT1信号通路的抑制剂通过影响STAT1在肾小球和肾小管的表达而减少肾细胞表面的趋化因子、IFN-γ等达到抑制肾脏炎性反应的效果,有利于改善肾功能。
2.3 JAK/STAT信号通路与痛风 痛风是由单钠尿酸盐(MSU)晶体诱发的炎症性疾病。长期高尿酸血症可引起关节及周围软组织尿酸盐晶体沉积,进而出现反复发作的急性关节和软组织炎症、痛风石沉积、慢性关节炎和关节损害。痛风性关节炎是机体对沉积的MSU晶体产生炎性反应的结果。核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体激活及有生物活性的IL-1β释放对于痛风的急性发作至关重要[22]。有研究发现,Ⅰ型IFN受体通过JAK/STAT信号通路调节天冬氨酸蛋白水解酶Caspase-11的表达,Caspase-1活化依赖Caspase-11的表达[23]。Caspase-1是一种独特的半胱氨酸蛋白酶,可作用于IL-1β前体进而诱导IL-1β的产生,在固有免疫中发挥着重要作用,因而Caspase-1的活化与痛风发病密不可分[24],也可以理解为Ⅰ型IFN与其细胞表面受体结合来激活特定的JAK-STAT信号通路并调节Caspase-1的活化,诱导IL-1β的产生,从而引起急性痛风性关节炎的发生。TEMMOKU等[25]为评估IL-6在MSU晶体引起的炎性反应中的作用,分别用MSU晶体刺激有IL-6表达和无IL-6表达的人中性粒细胞,再测定NLRP3炎症小体激活后裂解的Caspase-1或Caspase-1诱导产生的IL-1β,结果发现在缺乏IL-6的情况下,MSU晶体并不能诱导人中性粒细胞产生有效的IL-1,而经IL-6致敏的中性粒细胞却明显产生IL-1,且用JAK/STAT抑制剂阻断IL-6受体信号转导可以阻止IL-6致敏中性粒细胞中Caspase-1裂解或IL-1的产生。以上研究结果表明,细胞因子IL-6通过JAK/STAT信号通路参与MSU晶体诱导的NLRP3炎症小体激活和随后固有免疫细胞产生IL-1,其在MSU晶体诱导的滑膜炎症中具有至关重要的作用。
2.4 JAK/STAT信号通路与其他风湿免疫性疾病 越来越多的研究发现,某些促炎性细胞因子可能在正常骨重建和骨质疏松症的发病中发挥着关键作用。最初IL-6被认为是一种促进破骨细胞生成从而促进骨吸收因子,后来的研究发现在骨转换增加的情况下,IL-6可以影响骨形成[26]。IL-1是一种骨吸收的强效刺激物,可促进破骨细胞生成并且与绝经后骨的加速丢失相关[27],而IL-6、IL-1的产生与JAK/STAT信号通路的活化相关。成纤维细胞生长因子23(FGF23)是由成骨细胞和骨细胞产生的一种促进磷酸盐排泄的细胞因子。一项探究FGF23在骨质疏松症进展中调控机制的研究发现,FGF23基因敲除大鼠可发生骨质疏松,并且可能与JAK2/STAT3信号通路相关,活化的JAK2 和STAT3通过调节成骨细胞中合成代谢的信号而在骨骼生长中发挥关键作用[28]。多囊蛋白-1(PC1)被认为是参与骨重建的主要的机械感应分子,主要通过JAK2/STAT3信号通路在感知机械刺激时介导人成骨细胞中的Runx2基因转录并诱导成骨细胞分化,经过机械拉伸的原代成骨细胞中多囊蛋白表达增多,细胞质内JAK2磷酸化增加,同时机械刺激也触发了PC1介导的STAT3磷酸化和核转位[29]。总之,JAK2/STAT3信号通路是相关因子影响骨代谢的途径。
强直性脊柱炎是一种慢性、进行性炎症性疾病,以骶髂关节炎和脊柱炎症为特征,伴有骨侵蚀、新骨形成和脊柱强直,并可出现眼、心脏、肺和肠道等关节外症状。有研究表明,辅助性T 细胞17(T helper cell 17,Th17)相关基因的过度表达与强直性脊柱炎相关,并确定了IL-23的主要作用,在IL-23存在的情况下,Th17细胞扩增,从而导致IL-17及其他促炎细胞因子水平升高[30]。既往研究也发现,与对照组相比,强直性脊柱炎患者血清IL-17和IL-23水平升高,滑液中IL-23浓度升高,其中JAK/STAT信号通路中参与IL-23信号转导的STAT3也被发现与强直性脊柱炎相关[31],而且许多与强直性脊柱炎发病有关的细胞因子均会通过JAK途径发出信号[32]。因此,JAK信号通路参与强直性脊柱炎发病机制中促炎信号的转导。一项随机、双盲、安慰剂对照的Ⅱ期临床试验结果发现,口服选择性JAK1抑制剂非戈替尼治疗活动性强直性脊柱炎患者是安全且有效的[5]。
干燥综合征是一种常见的系统性自身免疫性疾病,女性与男性患病比为9∶1,80%的患者会出现口眼干燥、疲劳和关节疼痛的症状,超过半数患者的唾液腺和血液中可检测到IFN相关基因(Ⅰ型或Ⅱ型)的表达增加,而Ⅰ型和Ⅱ型IFN又会诱导B淋巴细胞活化因子在原发性干燥综合征患者的血清和唾液腺中升高,从而起到促进B淋巴细胞成熟、增殖和存活的作用,引起固有和适应性免疫系统的激活与自身抗体的分泌。这些自身抗体会构成免疫复合物,维持并放大IFN-α的产生,引起免疫系统活化,进而导致组织损伤[33],这表明Ⅰ型IFN(IFNα和IFNβ)和Ⅱ型IFN(IFNγ)在干燥综合征发病机制中具有核心作用。IFN与其受体的结合可激活JAK/STAT信号通路。IFN与细胞表面相应受体结合后,JAK活化导致其磷酸化,从而引起STAT蛋白募集、二聚化和核转位。在细胞核内STAT蛋白与DNA元件中的IFN活化位点结合会激活IFN刺激基因的转录,引起IFN相关基因表达增加[34]。
系统性硬化症是一种以皮肤和内脏器官纤维化为特征的自身免疫性疾病。系统性硬化症患者血清IL-4水平升高。IL-4是2型辅助性T淋巴细胞(Th2)的细胞因子,主要参与炎性反应并促进纤维化的发生,其他Th2细胞因子IL-13、转化生长因子(TGF)-β会协同加强这一效应,介导T淋巴细胞和纤维细胞之间的相互作用[35-36]。另一项关于JAK/STAT信号通路参与系统性硬化症病理过程的研究发现,系统性硬化症患者的外周T淋巴细胞和单核细胞中磷酸化STAT1或STAT3较健康受试者增多,且在系统性硬化症患者的皮肤切片中也发现了磷酸化STAT3细胞[37],表明IL-4通过JAK/STAT信号通路引起STAT蛋白的活化,从而影响细胞内基因的表达,促使系统性硬化症纤维化的发生,因此JAK抑制剂可能是治疗系统性硬化症的一种新的选择。
3 小结与展望
风湿免疫性疾病种类多且发病机制十分复杂,许多参与免疫炎症性疾病发病机制的细胞因子通过JAK/STAT信号通路将胞外信号转导到胞内,该信号通路作为细胞因子参与风湿免疫性疾病发病的枢纽,与风湿免疫性疾病的发生、发展密切相关,且治疗靶点丰富,具有巨大的临床应用潜力[12]。JAK抑制剂已被证明是治疗类风湿性关节炎的有效办法,目前也有大量研究探讨JAK抑制剂在其他免疫性疾病(包括银屑病、系统性红斑狼疮、炎性肺病、自身炎症性疾病)中的作用,越来越多的JAK抑制剂,如托法替布、巴瑞替尼、奥拉替尼、卢索替尼被用于风湿免疫性疾病的治疗,但是,在风湿免疫性疾病的发病机制中关于JAK/STAT信号通路的认识刚起步,其具体发挥着怎样的作用还需要进一步研究和探索。因此,有必要深入研究JAK/STAT信号通路在各种风湿免疫性疾病发病中的具体作用机制,探讨以JAK/STAT信号通路为靶点的治疗方案,推动风湿免疫性疾病靶向治疗的发展。
作者贡献:肖凡妮负责论文整体构思与设计、文献检索及整理并撰写论文初稿;青玉凤提出研究思路,设计研究方案,对初稿进行修订;张全波负责论文的质量控制及审校,对论文整体负责。
本文无利益冲突。

