肺转移性副神经节瘤1 例报告及文献复习
许容容, 陆 远, 周建明, 彭丹丹, 朱晓莉, 韩淑华
(1. 东南大学附属中大医院呼吸与危重症医学科,江苏 南京 210009;2. 东南大学附属中大医院胸心外科,江苏 南京 210009;3. 东南大学附属中大医院影像科,江苏 南京 210009)
副神经节瘤(paraganglioma,PGL)和嗜铬细胞瘤(phaeochromocytoma, PCC)均为起源于副神经节的肿瘤,统称为嗜铬细胞瘤和副神经节瘤(paraganglioma and phaeochromocytoma, PPGL),是一类少见的神经内分泌肿瘤。国内尚无准确的发病率统计,日本和美国布鲁克林第三医院在普通门诊高血压门诊患者中PPGL 的患病率为0.2%~0.6%[1]。起源于肾上腺髓质的肿瘤称为PCC,占PPGL 的80%~85%;起源于肾上腺外副神经节的肿瘤称为PGL,占PDGL 的15%~20%[2]。PGL可起源于沿着颈部和颅底分布的舌咽神经及迷走神经的副交感神经节,其中颈动脉体瘤、颈静脉球体瘤、鼓室球瘤和迷走副神经节瘤较为常见。PGL一般不分泌可引起血压波动的儿茶酚胺(catecholamine,CA),故一般临床症状表现不明显,患者大多因肿瘤生长引起局部压迫症状或者无症状体检时意外发现[3]。本研究报道了1 例女性患者因左肺结节10 d 入院就诊,术后病理检查提示肺部结节为转移性PGL,PGL 并发肺部转移相对少见,通过复习相关文献,为临床上PGL 的规范诊治提供参考。
1 临床资料
1.1 一般资料
患者,女性,57 岁,因“体检发现左肺结节10 d”于2021年3月25日入院,患者10 d 前在外院体检胸部CT 发现左肺上叶舌段及左肺下叶后基底段分别可见类圆形软组织密度影,较大者直径约1.2 cm,边缘欠光整,提示左肺上叶及下叶占位性病变待除外,左肺多发实性微结节影,左肺下叶点状钙化灶,左侧叶间胸膜增厚。后于山西省晋中市第一人民医院复查胸部CT 显示:双肺多发结节灶,其中较大者位于左肺上叶舌段及左肺下叶后基底段;右肺中叶外侧段及左肺上叶下舌段多发小斑片影及纤维索条影,考虑炎性改变。无咳嗽咳痰,无胸闷气喘,无胸痛咯血,无头晕头痛,无恶心呕吐,无腹痛腹泻,今患者为进一步诊治,至本院就诊。
1.2 既往史
患者曾因进行性耳聋在外院行颈静脉球体瘤手术切除(具体不详),后于2021年行放射治疗(具体不详);曾因肠息肉行手术切除术。患者既往健康状况一般,否认“高血压、糖尿病、冠心病”等慢性病史,否认“肝炎和结核”等传染病病史。否认其他手术和外伤史;否认输血史;否认药物及食物过敏史;否认有家族遗传性疾病史。
1.3 体格检查
体 温36.5 ℃, 脉 搏84 min-1, 呼 吸 频 率20 min-1,血压121/72 mmHg,神志清楚,精神尚可,发育正常,营养中等,查体合作,回答切题。双侧瞳孔等大等圆,直径约3 mm,对光反射灵敏,眼球运动自如。左耳听力下降,右耳听力正常。口唇无明显紫绀,咽无充血,双侧扁桃体无肿大。颈软,气管居中,甲状腺无肿大,无颈静脉充盈,肝颈静脉返流征阴性。双侧胸廓对称无畸形,呼吸节律规则,胸廓扩张度正常,触诊语颤无增强及减弱,双肺呼吸动度对称,无胸膜摩擦音,叩诊呈清音,双肺呼吸音清,未闻及干湿性啰音。心前区无隆起,心率84 min-1,律尚齐,各瓣膜听诊区未闻及明显病理性杂音。腹软,腹部未扪及包块,无压痛及反跳痛,肝脾肋下未扪及,肝肾区无叩痛,肠鸣音正常,移动性浊音阴性,四肢肌力及肌张力正常,双下肢无水肿。生理反射存在,病理反射未引出。
1.4 相关检查结果
入院后查血液和尿液肾上腺素(epinephrine,E),去甲肾上腺素(norepinephrine,NE),多巴胺(dopamine,DA)及中间代谢产物甲氧基肾上腺素(metanephrine, MN),甲氧基去甲肾上腺素(normetaneprine, NMN)及终末代谢产物香草扁桃酸(vanilmandelic, VMA) 浓度均在正常范围内。
1.4.1 颅脑MRI 平扫+增强 2021年2月18日外院颅脑MRI 平扫+增强:①左侧鼓室PGL 术后,现左侧桥小脑角区、颈静脉孔区及鼓室不规则异常强化影,与2020年12月30日检查结果相仿;②脑内散在缺血灶;③左侧鼻腔、筛窦异常信号影,考虑息肉可能性大;④左侧乳突炎。
1.4.2 胸 部CT 检 查 2021年3月17日 外 院 胸 部CT 检查提示:双肺多发结节灶;右肺中叶外侧段及左肺上叶下舌段多发小斑片影及纤维索条影,考虑炎性改变。
1.4.3 PET-CT 检 查 2021年3月24日 本 院PET-CT 检查提示:①左肺下叶实性结节,氟代脱氧葡萄糖(fludeoxyglucose,FDG) 代谢轻度增高,考虑早癌可能,建议活检;左肺上叶实性结节,FDG 代谢不高,不除外恶性病变可能;余双肺多发小结节,FDG 代谢均不高;两肺下叶胸膜下小斑片影,FDG 代谢不高,考虑间质性炎症可能;左侧斜裂胸膜局部增厚,左肺下叶钙化灶。②左侧头长肌外缘小淋巴结,FDG 代谢增高,不除外恶性病变可能。③双侧口咽对称性FDG 代谢增高,考虑炎性或生理性摄取可能;双侧颈血管鞘旁多枚小淋巴结,FDG 代谢轻度增高,考虑炎性淋巴结可能。④左侧附件区软组织密度灶,考虑良性病变可能,请结合临床妇科检查;腹膜后散在小淋巴结,FDG 代谢不高。⑤左侧上颌窦、左侧蝶窦及左侧筛窦炎, 肝左叶囊肿, 右肾小囊肿(图1)。

图1 肺转移性PGL 患者肺部PET-CT 影像表现Fig.1 Images of PET-CT of patient with pulmonary metastatic PGL
1.4.4 心脏彩超 2021年3月25日本院心脏彩超示: 心 脏 射 血 分 数(ejection fraction, EF) 为0.73,左室舒张功能减低。
1.4.5 肺功能检查 2021年3月25日本院肺功能检查提示:小气道病变,弥散功能正常,支气管舒张试验阴性。
1.4.6 胸部增强CT 2021年3月26日本院胸部增强CT:两侧胸廓形态对称,纵隔及气管居中,两肺纹理正常,两肺见多发小结节影,较大者于左肺下叶,大小为13 mm×11 mm,呈浅分叶状,增强扫描中度强化。右肺中叶及左肺上叶见少许条索影;双侧肺叶、段支气管形态未见异常,两侧肺门及纵隔结构未见异常。双侧胸膜未见异常,胸廓诸骨未见异常(图2)。

图2 肺转移性PGL 患者胸部增强CT 影像Fig.2 Images of chest contrast-enhanced CT of patient with pulmonary metastatic PGL
1.4.7 头颅+颈椎MR 平扫+增强 2021年3月30日本院头颅+颈椎MR 平扫+增强显示:①左侧中耳乳突炎;左侧上颌窦及蝶窦囊肿;左侧中鼻道软组织信号,息肉?内翻性乳头状瘤?②颈静脉球体瘤术后,左侧桥小脑角区、颈静脉孔区及鼓室异常信号,肿瘤残留/复发?请结合临床及老片比较;③脑内散在缺血腔梗灶;④C3/4 椎间盘膨出;C5/6 椎间盘轻度突出;⑤C4 和6 椎体许莫氏结节;颈椎退变;请结合临床随诊复查(图3)。
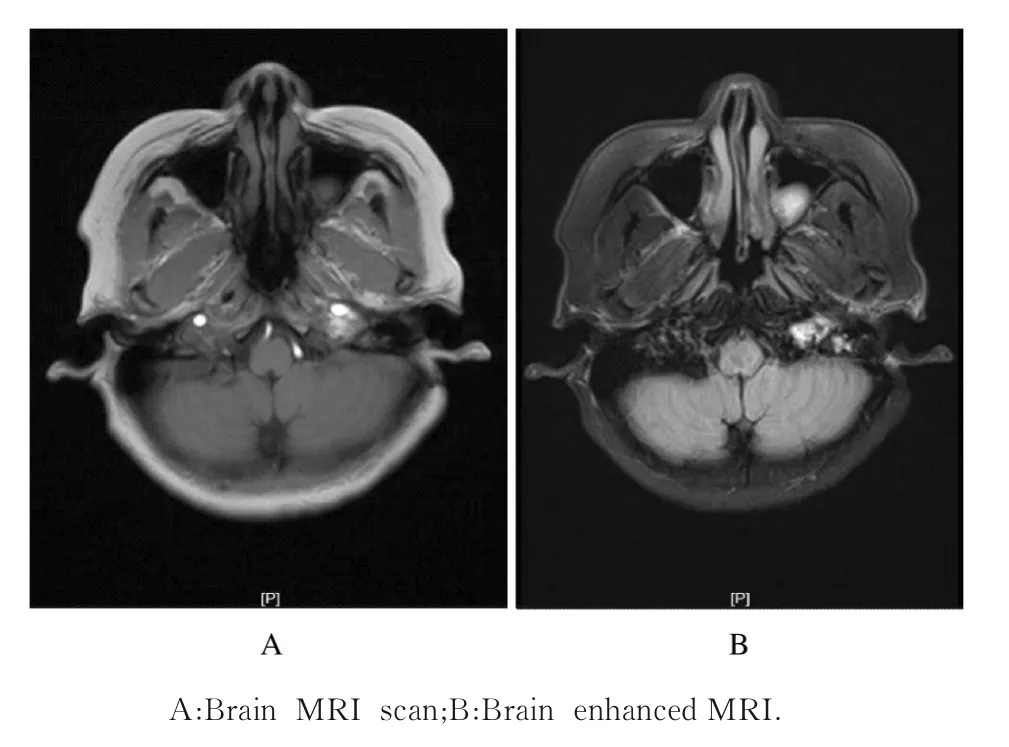
图3 肺转移性PGL 患者头颅MRI 影像Fig. 3 Images of brain MRI of patient with pulmonary metastatic PGL
1.5 入院诊断
①左肺结节性质待查:肿瘤?结核?②左侧颈静脉球体瘤术后。
1.6 治疗过程
患者入院后完善相关检查及术前评估,经胸心外科会诊后建议行全麻下经胸腔镜左肺上叶、下叶结节楔形切除术+淋巴结采样术。术中肉眼所见,左上肺楔形肺组织一块,切面见一灰白色结节,直径为7 mm;左下肺楔形肺组织切面见一灰白色结节,直径为12 mm(图4)。术中快速病理提示左上肺结节及左下肺结节为富于血窦的肿瘤,结合临床病史首先需排除原颈静脉球体瘤转移可能,待常规及免疫组织化学检查进一步明确。术后免疫组织化学检查结果:左上肺及左下肺结节膜糖蛋白56(CD56)(+)、嗜铬素A(CgA)(+)、Ki67(+约2%)、PanCK(-)、孕激素(PR)(-)、酸性钙结合蛋白(S-100)(散在+)、突触素(Syn)(+),甲状腺转录因子1(TTF1)(-)和细胞程序性死亡配体1[PD-L1(22C3)](约40%的肿瘤细胞胞浆弱阳性)(图5)。考虑原肿瘤转移至肺。脉管内见瘤栓,标本手术切缘均未见病变残留。下肺韧带旁淋巴结:淋巴结(1/4)见肿瘤转移;上纵隔淋巴结:淋巴结6 枚未见肿瘤转移;隆突下淋巴结:1 枚淋巴结未见肿瘤转移。患者术后恢复尚可,术后1 周顺利出院,考虑患者存在肺部及淋巴结转移。术后采用高通量测序法(iNGS)检测手术标本基因突变情况,结果未提示有肿瘤特有突变及胚系突变,仅检测到药物代谢相关酶类基因多态性,包括:胞苷脱氨酶基因(cytidine deaminase gene, CDA)、 二 氢 嘧 啶 脱 氨 酶 基 因(dihydropyrimidine deaminase gene,DPYD)、核苷酸切除修复交叉互补基因2 (nucleotide excision repair cross complementary gene 2,ERCC2)、谷胱甘肽硫转移酶M1 基因(glutathione thitransferase M1 gene,GSTM1)、亚甲基四氢叶酸还原酶基因(methylene tetrahydrofolate reductase gene,MTHFR) 和X 射线修复交叉互补基因1 (X-ray repair of cross complementary gene 1,XRCC1);未检测到高度微卫星不稳定(no high microsatellite instability detected, MSI-H); 肿 瘤 突 变 负 荷(tumor mutational burden,TMB):0个突变/100万个碱基(Mb)。建议患者进一步术后辅助治疗,患者决定于北京市天坛医院进一步诊治。

图4 肺转移性PGL 患者左肺上叶(A)和左肺下叶(B)术后标本照片Fig. 4 Postoperative samples of up left lung(A) and low left lung(B)of patient with pulmonary metastatic PGL
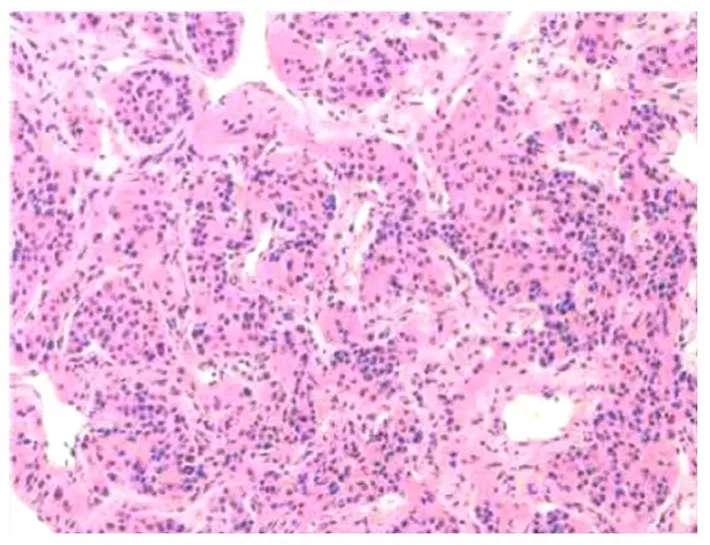
图5 肺转移性PGL 患者肺部结节术后标本形态表现(HE,×200)Fig. 5 Morphology of postoperative samples of patient with pulmonary nodules of metastatic PGL(HE,×200)
2 讨论
PGL 是少见的神经内分泌肿瘤,世界卫生组织(WHO)(2014)内分泌肿瘤分类中被定义为交界性/生物学行为不确定性肿瘤,而在WHO《2017内分泌器官肿瘤分类》中PCC 和PGL 被全部调整为恶性,因为随着研究的深入,发现原先诊断为良性的PGL,部分病例经过治疗和随访后出现转移性病灶,具有恶性肿瘤的生物学特征[1]。国内尚无发病率的统计,美国化学学会及欧洲内分泌学会统计PGL 的 发 病 率 约 为5/10 万[4-5]。PGL 为 起 源 于肾上腺外副神经节,包括腹部(最常见)、胸部、骨盆和颈部;其中来源于头颈部和颅底的PGL 大多起源于副交感神经节,通常不产生儿茶酚胺(catecholamine,CA)。PGL 的病因尚不明确,但研究表明致病基因的种系突变与其发病相关,约1/3 的患者存在基因突变[6]。根据细胞内信号传导通路的不同,可将上述基因分为2 类:第一类是与缺氧通路相关,通过激活缺氧诱导因子,刺激肿瘤的生长,包括琥珀酸脱氢酶复合物(succinate dehydrogenase complex,SDHx)、视网膜母细胞瘤(von Hippel-Lindau,VHL)、缺氧诱导因子2A(hypoxia inducible factors 2A,HIF2A) 和脯氨酸羟化酶2 编码基因(egl nine homolog 1, EGLN1)等;第二类是与激酶信号转导、蛋白质合成相通路相关的基因,通过激活MAPK 和mTOR 信号通路从而促进肿瘤的生长, 包括转染重排基因(rearrangged during transfection,RET)、神经纤维瘤病1 型(neurofibromatosis type 1,NF1)、MYC相关因子X(myc-associated factor X,MAX)和跨膜 结 构 域 蛋 白127 (transmembrane protein 127,TMEM127)等。信号通路之间不是独立的而是有交叉[7-9],其中SDHx 是家族遗传性突变概率最高的基因, 可引起家族性副神经节瘤综合症(familial paraganglioma sydrome,FPS)[10];SDHx包 含4 个 亚 基, 即SDHA、 SDHB、 SDHC 和SDHD 蛋白。一项回顾性研究[11]表明:儿童和青少年确诊患者中,SDHB 是最常见的突变基因(72%),其次为SDHD(9%)、VHL(6%)和其他突变(13%),并且SDHB 与肿瘤的远处转移及复发相关,建议存在转移性肿瘤的患者及直系亲属常规筛查SDHB 基因,将有助于疾病的诊断和预测患者的远期预后,对于存在SDHB 突变的患者随访的周期需要缩短并且需要制定综合的治疗方案[12]。
2.1 PGL 的临床表现
PGL 的临床表现根据患者的肿瘤部位、CA 分泌以及是否存在远处转移瘤等有较大差异,PGL大多位于肾上腺外副神经节组织,大多不分泌CA,因此CA 分泌过多所致的高血压、头痛、多汗和心悸等症状不典型,也是引起患者延迟就诊的原因之一[13];故此类患者早期没有明显的临床症状,常是因体检意外发现转移灶或者肿瘤生长引起局部压迫症状而就诊。该患者2018年因左耳进行性听力下降而至外院就诊,追问病史患者于2016年即出现左耳听力下降,多次就医未明确病因,未系统排查颅脑MRI,直至听力下降严重影响生活后至北京天坛医院就诊系统检查,随后发现左侧颈静脉球体瘤并行手术治疗。患者自2018年手术之后未进行规律随访,直至本次入院前体检胸部CT 提示左肺2 枚新发结节,患者自诉在2018年手术前胸部CT 检查未见明显异常,入院后为评估病情行PET-CT 检查,其中左肺下叶实性结节,FDG 代谢轻度增高,考虑早期肿瘤可能,建议活检;左肺上叶实性结节,FDG 代谢不高,不除外恶性病变可能,经过多学科会诊讨论,考虑肺部原发肿瘤不能完全排除,且2 枚结节中左肺上叶结节FDG 代谢不高,良性病变亦不能除外,2 枚结节位置均位于左肺,且位于左肺外周,气管镜活检无法触及,为获取病理组织,胸腔镜下手术切除为首选方案,故行外科手术切除。术后病理证实2 枚结节均为转移性PGL。
2.2 PGL 的治疗方案
2.2.1 手术治疗和随访 对于无手术禁忌证的PGL 患者,手术是首选的治疗方案。除了头颈部的PGL 和分泌多巴胺(dopamine,DA) 的患者,其他患者均需要进行充分的术前准备,避免术前、术中麻醉以及术后出现血压大幅度波动进而对患者造成严重影响;同时全程的生命体征监测至关重要[14]。PGL 存在复发及远处转移倾向,目前推荐所有接受手术治疗的患者,术后需终生进行随访,尤其是存在基因突变[琥珀酸脱氢酶复合物B(SDHB)、琥珀酸脱氢酶复合物D (SDHD) 和VHL 基因突变] 的患者,随访的周期需要缩短[15-16]。即便是对于并发有远处转移的患者,减瘤手术也会使患者获益。患者术后标本基因检测结果并未发现存在SDHB 及其他常见肿瘤相关基因突变,3年后仍然出现肺部转移病灶,因此对于基因突变阴性的患者,术后规律随访仍非常重要。目前对于接受手术的患者建议在术后0.5~1.0年内每6 周进行一次随访,之后进行年度随访[6,17],随访筛查的内容包括:①影像学检查。头颈部MRI、胸腹盆CT、胸腹盆增强CT 或者全身PET-CT 检查;②生化检验包括激素及代谢产物的测定,如血清和尿液E、 NE、 DA 及中间代谢产物MN、NMN 及终末代谢产物VMA 浓度等。PCC 患者多存在激素水平及代谢产物的异常,本例患者为肾上腺外肿瘤,入院后筛查激素水平及代谢产物浓度均在正常范围内。
2.2.2 化疗和放疗 对于无法接受手术治疗的患者,化疗或放疗可作为主要的治疗手段,常用的化疗方案为环磷酰胺、 长春新碱和达卡巴嗪(cyclophosphamide, vincrisine, dacarbazine,CVD)[18-19]。研究[20-21]表明:CVD 化疗方案可使半数以上的患者达到疾病控制,但并不能延长患者的生存期,并且还会出现相关的不良反应,如严重的骨髓抑制和甲状腺功能减退等。局部病灶进展伴有临床症状的患者可考虑局部放疗(external beam radiation therapy, EBRT)[22]; 如 果 间 碘 苄 胍(metaiodobenzylguanidine, MIBG) 显像阳性,则可以应用131I-MIBG 治疗[23]。
2.2.3 靶向治疗 随着PGL 发病机制及分子信号通路研究的深入,靶向治疗是当今个体化、精准治疗的趋势[24]。与PGL 发病相关的2 条信号通路包括缺氧相关信号通路及激酶信号转导和蛋白质合成通路,这2 条通路中的相关基因突变与疾病的发生发展存在密切关系,调控关键基因的表达,可能具有潜在的治疗前景[24-25]。研究[26]表明:在PGL 患者肿瘤组织中,谷氨酰胺酶-1 在SDHB 表达低的患者中高表达,表明谷氨酰胺酶-1 的表达与PGL 恶性程度相关,谷氨酰胺酶可能是潜在的具有治疗作用的靶点;对于存在SDHB 突变的患者,聚胺信号通路被过度活化,而聚胺通路抑制剂可显著抑制人hPheo1 细胞株的生长以及移植瘤小鼠的肿瘤生长,在细胞及动物模型层面阐述了聚胺类似物抑制剂治疗PCC/PGL 的可能性,有望成为恶性PCC/PGL靶向治疗的选择[27]。
2.2.4 抗血管生成治疗 PGL 是血管丰富的肿瘤,本例患者术后标本描述为富于血窦的肿瘤,血供丰富是与PGL 复发及转移相关的重要因素。具有抗血管特性的酪氨酸激酶抑制剂舒尼替尼可作用于多个靶点, 包括血管内皮生长因子受体(vascular endothelial growth factor receptors,VEGFR)、血小板源性生长因子受体(plateletderived growth factor receptor,PDGFR)、原癌基因C-KIT 和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR) 等,体 外 实 验[28]表明:舒尼替尼能够抑制PGL 细胞株细胞增殖,可能是通过作用于细胞周期、DNA 代谢以及细胞组织基因等发挥作用,多靶点的络氨酸激酶抑制剂可能是PGL 能够选择的治疗方案之一。其他仍在临床试验阶段的药物包括阿昔替尼和乐伐替尼等。抗血管生成药物将成为PGL 治疗策略中的重要组成部分。
综上所述,PGL 是少见的恶性神经内分泌肿瘤,具有远处转移及复发的倾向,临床表现不典型,常常以转移病灶的临床表现就诊,容易误诊,确诊有赖于病理学检查。随着对PGL 发病机制、分子途径认识的深入,目前PGL 的治疗方案有了更多的选择,除了传统的手术和化疗等治疗手段之外,靶向治疗和抗血管生成疗法也成为可选择的治疗方式,通过有效的治疗,PGL 患者的生存率及生活质量将会大大提高。

