抗菌肽LL-37 对糖尿病心肌病大鼠心肌损伤的保护作用及其机制
武春艳, 汪剑英, 曾海燕, 谭少文
(1. 南华大学附属第三医院心血管内科,湖南 衡阳 421900;2. 南华大学附属第三医院神经内科,湖南 衡阳 421900;3. 南华大学附属第二医院心血管内科,湖南 衡阳 421001)
糖尿病心肌病 (diabetic cardiomyopathy,DCM)是一种因高糖环境所致心肌特异性病变的糖尿病并发症,是导致糖尿病患者致残或死亡的重要原因之一。DCM 病理生理变化以高血压、高血脂、炎症反应和心肌结构及功能异常为主要特征[1]。虽然血糖控制和改善胰岛素抵抗是治疗糖尿病的常用方法,但DCM 心肌损伤并未得到明显改善。 研究[2-3]表明: Toll 样受体4/核 因 子κB(Toll-like receptor 4/nuclear factor-κB,TLR4/NFκB)信号通路介导的炎症反应在DCM 发生发展中起到重要作用。TLR4 可刺激NF-κB 通路促进DCM 中调节先天免疫所必需的炎症细胞因子的产生,导致DCM 大鼠心肌组织纤维化、心肌炎症和心肌细胞肥大,最后发展为心肌功能障碍[4-5]。YOUSSEF 等[6]发现抑制TLR4/ NF-κB 通路激活介导的炎症反应可改善心肌损伤,是治疗DCM 心肌损伤的关键靶点。抗菌肽LL-37 是人体内发现的唯一抗菌肽,在先天免疫系统机制中起重要作用,其除具有抗菌活性外,还具有趋化活性、修复损伤、抑制细胞凋亡和细胞毒性等活性[7]。研究[8]表明:抗菌肽LL-37 在肥大细胞中可与Toll 样受体(Toll-like receptors,TLR) 结合,抑制TLR 信号通路,减少促炎细胞因子的产生,并促进损伤组织愈合。然而,抗菌肽LL-37 是否可以改善DCM 大鼠心肌损伤至今尚未见相关报道。因此,本研究采用链脲佐菌素(streptozotocin,STZ)+高脂饲料喂养大鼠构建DCM 模型,探讨抗菌肽LL-37 对DCM 大鼠心肌功能和形态学改变的潜在影响及其相关机制,为DCM 大鼠心肌损伤寻找一种新的治疗方法。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级雄性SD大鼠48 只,鼠龄6 周,体质量180~230 g,购于湖南省实验动物中心,动物使用许可证号:SYXK(湘)2019-0009。所有大鼠均在(22±1)℃、12 h光-暗循环的环境下饲养,实验前大鼠均以基础饲料喂养1 周。抗菌肽LL-37(纯度>99%)购自美国AbMole 生物公司;STZ 购自上海前尘生物科技有限公司,分别配制A 液(2.10 g 柠檬酸溶于双蒸水定容至100 mL) 与B 液(2.94 g 柠檬酸钠溶于双蒸水定容至100 mL),将A 液和B 液按1∶1.2 比例混合,调节pH 值至4.3,配制成柠檬酸缓冲液,最后将STZ 溶于柠檬酸缓冲液中,现用现配;兔抗TLR4、兔抗NF-κB p65、兔抗NF-κB 抑制因子(NF-κB inhibitor α,IκBα)、兔抗GAPDH、HRP标记山羊抗兔IgG(H+L)抗体和TUNEL 细胞凋亡试剂盒购自英国Abcam 公司;ELISA 试剂盒购自武汉默沙克生物科技有限公司。手提式血糖仪购自长沙三诺药业股份有限公司,AU2700 自动生化分析仪购自美国贝克曼公司,Vevo770 型超声心动仪购自加拿大Visual Sonics 公司。
1.2 实验动物模型制备和分组将48 只大鼠随机各分为正常对照组、模型组、低剂量LL-37 组和高剂量LL-37 组,每组12 只。除正常对照组外,其他各组大鼠均通过高脂饲料喂养+腹腔注射STZ构建DCM 模型[9],即采用高脂饲料(20%蔗糖、10%猪油、1.5%胆固醇、0.1%胆酸钠、8%蛋黄粉和60.4%普通饲料)喂养4 周后,禁食12 h,然后一次性腹腔注射30 mg·kg-1STZ。注射72 h 后采血测量随机空腹血糖(fasting blood glucose,FBG)水 平,若2 次 随 机FBG 水 平 均>16.7 mmol·L-1,则表示2 型糖尿病实验动物模型构建成功,剔除造模不成功大鼠,并予以补充。对照组大鼠采用普通饲料(75%玉米、20%麦麸、3%鱼粉、1.5%淀粉和0.5%盐)喂养4 周,禁食12 h 后腹腔注射等体积生理盐水。造模成功后,低和高剂量LL-37 组大鼠分别腹腔注射0.5 和2.0 mg·kg-1抗菌肽LL-37,正常对照组和模型组大鼠腹腔注射等量生理盐水,每天1 次,连续6 周。药物干预的同时,除正常对照组大鼠外,其他各组大鼠继续喂养高脂饲料,造成心肌损伤。
1.3 各组大鼠体质量和FBG 水平检测采用尾静脉穿刺采血,使用手持血糖仪分别于4 个时间点(干预前及干预后2、4 和6 周)检测各组大鼠FBG水平,同时记录各组大鼠体质量。
1.4 各组大鼠血脂水平检测药物干预6 周后静脉取血,采用AU2700 自动生化分析仪测定总胆固醇 (total cholesterol, TC) 和 甘 油 三 酯(triglyceride,TG)水平。
1.5 心脏超声检查各组大鼠心功能血脂检测结束后,腹腔注射200 μL 3%戊巴比妥钠麻醉大鼠,左胸脱毛后固定在操作台上, 采用配备RMVTM716 探头的Vevo770 型超声心动仪检测大鼠心功能,记录超声心动图参数:左心室舒张阶段末期内径(left ventricular end diastolic dimension,LVEDd)、 左 心 室 收 缩 阶 段 末 期 内 径 (left ventricular end systolic dimension, LVEDs)、左心室 射 血 分 数 (left ventricular ejection fraction,LVEF) 和左心室短轴缩短率(left ventricular fractional shortening,LVFS)。
1.6 HE 染色和TUNEL 染色观察各组大鼠心肌组织病理形态表现和心肌细胞凋亡率断颈处死大鼠后取适量心肌组织,固定包埋, 制成厚度约为3 μm 的切片,行常规HE 及TUNEL 染色,中性树脂封片,置于光学显微镜下观察心肌组织病理学和心肌细胞凋亡水平。经苏木精染色后,细胞核呈蓝色,伊红染色后胞浆呈现深浅不同的红色。TUNEL 染色阳性细胞(凋亡细胞)呈棕褐色,细胞凋亡率以随机5 个视野中阳性细胞百分率表示。细胞凋亡率=阳性细胞数/总细胞数×100%。
1.7 ELISA 法检测各组大鼠心肌组织中炎症因子水平取适量心肌组织加入生理盐水,超声破碎仪充分匀浆,4 ℃、4000 g 离心15 min,取上清液,参照ELISA 试剂盒操作说明书测定450 nm 波长处的吸光度(A)值,根据A 值和标准曲线计算白细胞介素1β (interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6) 和 肿 瘤 坏 死 因 子α (tumor necrosis factor-α,TNF-α)等炎症因子水平。
1.8 Western blotting 法检测各组大鼠心肌组织中TLR4/NF-κB 相关蛋白的表达水平取适量心肌组织加入RIPA 裂解缓冲液,使用碾磨棒于冰上充分碾磨,4 ℃、12000 g 离心20 min,取上清液,使用BCA 法检测试剂盒测定蛋白含量。取30 μg 蛋白,加入5×loading buffer 沸水浴10 min,经10%SDS-PAGE 电泳分离蛋白,通过湿转法将蛋白转移至PVDF 膜上,用5% 脱脂奶粉室温封闭2 h,TBST 洗涤3 次,分别加入TLR4 抗体(1∶500)、NF-κB p65 抗 体(1∶1000)、IκB α 抗 体(1∶1000) 和GAPDH 抗体(1∶1000),4 ℃孵育过夜。TBST 洗涤3 次,加入HRP 标记山羊抗兔IgG二抗(1∶10000),室温孵育1 h,TBST 洗 涤3 次,滴加ECL 显色液,显影拍照。采用Image Pro Plus 6.0 软件分析各泳道条带灰度值,计算目的蛋白相对表达水平。目的蛋白相对表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.9 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组大鼠体质量、FBG、血脂水平、LVEDd、LVEDs、LVEF、LVFS、心肌细胞凋亡水平、炎症因子表达水平和TLR4/NF-κB 相关蛋白表达水平均符合正态分布,以-±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠体质量干预前,与正常对照组比较,模型组大鼠体质量明显降低(P<0.05);与模型组比较,低和高剂量LL-37 组大鼠体质量差异无统计学意义(P>0.05)。与干预前比较,干预后各时间点正常对照组大鼠体质量逐渐升高(P<0.05),而 模 型 组、 低 剂 量LL-37 组 和 高 剂 量LL-37 组大鼠体质量逐渐降低(P<0.05),且干预后各时间点低剂量LL-37 组与模型组大鼠体质量比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量Tab. 1 Body weights of rats in various groups (n=12,-±s, m/g)
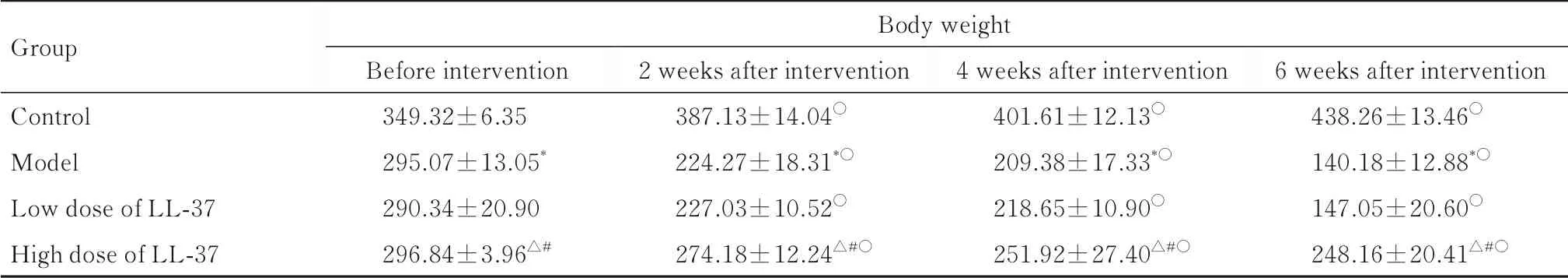
表1 各组大鼠体质量Tab. 1 Body weights of rats in various groups (n=12,-±s, m/g)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs low dose of LL-37 group;○P<0.05 vs before intervention.
Group Control Model Low dose of LL-37 High dose of LL-37 Body weight Before intervention 349.32±6.35295.07±13.05*290.34±20.90296.84±3.96△#2 weeks after intervention 387.13±14.04○224.27±18.31*○227.03±10.52○274.18±12.24△#○4 weeks after intervention 401.61±12.13○209.38±17.33*○218.65±10.90○251.92±27.40△#○6 weeks after intervention 438.26±13.46○140.18±12.88*○147.05±20.60○248.16±20.41△#○
2.2 各组大鼠血清FBG 水平干预前,与正常对照组比较,模型组大鼠FBG 水平明显升高(P<0.05);与模型组比较,低和高剂量LL-37 组大鼠FBG 水平差异无统计学意义(P>0.05)。与干预前比较,干预后模型组与低剂量LL-37 组大鼠FBG 水 平 逐 渐 升 高(P<0.05), 且 低 剂 量LL-37 组和模型组大鼠FBG 水平差异无统计学意义(P>0.05),而高剂量LL-37 组大鼠FBG 水平逐渐降低(P<0.05)。见表2。
表2 各组大鼠FBG 水平Tab.2 FBG levels of rats in various groups [n=12,-±s,cB/(mmol·L-1)]

表2 各组大鼠FBG 水平Tab.2 FBG levels of rats in various groups [n=12,-±s,cB/(mmol·L-1)]
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs low dose of LL-37 group;○P<0.05 vs FBG level before intervention.
Group Control Model Low dose of LL-37 High dose of LL-37 FBG level Before intervention 5.12±0.6121.00±1.42*21.40±0.6622.34±1.47△#2 weeks after intervention 5.26±0.7524.73±1.89*○23.83±1.23○20.12±1.61△#○4 weeks after intervention 5.60±0.8026.10±1.85*○25.01±2.73○17.44±1.50△#○6 weeks after intervention 5.72±0.1028.86±2.55*○27.36±2.74○14.50±2.39△#○
2.3 各组大鼠血脂水平与正常对照组比较,模型组大鼠TC 和TG 水平均明显升高(P<0.05);与模型组比较,高剂量LL-37 组大鼠TC 和TG 水平明显降低(P<0.05),而低剂量LL-37 组差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血脂水平Tab. 3 Serum lipid levels of rats in various groups[n=12,-±s,cB/(mmol·L-1)]
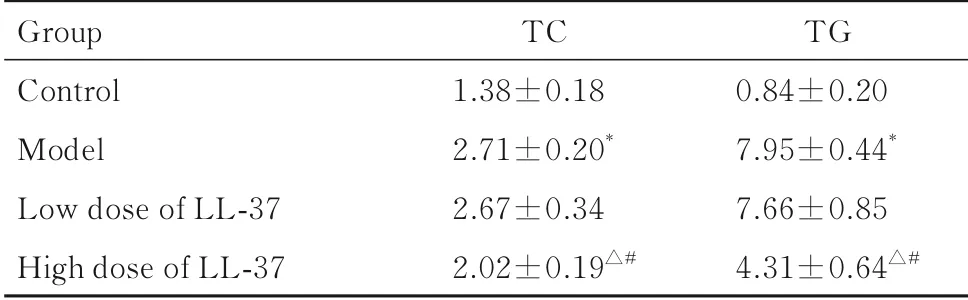
表3 各组大鼠血脂水平Tab. 3 Serum lipid levels of rats in various groups[n=12,-±s,cB/(mmol·L-1)]
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs low dose of LL-37 group.
Group Control Model Low dose of LL-37 High dose of LL-37 TC 1.38±0.182.71±0.20*2.67±0.342.02±0.19△#TG 0.84±0.207.95±0.44*7.66±0.854.31±0.64△#
2.4 各组大鼠心功能指标与正常对照组比较,模型组大鼠LVEDd 和LVEDs 均明显升高(P<0.05),LVEF 和LVFS 均明显降低(P<0.05);与模型组比较,高剂量LL-37 组大鼠LVEDd 和LVEDs 均明显降低(P<0.05),LVEF 和LVFS均明显升高(P<0.05),而低剂量LL-37 组上述各指标差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠心功能指标Tab. 4 Cardiac function indexes of rats in various groups (n=12,-±s)

表4 各组大鼠心功能指标Tab. 4 Cardiac function indexes of rats in various groups (n=12,-±s)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs low dose of LL-37 group.
Group Control Model Low dose of LL-37 High dose of LL-37 LVEDd (l/mm)2.81±0.203.81±0.10*3.74±0.272.74±0.11△#LVEDs (l/mm)1.27±0.162.82±0.18*2.57±0.531.41±0.10△#LVEF (η/%)81.30±5.7152.40±4.16*53.87±3.8676.39±4.15△#LVFS (η/%)45.37±3.0932.90±2.30*34.41±1.3344.18±2.79△#
2.5 各组大鼠心肌组织病理形态表现正常对照组大鼠心肌组织有完整且清晰的组织结构,心肌细胞呈平行排列,无明显的病理变化;而模型组DCM 大鼠心肌纤维排列紊乱,间质水肿;高剂量LL-37 组大鼠心肌组织病理变化明显改善,而低剂量LL-37 组大鼠心肌组织无明显改变。见图1。
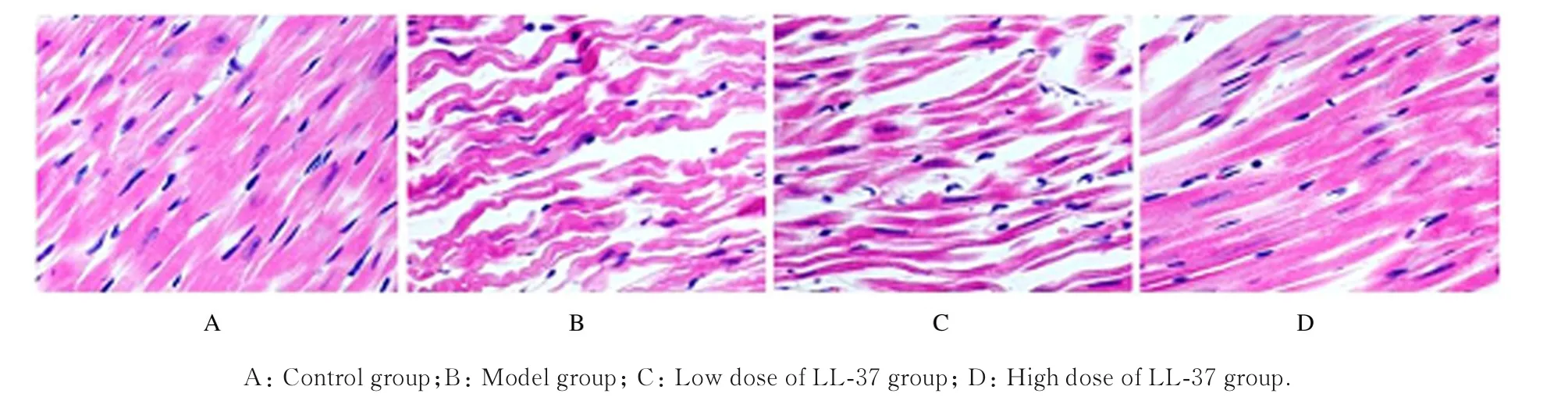
图1 各组大鼠心肌组织病理形态表现(HE,×400)Fig.1 Pathomorphology of myocardium tissue of rats in various groups(HE,×400)
2.6 各组大鼠心肌细胞凋亡率与正常对照组(3.40%±1.38%)比较,模型组大鼠心肌细胞出现核破裂,细胞凋亡率(41.51%±3.71%)明显升高(P<0.05);与模型组比较,高剂量LL-37 组大鼠心肌细胞凋亡率(22.38%±3.46%)明显降低(P<0.05),而低剂量LL-37 组大鼠心肌细胞凋亡率(39.86%±3.57%)差异无统计学意义(P>0.05)。见图2。
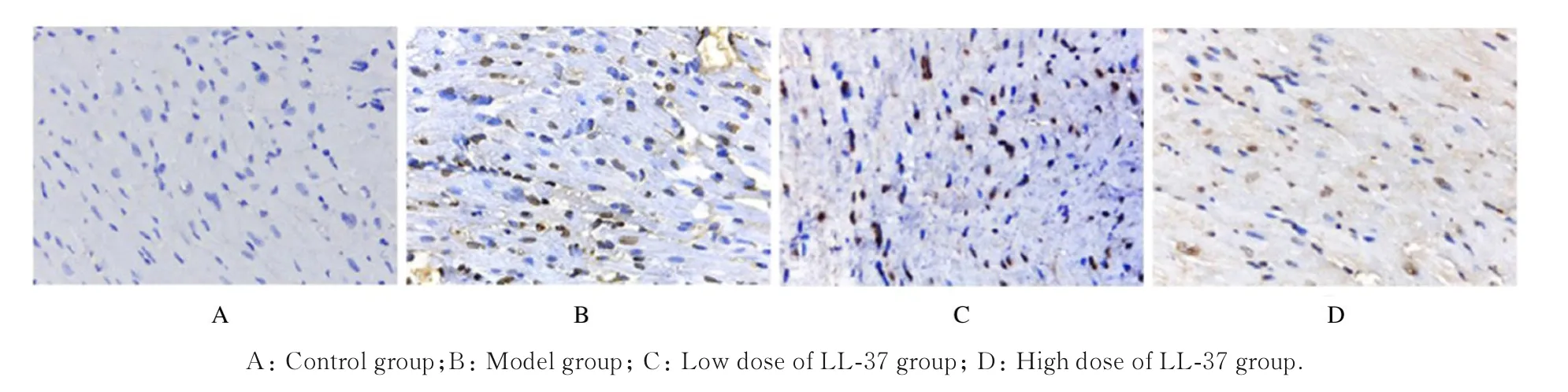
图2 各组大鼠心肌细胞凋亡情况(TUNEL,×200)Fig.2 Apoptosis of myocardial cells of rats in various groups(TUNEL,×200)
2.7 各组大鼠心肌组织中炎症因子水平与正常对照组比较,模型组大鼠心肌组织中炎症因子IL-1β、IL-6和TNF-α水平均明显升高(P<0.05);与模型组比较,高剂量LL-37组大鼠心肌组织中炎症因子IL-1β、IL-6 和TNF-α 水平均明显降低(P<0.05),而低剂量LL-37 组上述指标差异无统计学意义(P>0.05)。见表5。

表5 各组大鼠心肌组织中炎症因子表达水平Tab.5 Expression levels of inflammatory factors in myocardium tissue of rats in various groups[n=12,-x±s,ρB/(mg·L-1)]
2.8 各组大鼠心肌组织中TLR4/NF-κB 相关蛋白表达水平与正常对照组比较,模型组大鼠心肌组织中TLR4 和NF-κB p65 蛋白表达水平均明显升高(P<0.05),IκBα 蛋 白 表 达 水 平 明 显 降 低(P<0.05);与模型组比较,高剂量LL-37 组大鼠心肌组织中TLR4 和NF-κB p65 蛋白表达水平明显降低(P<0.05),IκBα 蛋 白 表 达 水 平 明 显 升 高(P<0.05),而低剂量LL-37 组各蛋白表达水平差异无统计学意义(P>0.05)。见图3。

图3 各组大鼠心肌组织中TLR4、NF-κB p65 和IκBα 蛋白表达电泳图(A)和直条图(B)Fig. 3 Electrophoretogram (A) and histogram (B) of expressions of TLR4, NF-κB p65 and IκBα proteins in myocardium tissue of rats in various groups
3 讨论
据统计,全球糖尿病成年患者数将从2010年的2.85 亿 人 增 加 到2030年 的4.39 亿 人[10]。DCM是由高血糖引发一系列的不良刺激,导致心肌纤维化和胶原沉积,最终发展为心肌舒张功能障碍,同时伴有LVEDd 升高,LVEF 降低,高血压和高血脂症状也很明显[11-12]。此外,高血糖还可能加速心肌细胞中间质蛋白(胶原)的糖基化,从而导致收缩功能障碍[13]。在早期阶段,这些变化是可逆的,有严格的代谢控制,但随着病理过程的进展,这些变化为不可逆,最终可能发展为糖尿病患者心肌损伤。然而目前对DCM 心肌损伤的具体病理生理机制还缺乏明确的认识,DCM 的治疗措施不能完全改善心肌损伤,寻找一种更有针对性的治疗策略来改善DCM 心肌损伤对治疗DCM 具有重要意义。
抗菌肽LL-37 是hCAP-18C-末端成熟形式抗菌肽。抗菌肽LL-37 作为一种多功能的宿主防御分子,可诱导伤口愈合、参与血管生成和调节细胞凋亡,对感染和组织损伤的正常免疫反应至关重要[14-15]。研 究[16]表 明:抗 菌 肽LL-37 可 以 诱 导 巨噬细胞中趋化因子和趋化因子受体的表达(IL-6、IL-8 和TNF-α 等),从而通过间接促进免疫细胞的迁移来促进免疫应答抵御感染。抗菌肽LL-37 还能够介导促进免疫反应的细胞反应,增强伤口愈合过程[17]。DCM 的各种病理生理过程最终导致心脏结构和功能的紊乱,抗菌肽LL-37 是否可以改善DCM 心肌损伤值得探讨。本研究采用STZ+高脂饲料喂养大鼠建立实验性DCM 动物模型,结果显示:模型组大鼠体质量明显降低,FBG 和血脂水平均明显升高,表明模型组大鼠体内糖代谢和脂代谢发生紊乱,这是DCM 的发病基础。心功能检测发现:模型组大鼠LVEDd 和LVEDs 均明显升高,LVEF 和LVFS 均明显降低,模型组大鼠表现出心脏舒张功能和收缩功能障碍。HE 染色和TUNEL染色结果显示:模型组大鼠心肌组织损伤和细胞凋亡严重,表明DCM 造模成功[18-19]。抗菌肽LL-37处理后DCM 大鼠血糖和血脂水平降低,细胞凋亡减少,心脏各功能指标均明显缓解,心肌损伤明显改善,表明抗菌肽LL-37 对DCM 大鼠心肌损伤具有明显保护作用。
NF-κB 是控制促炎细胞因子表达和细胞存活的主要转录因子,通过刺激IL-1β、IL-6 和TNF-α 等炎性细胞因子的形成参与炎症过程的调节,从而加快心肌组织损伤,导致糖尿病患者心力衰竭[20-21]。TLR4 是一种跨膜蛋白,可与内源性配体结合,通过信号转导途径活化NF-κB,从而引发炎症反应[22]。陆晓丹等[23]研究发现:抑制TLR4/NF-κB信号通路的异常活化所介导的炎症反应可明显改善DCM。因此,本研究对抗菌肽LL-37 保护DCM 大鼠心肌损伤的作用机制与TLR4/ NF-κB 信号通路是否有关进行探讨,结果显示:DCM 大鼠心肌组织中TLR4 和NF-κB p65 蛋白表达水平,炎症因子IL-1β、IL-6 和TNF-α 的表达水平均明显升高,而IκBα表达水平明显降低,表明模型组TLR4/NF-κB信号通路处于激活状态,且有明显的炎症反应。抗菌肽LL-37 治疗后IκBα 蛋白表达水平明显升高,而TLR4、NF-κB p65 和各炎症因子的表达水平均明显降低,TLR4/NF-κB 信号通路被明显抑制。由此可见,抗菌肽LL-37 对DCM 大鼠心肌损伤的保护作用可能与抑制TLR4/NF-κB 信号通路的激活有关,通过抑制TLR4/NF-κB 信号通路介导的炎症细胞因子的产生减轻炎症反应,从而保护心肌损伤。但本研究的不足之处在于未使用TLR4/NF-κB信号通路抑制剂进一步予以证实。
综上所述,抗菌肽LL-37 治疗可能通过抑制TLR4/NF-κB 信号通路活化,抑制心肌细胞凋亡,减轻炎症反应、改善心肌结构异常和心肌功能障碍,从而保护DCM 大鼠心肌损伤。因此,抗菌肽LL-37 可能是治疗DCM 心肌损伤的新疗法,其临床治疗作用有待进一步研究。

