毛蕊异黄酮对肝硬化大鼠肠黏膜屏障功能的影响及其机制
刘 琦, 徐 新, 王正根
(南华大学附属第二医院消化内科,湖南 衡阳 421001)
肝硬化常见于慢性肝病的终末期,由多种因素长期干预引起肝脏变形变硬、肝细胞坏死和假小叶形成,进而造成弥漫性肝损伤[1]。肝硬化晚期会导致多器官或组织的受累,出现消化道出血、继发性感染、肝性脑病和肝癌等主要并发症。多项研究[2-5]显示:肝硬化可使肠组织处于缺血缺氧状态,引起肠组织部分坏死,细菌移位,导致肠黏膜屏障损伤,而肠道生态失调会再次引起免疫刺激加速肝硬化,表明肝硬化与肠黏膜屏障损伤存在相互影响的关系[2-3]。炎症是造成肠黏膜屏障损伤的主要 因 素,而Toll 样 受 体4/核 因 子-κB (Toll-like receptor 4/nuclear factor kappa B,TLR4/NF-κB)信号通路是调控炎症最常见的信号通路之一[4]。在炎症性肠病中,TLR4/NF-κB 信号通路在肠组织中高度活化,并且阻断该信号通路可改善肠道炎症反应[5]。毛蕊异黄酮是中药黄芪的主要成分,具有抗菌效果[6]。研究[7]显示:毛蕊异黄酮可通过调控整合素β1/NF-κB 通路,抑制NF-κB 表达,从而达到抗炎效果,对胃黏膜损伤起到保护作用。然而,毛蕊异黄酮能否对肝硬化致肠黏膜屏障功能损伤具有改善作用,尚不明确。因此,本研究拟构建肝硬化大鼠模型,观察毛蕊异黄酮对肝硬化大鼠肠黏膜屏障功能的影响,并探讨其作用机制,为在临床上应用毛蕊异黄酮治疗肝硬化致肠损伤提供科学依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级雄性SD大鼠80 只,鼠龄6 周,体质量200~230 g,由广东至远生物医药科技有限公司提供,动物生产许可证号:SCXK(粤)2021-0057;在无特定病原体条件下饲养,温度21 ℃~24 ℃,相对湿度50%~55%,明暗光照各12 h,适应性饲养7 d。毛蕊异黄酮[ 高 效 液 相 色 谱 法 (high performance liquid chromatography,HPLC)] ≥98%,货号:JOT-10389]购自成都普菲德生物技术有限公司,四氯化碳(CCl4,0.3 mg·L-1,货号:C119833) 购自上海阿拉丁生化科技股份有限公司,大鼠白细胞介素1β(interleukin-1β,IL-1β)(货号:CSB-E08055r)、大鼠白细胞介素6 (interleukin-6,IL-6)(货号:CSB-E04640r) 和 大 鼠 肿 瘤 坏 死 因 子α (tumor necrosis factor-α,TNF-α)(货 号:CSB-E11987r)购自武汉华美生物有限公司,D-乳酸(d-lactate,D-LA)(货号:SBJ-R0031)、二胺氧化酶(diamine oxidase, DAO)(货 号: SBJ-R0162)、 内 毒 素(endotoxin,ET)(货号:SBJ-R0392) 和酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA) 试剂盒购自南京森贝伽生物科技有限公司,TLR4 (编号:sc-293072)、NF-κB p65 (编号:sc-8008)、NF-κB 抑 制 因 子α (IκBα,编 号:sc-1643) 和GAPDH (编号:sc-365062) 抗体购自美国Santa Cruz 公司。电泳仪(型号:164-5056)购自美国Bio-Rad 公司,正置显微镜(型号:CX23)购自日本Olympus 公司,全自动生化分析仪(型号:BK-200)购自济南鑫贝西生物技术有限公司。
1.2 实验动物造模和分组将80 只SD 大鼠随机分为对照组(n=12)和造模组(n=68),造模组大鼠采用CCl4联合乙醇复合法诱导肝硬化大鼠模型[8]:造模组大鼠以10%乙醇溶液作为唯一饮用水,并根据大鼠体质量,首次皮下注射剂量为5 mL·kg-150%CCl4- 橄 榄 油 溶 液, 后 续 剂 量为3 mL·kg-1,每4 d 1 次,连 续9 周。9 周 内 共18 只大鼠死亡,随机从造模组中抽取3 只大鼠用于病理组织学检测,以肉眼可见肝脏组织结节及病理显示假小叶形成即视为造模成功[9]。将造模成功的大鼠随机分为模型组、低剂量毛蕊异黄酮组和高剂量毛蕊异黄酮组,每组12 只。分组后,低和高剂量毛蕊异黄酮组大鼠分别给予5 和20 mg·kg-1毛蕊异黄酮灌胃,对照组和模型组大鼠给予等量生理盐水灌胃,每天1 次,连续4 周。
1.3 生物化学检测各组大鼠血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(asportate transaminase,AST)活性末次灌胃24 h 后,取各组大鼠腹主动脉血,室温放置30 min,2600 r·min-1离心10 min,分离血清,按照说明书使用全自动生化仪检测血清中ALT(U·L-1)和AST(U·L-1)的活性。
1.4 HE 染色观察各组大鼠肝脏和回肠组织病理形态表现取各组大鼠肝脏和回肠组织,将已固定好的组织进行修剪,流水冲洗30 min,置于70%、80%、90%、95%和100%酒精中脱水,二甲苯中透明,浸蜡包埋及切片、热水展片、45 ℃烤片后制备石蜡切片(厚度为6 μm)。石蜡切片经二甲苯脱蜡、入100% (Ⅰ和Ⅱ)、90%、80%、70%和50%酒精并至水、蒸馏水漂洗,再将切片放入苏木精水溶液中染色10 min,流水冲洗1 min,1%盐酸酒精2 s,流水过洗2 s,0.5% 伊红溶液染色3 min,蒸馏水稍洗2 s,入80%、95%和100%酒精中脱水15 s,二甲苯透明,中性树胶封固后,观察大鼠肝脏和回肠组织病理形态学。其中回肠组织置于显微镜(×100)下随机选取5 个视野参考Nadler 标准[10]进行双盲评分,取其平均值,病理评分≥3 分视为肠损伤。
1.5 ELISA 法检测各组大鼠血清中D-LA、DAO和ET 水平及回肠组织中炎症因子水平取0.2 g大鼠回肠组织加入1.8 mL 生理盐水研磨制备组织匀浆,3800 r·min-1离心20 min,取上清冻存。取50 μL 回肠组织上清和血清,按照ELISA 试剂盒说明 书 进 行 操 作,测 定 血 清 中D-LA (mg·L-1)、DAO (U·mL-1) 和ET (EU·mL-1) 水平 及回肠组 织中炎症因子IL-1β、TNF-α 和IL-6(均为μg·L-1)水平。
1.6 Western blotting 法检测各组大鼠回肠组织中TLR4/NF-κB 信号通路相关蛋白表达水平取各组大鼠0.1 g 回肠组织,加入预冷的RIPA 裂解液提取总蛋白,采用BCA 法检测蛋白浓度。取30 μg(20 μL) 蛋白进行SDS-PAGE 凝胶电泳分离蛋白后转PVDF 膜,5%的脱脂奶粉常温封闭1.5 h,分别加入TLR4(1∶1000)、NF-κB p65(1∶1000)、NF-κB 抑 制 因 子(NF-κB inhibitor α, IκB α)(1∶1000) 及内参GAPDH (1∶1000) 抗体,4 ℃孵育一夜。次日,加入相应二抗(1∶10000)常温孵育1 h,TBST 缓冲液清洗3 次,ECL 试剂发光显影。应用Image J 进行条带灰度扫描分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1.7 统计学分析采用SPSS 22.0 软件进行统计学分析。各组大鼠血清中ALT 和AST 活性,D-LA、DAO 和ET 水平,回肠组织病理评分,回肠组织中IL-1β、 TNF-α 和IL-6 水 平, TLR4、NF-κB p65 和IκBα 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血清中ALT 和AST 活性与对照组比较,模型组大鼠血清中ALT 和AST 活性明显升高(P<0.05);与模型组比较,高剂量毛蕊异黄酮组大鼠血清中ALT 和AST 活性明显降低(P<0.05),而低剂量毛蕊异黄酮组ALT 和AST活性差异无统计学意义(P>0.05);与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠血清中ALT 和AST 活性明显降低(P<0.05)。见表1。
表1 各组大鼠血清中ALT 和AST 活性Tab. 1 Activities of ALT and AST in serum of rats in various groups [n=12,±s,ρβ/(U·L-1)]

表1 各组大鼠血清中ALT 和AST 活性Tab. 1 Activities of ALT and AST in serum of rats in various groups [n=12,±s,ρβ/(U·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of calycosin group.
Group Control Model Calycosin Low dose High dose FP ALT 32.93±3.7493.86±6.49*92.10±3.6750.99±5.23△#190.461<0.01 AST 63.46±2.98128.14±7.66*131.07±6.8879.36±4.77△#170.394<0.01
2.2 各组大鼠肝组织病理形态表现HE 染色结果显示:对照组大鼠肝小叶结构清晰,肝细胞排列分布正常,无炎性细胞浸润。模型组大鼠弥漫性纤维化形成纤维间隔致肝小叶结构紊乱,形成假小叶,并伴随着大量炎性细胞和脂肪变性。与模型组比较,高剂量毛蕊异黄酮组大鼠肝小叶结构较完整,无明显纤维增生,可见部分炎性细胞浸润和脂肪变性;而低剂量毛蕊异黄酮组大鼠肝组织病变情况与模型组一致。与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠肝脏损伤情况明显改善。见图1。
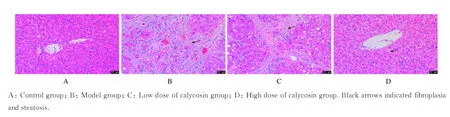
图1 各组大鼠肝组织病理形态表现(HE,×100)Fig.1 Pathomorphology of liver tissue of rats in various groups (HE, ×100)
2.3 各组大鼠血清中D-LA、DAO 和ET 水平与对照组比较,模型组大鼠血清中D-LA、DAO 和ET 水平明显升高(P<0.05);与模型组比较,高剂量毛蕊异黄酮组大鼠血清中D-LA、DAO 和ET水平明显降低(P<0.05),而低剂量毛蕊异黄酮组上述指标差异无统计学意义(P>0.05);与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠血清中D-LA、DAO 和ET 水平明显降低(P<0.05)。见表2。
表2 各组大鼠血清中D-LA、DAO 和ET 水平Tab. 2 Levels of serum D-LA, DAO, and ET of rats in various groups (n=12,±s)
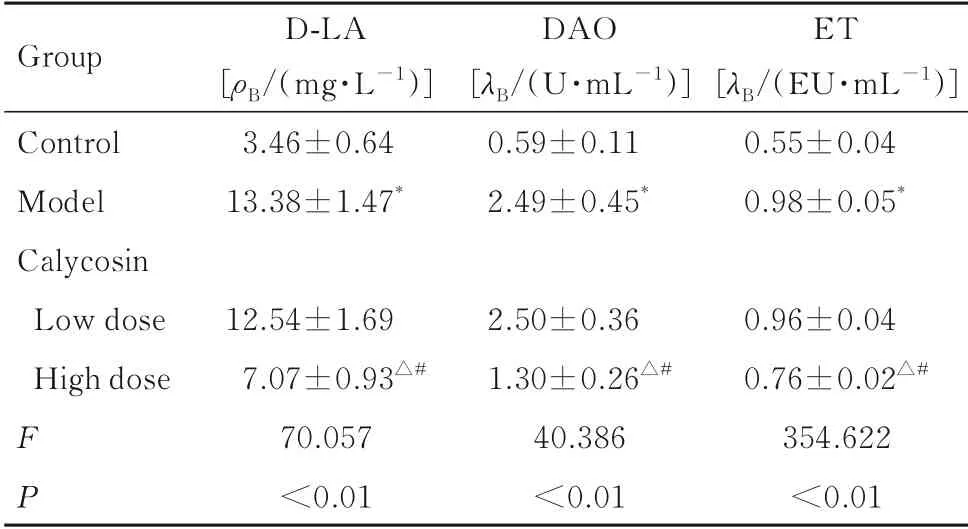
表2 各组大鼠血清中D-LA、DAO 和ET 水平Tab. 2 Levels of serum D-LA, DAO, and ET of rats in various groups (n=12,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of calycosin group.
Group Control Model Calycosin Low dose High dose FP D-LA[ρB/(mg·L-1)]3.46±0.6413.38±1.47*12.54±1.697.07±0.93△#70.057<0.01 DAO[λB/(U·mL-1)]0.59±0.112.49±0.45*2.50±0.361.30±0.26△#40.386<0.01 ET[λB/(EU·mL-1)]0.55±0.040.98±0.05*0.96±0.040.76±0.02△#354.622<0.01
2.4 各组大鼠回肠组织病理形态表现 HE 染色结果显示:对照组大鼠回肠组织固有层无水肿现象,绒毛排列整齐,病理结构正常。模型组大鼠回肠组织固有层聚集大量淋巴细胞,间质水肿,上皮结构紊乱,大量绒毛及腺体坏死。与模型组比较,高剂量毛蕊异黄酮组大鼠回肠组织结构有所改善,炎性细胞浸润和固有层水肿等现象减轻,部分绒毛坏死或断裂;而低剂量毛蕊异黄酮组大鼠回肠组织病理形态表现与模型组一致。见图2。对照组、模型组、低剂量毛蕊异黄酮组和高剂量毛蕊异黄酮组大鼠回肠组织病理学评分分别为(0.33±0.20)、(3.74±0.32)、(3.18±0.35)和(1.79±0.38)分,差异有统计学意义(F=114.702,P<0.01)。与对照组比较,模型组大鼠回肠组织病理学评分明显升高(P<0.05);与模型组比较,高剂量毛蕊异黄酮组大鼠回肠组织病理学评分明显降低(P<0.05),而低剂量毛蕊异黄酮组大鼠回肠组织病理学评分差异无统计学意义(P>0.05);与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠回肠组织病理学评分明显降低(P<0.05)。
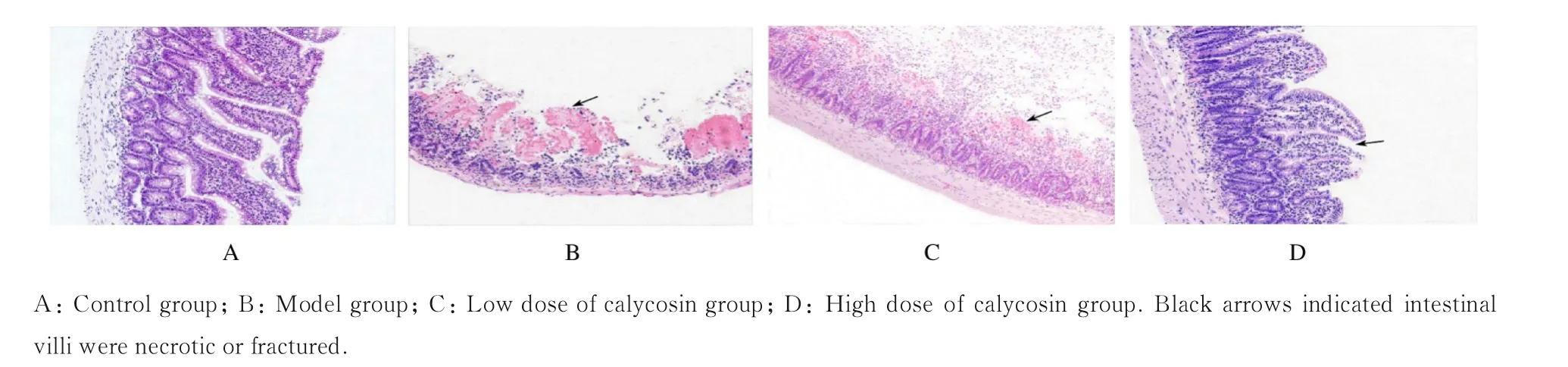
图2 各组大鼠回肠组织病理形态表现(HE,×100)Fig.2 Pathomorphology of ileum tissue of rats in various groups (HE, ×100)
2.5 各组大鼠回肠组织中炎症因子水平与对照组比较,模型组大鼠回肠组织中IL-1β、TNF-α 和IL-6 水平明显升高(P<0.05);与模型组比较,高剂量毛蕊异黄酮组大鼠回肠组织中IL-1β、TNF-α 和IL-6 水平明显降低(P<0.05),而低剂量毛蕊异黄酮组大鼠回肠组织中上述指标差异无统计学意义(P>0.05);与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠回肠组织中IL-1β、TNF-α 和IL-6 水平明显降低(P<0.05)。见表3。
表3 各组大鼠回肠组织中IL-1β、TNF-α 和IL-6 水平Tab. 3 Levels of IL-1β、TNF-α and IL-6 in ileum tissue of rats in various groups [n=12,±s, ρβ/(μg·L-1)]
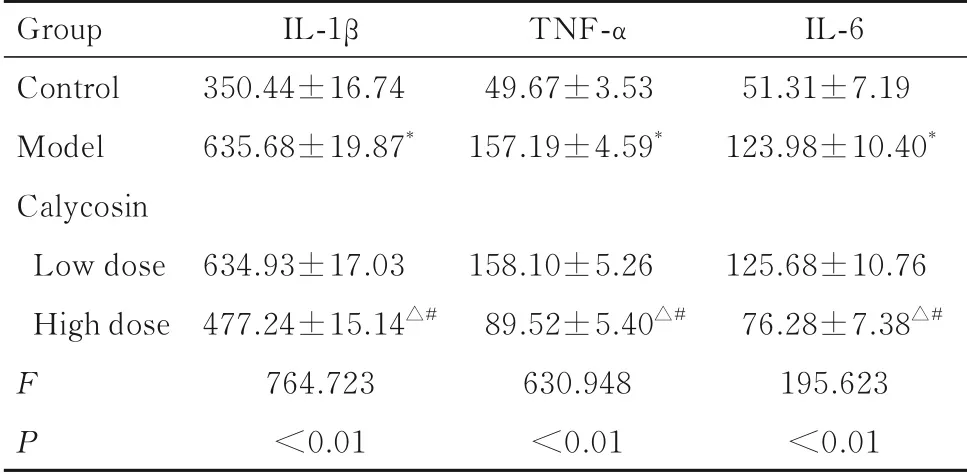
表3 各组大鼠回肠组织中IL-1β、TNF-α 和IL-6 水平Tab. 3 Levels of IL-1β、TNF-α and IL-6 in ileum tissue of rats in various groups [n=12,±s, ρβ/(μg·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of calycosin group.
Group Control Model Calycosin Low dose High dose FP IL-1β 350.44±16.74635.68±19.87*634.93±17.03477.24±15.14△#764.723<0.01 TNF-α 49.67±3.53157.19±4.59*158.10±5.2689.52±5.40△#630.948<0.01 IL-651.31±7.19123.98±10.40*125.68±10.7676.28±7.38△#195.623<0.01
2.6 各组大鼠回肠组织中TLR4/NF-κB 信号通路相关蛋白表达水平与对照组比较,模型组大鼠回肠组织中TLR-4 和NF-κB p65 蛋白表达水平明显升高(P<0.05),IκBα 蛋白表达水平明显降低(P<0.05);与模型组比较,高剂量毛蕊异黄酮组大鼠回肠组织中TLR-4 和NF-κB p65 蛋白表达水平明显降低(P<0.05),IκB α 蛋白表达水平明显升高(P<0.05),而低剂量毛蕊异黄酮组大鼠回肠组织中上述各指标差异无统计学意义(P>0.05);与低剂量毛蕊异黄酮组比较,高剂量毛蕊异黄酮组大鼠回肠组织中TLR-4 和NF-κB p65 蛋白表达水平明显降低(P<0.05),IκBα 蛋白表达水平明显升高(P<0.05)。见图3 和表4。
表4 各组大鼠回肠组织中TLR4/NF-κB 信号通路相关蛋白表达水平Tab. 4 Expression levels of TLR4/NF-κ B signaling pathway related proteins in ileum tissue of rats in various groups (n=12,±s)
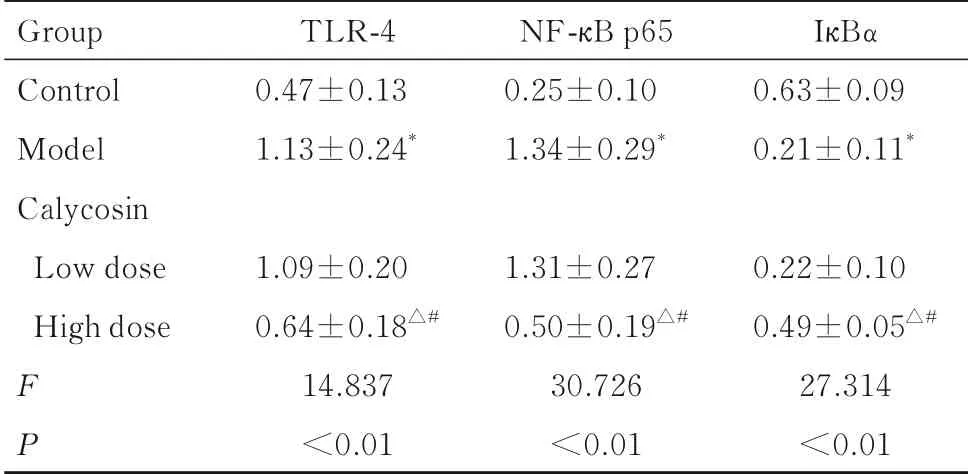
表4 各组大鼠回肠组织中TLR4/NF-κB 信号通路相关蛋白表达水平Tab. 4 Expression levels of TLR4/NF-κ B signaling pathway related proteins in ileum tissue of rats in various groups (n=12,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of calycosin group.
Group Control Model Calycosin Low dose High dose FP TLR-40.47±0.131.13±0.24*1.09±0.200.64±0.18△#14.837<0.01 NF-κB p650.25±0.101.34±0.29*1.31±0.270.50±0.19△#30.726<0.01 IκBα 0.63±0.090.21±0.11*0.22±0.100.49±0.05△#27.314<0.01

图3 各组大鼠回肠组织中TLR4/NF-κB 信号通路相关蛋白表达电泳图Fig. 3 Electrophoregram of expressions of TLR4/NFκB signaling pathway related proteins in ileum tissue of rats in various groups
3 讨论
前期研究[8-10]显示:在中医学中肝硬化由湿热所致,肝气郁积,影响脾胃,致血行不畅、脉络阻塞,造成积聚或症癜,后期则出现水蛊,提示肝硬化引起消化不良,导致肠道内细菌等有毒物质堆积,导致肠黏膜损伤,机体免疫力下降。临床研究[11-12]表明:50%的肝硬化患者表现出一种或多种症状,如腹水、因肝性脑病引起的不同程度的意识模糊和静脉曲张或细菌感染引起的急性胃肠出血等。由于肝硬化发病机制多样,临床常通过检测ALT 和AST 活性及组织活检来确诊疾病。且在动物实验中,CCl4联合乙醇复合法诱导大鼠肝硬化模型在病理生理等方面可完全模拟人肝硬化诱发肠道疾病,结果显示:血清中ALT 和AST 活性升高,肝组织出现假小叶,肠组织绒毛大量坏死,肠道内炎症和有毒物质爆发,产生大量腹水[13],与本研究中模型组结果一致,提示模型制备成功。研究[14-15]显示:毛蕊异黄酮灌服单向肠灌流模型大鼠发现其吸收机制为主动转运,且在小肠中吸收最好,能够在一定程度上保证肠道自然生理状态。研究[14]证实:毛蕊异黄酮可上调IκBα 来抑制由缺血再灌注引起的NF-κB 信号通路的激活,降低脑组织炎症因子,从而保护脑组织。但毛蕊异黄酮在肝硬化中能否发挥保护肠道的作用,目前还未见相关文献报道。本研究采用高剂量毛蕊异黄酮干预后,肝组织和肠组织损伤减轻,肝酶含量降低,并且肠组织中有害物质和炎症因子减少,同时抑制了TLR4/NF-κB 信号通路,初步表明毛蕊异黄酮对肝硬化引起的肠损伤有改善作用,可能与肠黏膜屏障、炎症和TLR4/NF-κB 信号通路的调控有关。
肠黏膜屏障是阻止细菌和有害物质进入血液循环及其他组织的第一道防线。肠黏膜屏障受损后,氧气和营养物质不能及时被黏膜吸收,代谢产物堆积,引起肠道通透性的增加(漏肠)和细菌的易位,促进微生物代谢产物通过肠腔穿过肠黏膜屏障到达肝脏,导致胆管酸代谢受损,促进全身炎症和肠道运动障碍[16]。研究[17-19]显示:非酒精性脂肪性肝病小鼠摄入果糖,可引起D-LA 活性增加,导致肠道渗漏和内毒素血症;且在缺血性结肠炎患者血清中D-LA、DAO 和ET 水平升高。急性失代偿性肝硬化中存在肠道炎症,通过评估粪便细胞因子谱以及其他标志物,如D-LA、脂肪酸结合蛋白-2和粪钙保护素,从而确定肠道失调可影响肠道屏障完整性[20]。表明D-LA、DAO 和ET 是造成肠黏膜屏障损伤的标志物。研究[21]显示:毛蕊异黄酮对断奶仔猪由于多种应激源产生的胃肠道感染具有治疗作用,可治疗志贺氏菌和肠道致病菌大肠杆菌等细菌引起的疾病和感染,并且具有增强断奶仔猪肠道内稳态平衡的潜力。本研究结果显示:高剂量毛蕊异黄酮组大鼠血清中D-LA、DAO 和ET 水平明显降低,肠绒毛趋于正常,表明毛蕊异黄酮可减少体内有害细菌和毒素蓄积,提高机体对有害物质的消除能力,从而保护肠黏膜屏障。
TLR-4/NF-κB 信号通路是炎症的调节通路[22]。 先天免疫系统通过病原体识别受体(PPRs) 特异性识别PAMPs,从而有效启动免疫反应。TLR 作为PPRs 家族中的一员,是先天免疫系统中最重要的受体之一。TLR-4 是研究中最先发现的TLR,受到刺激后TLR-4 高表达,IκBα 降解,NF-κB p65 大 量释放,从而诱导IL-1β、TNF-α 和IL-6 等 下 游 炎 症 因 子 高 表 达[23]。研 究[24-25]显 示:炎症性肠病受多种分子机制调控,目前认为引起炎症级联瀑布反应是导致肠黏膜损伤的核心原因,在脓毒症诱导的肠屏障功能障碍大鼠肠组织中TLR-4/NF-κB 通路被明显激活,促进炎症细胞释放更多的炎症介质。此外,炎症介质进一步加重了肠黏膜屏障功能的损伤,从而导致更多的致病菌和原发性血小板增多症(ET)进入血液。CHAO 等[26]研究显示:毛蕊异黄酮明显抑制促炎细胞因子mRNA 的表达,降低髓过氧化物酶(MPO)活性,并且明显抑制NF-κB 通路和JNK 的磷酸化,维持肠黏膜的完整,从而治疗结肠炎。为进一步探讨毛蕊异黄酮对肝硬化大鼠肠黏膜保护作用的可能机制,本研究检测TLR-4/NF-κB 信号通路相关蛋白表达水平及其下游炎症因子,结果显示:采用高剂量毛蕊异黄酮干预后,肝硬化大鼠回肠组织中TLR-4 和NF-κB p65 蛋白表达水平及IL-1β、TNF-α 和IL-6炎症因子水平明显降低,IκBα 蛋白表达水平明显升高,表明毛蕊异黄酮通过下调回肠组织中TLR-4/NF-κB 信号通路相关因子的活性,进而降低炎症因子的表达,从而减轻肝硬化大鼠肠黏膜屏障损伤。
综上所述,毛蕊异黄酮能够改善肝硬化大鼠肠黏膜屏障损伤并抑制TLR4/NF-κB 信号通路。然而,毛蕊异黄酮是否对TLR4/NF-κB 信号通路靶向调控还不完善,后续研究还应结合使用TLR4/NF-κB 信号通路抑制剂进行动物实验探讨。

