毛蕊异黄酮对宫颈癌HeLa细胞增殖及凋亡的影响
黄莉莉, 张智勤, 黄 琦, 苏瑞莲, 黄秀敏, 2
(1. 厦门大学附属中山医院 妇产科, 福建 厦门, 361004; 2. 福建医科大学 临床医学部, 福建 福州, 350000)
宫颈癌是威胁女性健康的恶性肿瘤之一,目前临床常采用手术、放化疗等方式进行治疗,由于部分患者对放化疗药物具有抵抗性,治疗效果降低[1-2]。从植物中提取的活性成分具有抗肿瘤作用,研究[3-4]表明部分中药具有抗肿瘤作用。毛蕊异黄酮属于中药黄芪的有效活性成分,具有抗病毒、抗肿瘤等作用。研究[5]表明,毛蕊异黄酮可抑制膀胱癌细胞增殖及促进细胞凋亡。但毛蕊异黄酮与宫颈癌相关研究报道相对较少。微小RNA(miRNA)在肿瘤等多种疾病中表达异常,可以通过调节癌症细胞的凋亡和增殖从而调节癌症的生长。研究[6-8]表明,miR-4766-5p在多种癌症中低表达,包括胃癌、食管癌、结直肠癌等,且作为抑癌基因参与调节癌症的发展。但miR-4766-5p对宫颈癌细胞增殖及凋亡的影响尚未可知。因此,本研究主要探讨毛蕊异黄酮对宫颈癌细胞增殖及凋亡的影响,以及miR-4766-5p是否介导其作用。
1 材料与方法
1.1 材料与试剂
选取2020年1—3月在厦门大学附属中山医院治疗的宫颈癌患者49例为研究对象,患者平均年龄为(56.32±3.49)岁。手术时收集癌组织及癌旁组织,随后置于-80 ℃保存。所有受试者均签署知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
毛蕊异黄酮购自上海源叶生物科技有限公司(纯度≥98%); 人宫颈癌细胞HeLa由上海弘顺生物科技有限公司提供; 上海碧云天生物公司提供DMEM培养液、胎牛血清、CCK-8试剂以及细胞凋亡检测试剂盒。北京索莱宝提供 Lipofectamine2000; 反转录与PCR试剂由北京天根生化提供; miR-NC、miR-4766-5p mimics、anti-miR-4766-5p、anti-miR-NC由上海吉玛合成; 美国Cell Signaling Technology公司提供兔抗人cleaved-caspase3、cleaved-caspase9抗体与HRP标记的二抗。
1.2 方法
1.2.1 实验分组: HeLa细胞接种于6孔板(1×105个/孔),分别与低、中、高浓度的(25、50、100 μmol/L)毛蕊异黄酮共培养24 h[7], 并设为毛蕊异黄酮-低组、毛蕊异黄酮-中组、毛蕊异黄酮-高组,未处理的细胞为对照组。用不含血清的培养基稀释Lipofectamine2000, 不含血清的培养基分别稀释miR-NC、miR-4766-5p mimics、anti-miR-NC、anti-miR-4766-5p, 培养6 h后将培养基更换为含有100%胎牛血清的正常培养基继续培养48 h。采用脂质体转染法进行转染,根据实验计划,部分细胞转染后,经100 μmol/L毛蕊异黄酮培养24 h, 细胞分别记为miR-NC组、miR-4766-5p组、毛蕊异黄酮+anti-miR-NC组以及毛蕊异黄酮+anti-miR-4766-5p组。
1.2.2 CCK-8实验: 细胞转染48 h后,收集各组HeLa细胞接种于96孔板(3×103个/孔)孵育一夜,随后与10 μL CCK-8溶液共孵育2 h。 最后,在450 nm波长处检测光密度(OD)值,并计算细胞增殖抑制率。
1.2.3 平板克隆形成实验: 将HeLa细胞以每孔500个的密度接种于6孔板上。允许菌落生长10~14 d。弃掉培养基,磷酸盐缓冲液(PBS)洗涤2次后,甲醇固定15 min, 随后结晶紫染色20 min, 最后计数阳性菌落的形成(>50个/菌落)。
1.2.4 流式细胞术: 收集各组HeLa细胞, PBS洗涤2次,并重悬于1 X Annexin V结合缓冲液中(5×105个/mL), 随后分别与5 μL Annexin V-FITC与5 μL PI避光染色15 min, 于1 h内使用流式细胞仪分析细胞凋亡。
1.2.5 实时荧光定量聚合酶链反应(qRT-PCR): 采用Trizol试剂提取总RNA, 反转录合成cDNA。随后以cDNA为模板,使用SYBR Green试剂盒或者Mir-X miRNA qRT-PCR TB Green® Kit进行qRT-PCR扩增。反应条件: 95 ℃预变性2 min, 95 ℃变性30 s, 59 ℃退火30 s, 72 ℃延伸30 s, 共40次循环。以U6为内参,反应结束后收集目的基因和内参的Ct值,通过2-△△Ct法计算miR-4766-5p 含量。
1.2.6 蛋白质免疫印迹(Western blot): 各组HeLa细胞与500 μL RIPA裂解液共孵育提取总蛋白,用8%~10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分解细胞总裂解物(大约40 μg), 转膜后用5%牛血清白蛋白封闭2 h。随后加入1∶1 000稀释的cleaved-caspase3(Cat#9664)、cleaved-caspase9 (Cat#20750)与1∶2 000稀释的GAPDH(Cat#92310)一抗, 4 ℃孵育过夜。TBST洗涤后与1∶3 000稀释的二抗室温孵育2 h。应用Quantity One软件对蛋白条带进行定量。
1.3 统计学分析
2 结 果
2.1 毛蕊异黄酮抑制HeLa细胞增殖
相较于未经毛蕊异黄酮处理的细胞,毛蕊异黄酮-低组、毛蕊异黄酮-中组、毛蕊异黄酮-高组中的HeLa细胞增殖抑制率上升,细胞克隆形成能力受抑制,且呈剂量依赖性,差异有统计学意义(P<0.05), 见表1。

表1 毛蕊异黄酮对宫颈癌HeLa细胞增殖的影响
2.2 毛蕊异黄酮促进HeLa细胞凋亡
相较于未经毛蕊异黄酮处理的细胞, HeLa细胞凋亡率以及cleaved-caspase3和cleaved-caspase9蛋白含量在毛蕊异黄酮-低组、毛蕊异黄酮-中组、毛蕊异黄酮-高组中上升,且呈剂量依赖性,差异有统计学意义(P<0.05), 见图1、表2。
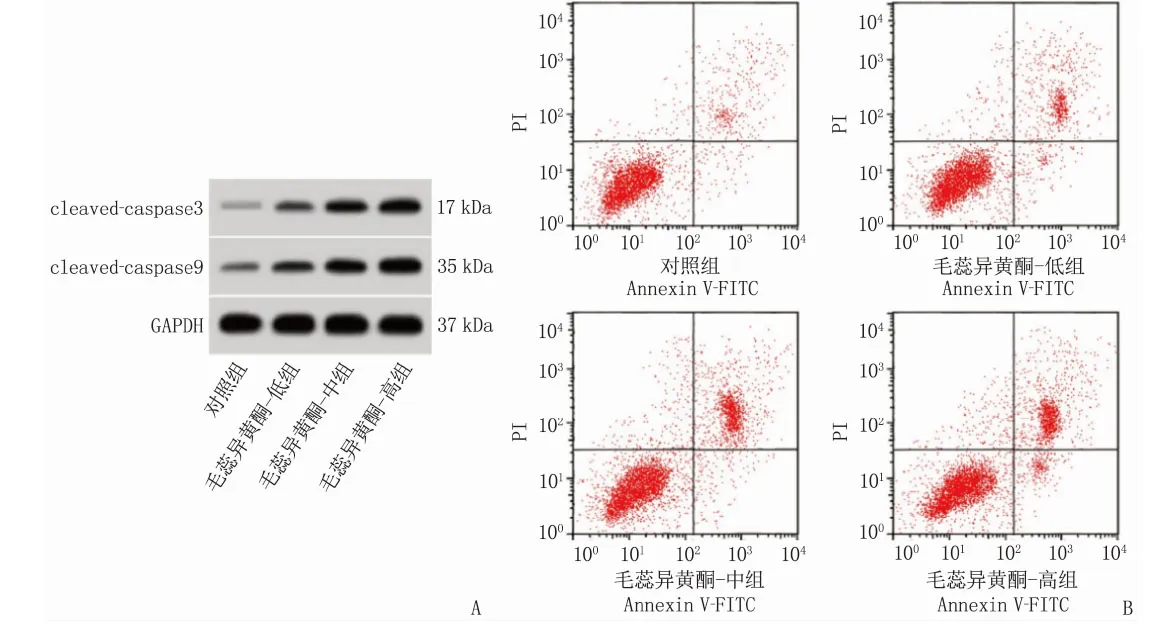
A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。图1 毛蕊异黄酮对宫颈癌HeLa细胞凋亡的影响

表2 毛蕊异黄酮对宫颈癌HeLa细胞凋亡的影响
2.3 宫颈癌组织中miR-4766-5p的表达
癌旁组织中miR-4766-5p表达量为(1.00±0.11), 宫颈癌组织中miR-4766-5p的表达量为(0.40±0.04)。宫颈癌组织中miR-4766-5p的表达量低于癌旁组织,差异有统计学意义(P<0.05)。
2.4 毛蕊异黄酮对宫颈癌HeLa细胞miR-4766-5p表达的影响
与对照组比较,毛蕊异黄酮-低组、毛蕊异黄酮-中组、毛蕊异黄酮-高组miR-4766-5p的表达量升高,且呈剂量依赖性,差异有统计学意义(P<0.05), 见表3。

表3 毛蕊异黄酮对宫颈癌HeLa细胞miR-4766-5p表达的影响
2.5 过表达miR-4766-5p促进HeLa细胞凋亡并抑制其增殖
相较于miR-NC组, miR-4766-5p组细胞增殖抑制率、凋亡率和cleaved-caspase3、cleaved-caspase9蛋白水平升高,克隆形成能力受到抑制,差异有统计学意义(P<0.05), 见图2、表4。
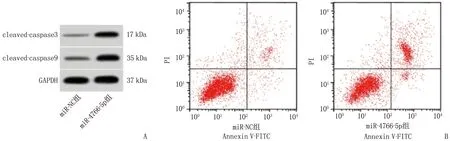
A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。图2 miR-4766-5p过表达对宫颈癌HeLa细胞凋亡的影响

表4 miR-4766-5p过表达对宫颈癌HeLa细胞增殖和凋亡的影响
2.6 干扰miR-4766-5p表达逆转了毛蕊异黄酮(100 μmol/L)对宫颈癌HeLa细胞的作用
相较于毛蕊异黄酮+anti-miR-NC组,毛蕊异黄酮+anti-miR-4766-5p组增殖抑制率、细胞凋亡率和cleaved-caspase3、cleaved-caspase9蛋白水平降低,细胞克隆形成能力增高,差异有统计学意义(P<0.05), 见图3、表5。
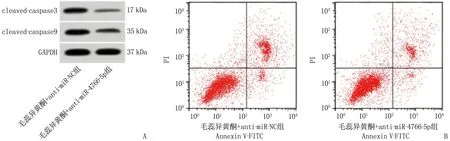
A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。

表5 干扰miR-4766-5p表达逆转了毛蕊异黄酮(100 μmol/L)对宫颈癌HeLa细胞增殖和凋亡的作用
3 讨 论
中医药可通过调控多种基因或信号通路而发挥抗宫颈癌的作用[9-11]。miRNA可通过靶向调控靶基因表达影响宫颈癌细胞生物学行为[12-13]。但miRNA是否介导中医药在宫颈癌中的治疗作用尚未可知。
毛蕊异黄酮是一种异黄酮类化合物,研究[14]表明,毛蕊异黄酮可抑制人黑色素瘤细胞增殖、迁移及侵袭。毛蕊异黄酮可通过抑制CyclinD1、基质金属蛋白酶2(MMP2)表达,进而破坏肺癌细胞的转移及增殖[15]。在乳腺癌中,毛蕊异黄酮通过抑制上皮间质转化(EMT)过程抑制癌细胞侵袭和迁移能力,还可抑制乳腺癌的生长[16-17]。毛蕊异黄酮可通过刺激氧化应激促进胃癌细胞凋亡,从而发挥抗癌症作用[18]。本研究中,毛蕊异黄酮能够显著抑制细胞增殖,刺激细胞凋亡,且呈剂量依赖性。此外, cleaved-caspase3和cleaved-caspase9的蛋白表达在宫颈癌细胞中随着毛蕊异黄酮浓度的升高而上调。Caspase负责细胞凋亡过程中的大部分蛋白质水解, cleaved-caspase3是检测细胞凋亡的可靠标志; caspase-9通过与凋亡蛋白酶激活因子-1结合而被激活,随后切割并激活下游Caspase-3和Caspase-7, 诱导caspase级联和细胞死亡程序,同时caspase-9伴随着自催化切割,在凋亡发生时cleaved-caspase9含量升高[19-20], 进一步提示毛蕊异黄酮促进宫颈癌细胞凋亡。
研究[7]证实, miR-4766-5p在多种癌症中发挥抑癌作用。例如, miR-4766-5p在胃癌组织和细胞中低表达,上调其表达可破坏癌细胞的增殖、迁移和侵袭。研究[21]表明, miR-4766-5p过表达可抑制胃癌细胞增殖。miR-4766-5p过表达可抑制食管癌进展[8]。同时, miR-4766-5p被发现可以减弱结直肠癌细胞的转移和增殖,该作用可能与circ_0000467/miR-4766-5p/KLF12通路有关[22]。因此,本研究推测miR-4766-5p在宫颈癌中也发挥抑癌作用。本研究结果显示, miR-4766-5p在宫颈癌组织和细胞中低表达,而在宫颈癌细胞中经毛蕊异黄酮处理后显著上调,提示miR-4766-5p可能参与毛蕊异黄酮的抗癌作用。随后本研究证实,在宫颈癌细胞中过表达miR-4766-5p, 癌细胞增殖受到抑制。进一步实验发现,干扰miR-4766-5p表达可减弱毛蕊异黄酮对宫颈癌细胞增殖的抑制作用,以及对细胞凋亡的促进作用,表明毛蕊异黄酮可通过促进miR-4766-5p表达,进而抑制宫颈癌发展进程。
综上所述,毛蕊异黄酮可通过上调miR-4766-5p表达,抑制宫颈癌细胞增殖,诱导细胞凋亡。毛蕊异黄酮或可作为治疗宫颈癌的药物,但其药效仍需进一步临床试验验证。本研究为毛蕊异黄酮联合miR-4766-5p靶向治疗宫颈癌提供了新的方向。

