人表皮生长因子受体2对卵巢癌细胞凋亡、侵袭的影响及机制研究
高玉霞, 何 乾, 李章欢, 刘 宇, 王文翔
(河南省新乡市中心医院/新乡医学院第四临床学院, 1. 妇瘤科, 2. 产科, 河南 新乡, 453000)
卵巢癌是女性常见的恶性肿瘤,全球每年约有15万名女性死于卵巢癌[1], 手术和铂类药物-紫杉烷联合化疗是卵巢癌的主要治疗手段。虽然一线治疗方案对卵巢癌的治疗有效率超过80%[2], 但卵巢癌患者的长期生存率仍较低[3], 故探寻卵巢癌的发病机制相关因子和靶向治疗新方法具有重要的临床意义。人表皮生长因子受体2(HER2)是酪氨酸激酶受体,能通过诱导细胞信号通路的激活而调控肿瘤细胞增殖、分化等多种生物学特性[4]。HER2的致癌潜力已在多种肿瘤中被证实,相关机制涉及在细胞膜上的过表达[5]。目前,抗HER2药物已被用于治疗HER2阳性乳腺癌和胃癌,且开发的药物数量正在逐渐增多[6]。HER2表达与卵巢癌复发率相关,HER2抑制剂能够抑制卵巢癌发展[7-8], 但HER2调控卵巢癌发展的分子机制仍有待研究。E74样ETS转录因子3(ELF3)是一种上皮特异性转录因子,参与不同的生物学进程,如增殖、迁移和各种上皮肿瘤的侵袭[9]。研究[10]表明,ELF3是卵巢癌细胞上皮-间充质转化的负调控因子。音猬因子(SHH)信号通路是一种进化保守的分子级联,其活性受SHH信号配体的调节,能激活参与细胞存活和增殖的基因的表达[11]。研究[12]表明,卵巢癌细胞迁移和侵袭受SHH信号通路的调控。本研究探讨HER2、ELF3和SHH信号通路对卵巢癌细胞凋亡、侵袭的影响,以期为HER2抑制剂在卵巢癌治疗中的应用提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
免疫组化试剂盒、5%牛血清白蛋白(BSA)封闭液、脱脂奶粉、4%多聚甲醛溶液购自福州飞净生物; 总RNA提取试剂、HiScript Ⅱ逆转录酶、细胞计数试剂盒8(CCK-8)、ExFect细胞转染试剂、细胞凋亡检测试剂盒、SYBRqPCR Master Mix试剂购自南京诺唯赞生物; 磷酸盐缓冲液、miRNA第一链合成试剂盒、蛋白质分子量标准、HER2小干扰RNA(si-HER2)、si-NC和定量引物(表1)购自大连宝日医生物技术; 聚碳酸酯膜购自北京索莱宝生物; HER2一抗抗体(货号MA5-13105)、Ki67一抗抗体(货号MA5-15690)、ELF3一抗抗体(货号PA5-89261)、SHH一抗抗体(货号MA5-14909)、GLIS家族锌指蛋白1(GLI1)一抗抗体(货号PA5-47478)、GAPDH一抗抗体(货号MA1-16757)、ELF3过表达载体(ELF3)、pcDNA3.1(+)载体(pcDNA)由美国Thermo Fisher公司提供; 卵巢癌细胞(A2780细胞和SKOV3细胞)、卵巢上皮细胞HOSEpiC、RPMI-1640和McCoy′s 5A培养基由上海酶研生物提供。

表1 引物序列
1.2 实验方法
1.2.1 组织样本收集: 收集在本院接受治疗的27例卵巢癌患者的27对卵巢癌组织和癌旁组织,储存于液氮中。本研究经医院伦理委员会审核批准,卵巢癌患者术前未接受化疗或放疗,且术前均提供书面知情同意书。
1.2.2 细胞培养和转染: 将HOSEpiC细胞和A2780细胞培养于添加RPMI-1640培养基的培养皿中,将SKOV3细胞培养于McCoy′s 5A培养基中。向相应培养基中添加10%胎牛血清和1%青霉素-链霉素,将细胞培养于37 ℃、5%CO2培养箱中。A2780细胞和SKOV3细胞汇合度达到95%左右时用胰酶消化,并按照实验所需孔数铺至24孔板。过夜培养后,向离心管中添加无血清培养基和ExFect转染试剂,向另一离心管中添加无血清培养基和寡聚核苷酸(si-NC、si-HER2)、质粒(pcDNA、ELF3)。用移液枪将混合液混合均匀后,将2个离心管中的混合液混合,室温静置20 min后加到培养孔中与细胞孵育6 h, 将培养基更换为新鲜的培养基,继续培养48 h, 收集细胞用于后续实验。
1.2.3 免疫组织化学法: 将石蜡包埋的卵巢癌组织和癌旁组织切成4 mm薄片, 60 ℃加热20 min后用酒精水化。将浸泡在柠檬酸缓冲液中的切片80 ℃加热20 min后与过氧化氢孵育10 min。将切片和HER2及Ki67抗体孵育,根据免疫组化试剂盒说明书将切片用苏木精染色,随后脱水,封片,最后用显微镜观察HER2或Ki67阳性细胞。
1.2.4HER2mRNA和ELF3mRNA表达分析: 利用总RNA提取试剂从收集的组织样本和细胞中分离总RNA, 根据HiScript Ⅱ逆转录酶和miRNA第一链合成试剂盒的说明书进行反转录。随后,将cDNA、引物和SYBR qPCR Master Mix试剂混合均匀,采用实时定量聚合酶链反应(qRT-PCR)法定量检测HER2mRNA和ELF3mRNA的表达,利用2-△△Ct法分析数据。
1.2.5 蛋白表达分析: 采用蛋白免疫印迹法检测蛋白表达水平。提取细胞总蛋白,用BCA蛋白实验试剂定量蛋白浓度后,将样品和蛋白质分子量标准分别加入到电泳孔中。蛋白条带分离后转移到PVDF膜上,将膜和5%BSA封闭液孵育,随后与HER2、Ki67、ELF3、SHH、GLI1和GAPDH一抗抗体孵育。最终用化学发光试剂曝光蛋白条带。
1.2.6 细胞活力检测: 转染48 h后,将A2780细胞和SKOV3细胞接种至96孔板,在培养箱中培养后,依据CCK-8说明书将CCK-8试剂加到每个培养孔中,最后使用酶标仪分析样品。
1.2.7 细胞凋亡检测: A2780细胞和SKOV3细胞转染48 h后,使用细胞凋亡检测试剂盒分析细胞凋亡率。将细胞悬浮在结合缓冲液中,随后与Annexin V-FITC、碘化丙啶避光孵育。最后,将细胞置于流式细胞仪中进行检测。
1.2.8 Transwell小室实验: A2780细胞和SKOV3细胞转染48 h后,将细胞悬液加至涂有聚碳酸酯膜的小室的上室,在每个Transwell小室的下室添加相应的含15%血清的培养基。24 h后,用4%多聚甲醛溶液固定侵袭到小室的细胞,用磷酸盐缓冲液清洗后在显微镜下观察侵袭细胞数。
1.2.9 免疫沉淀实验: 收集A2780细胞和SKOV3细胞,用裂解液裂解,取一部分裂解液用做input对照,剩余部分的裂解液与IgG抗体或HER2抗体包被的磁珠4 ℃孵育过夜,随后将两部分裂解液于沸水浴中孵育10 min, 进行蛋白免疫印迹法检测。
1.2.10 HER2与ELF3的关系分析: 基于Genemania网站预测HER2与ELF3的关系,基于Gepia数据库分析ELF3在卵巢癌组织和正常组织中的表达,基于Kaplan-Meier Plotter网站分析ELF3与卵巢癌患者生存率的相关性,通过免疫沉淀实验鉴定HER2与ELF3的关系。
1.3 统计学分析

2 结 果
2.1 Ki67、HER2在不同组织中的表达和HER2在不同细胞中的表达
免疫组织化学法检测结果显示,与癌旁组织中相比, Ki67、HER2蛋白在卵巢癌组织中的阳性表达率均更高,见图1A。HER2mRNA在卵巢癌组织中的表达高于癌旁组织,差异有统计学意义(P<0.05), 见图1B。HER2蛋白在卵巢癌细胞(A2780细胞、SKOV3细胞)中的表达均高于卵巢上皮细胞HOSEPiC, 差异有统计学意义(P<0.05), 见图1C。

A: Ki67、HER2在卵巢癌组织和癌旁组织中的阳性表达(放大200倍); B: HER2 mRNA在卵巢癌组织和癌旁组织中的相对表达量(两者比较, ∗∗∗∗P<0.000 1); C: HER2蛋白在卵巢癌细胞和卵巢上皮细胞中的相对表达量(与HOSEPiC比较, ∗∗∗P<0.001)。图1 Ki67、HER2在不同组织中的表达和HER2在不同细胞中的表达
2.2 沉默HER2对A2780、SKOV3细胞凋亡、侵袭的影响
A2780、SKOV3细胞中,转染si-HER2的细胞HER2蛋白表达水平均低于转染si-NC的细胞,差异有统计学意义(P<0.05), 见图2A。A2780、SKOV3细胞中,与转染si-NC的细胞相比,转染si-HER2的细胞均活力降低、细胞凋亡率增加、侵袭细胞数减少,差异有统计学意义(P<0.05), 见图2B~图2D。

A: HER2蛋白相对表达量; B: 细胞活力检测结果; C: 细胞凋亡检测结果; D: 细胞侵袭检测结果(放大100倍)。与si-NC比较, ∗∗P<0.01, ∗∗∗P<0.001, ∗∗∗∗P<0.000 1。图2 沉默HER2对A2780、SKOV3细胞凋亡、侵袭的影响
2.3 HER2与ELF3的关系分析
Genemania在线数据库预测结果显示, HER2可能与ELF3存在相互作用关系,见图3A。Gepia数据库分析结果显示,ELF3mRNA在卵巢癌组织中的表达高于正常组织,差异有统计学意义(P<0.05), 见图3B。ELF3高表达的卵巢癌患者的生存率低于ELF3低表达的卵巢癌患者,差异有统计学意义(P<0.05), 见图3C。A2780、SKOV3细胞中,转染si-HER2的细胞ELF3蛋白表达水平均低于转染si-NC的细胞,差异有统计学意义(P<0.05), 见图3D。免疫沉淀实验结果显示,HER2和ELF3蛋白富集于HER2抗体组和input组,IgG抗体组中检测不到HER2和ELF3蛋白,见图3E。
2.4 ELF3过表达逆转了沉默HER2对A2780和SKOV3细胞凋亡和侵袭的影响
A2780、SKOV3细胞中,转染si-HER2的细胞ELF3mRNA表达均低于转染si-NC的细胞,且转染si-HER2+ELF3的细胞ELF3mRNA表达均高于转染si-HER2+pcDNA的细胞,差异有统计学意义(P<0.05), 见图4A。A2780、SKOV3细胞中,与转染si-NC的细胞相比,转染si-HER2的细胞活力降低、细胞凋亡率增加、侵袭细胞数减少,差异有统计学意义(P<0.05); 与转染si-HER2+pcDNA的细胞相比,转染si-HER2+ELF3的细胞活力增加、细胞凋亡率降低、侵袭细胞数增加,差异有统计学意义(P<0.05), 见图4B~图4D。
2.5 HER2对ELF3/SHH通路的调控作用
蛋白免疫印迹法检测结果显示,在A2780、SKOV3细胞中,转染si-HER2的细胞SHH、GLI1蛋白表达均低于转染si-NC的细胞,差异有统计学意义(P<0.05), 但转染si-HER2+ELF3的细胞SHH、GLI1蛋白表达均高于转染si-HER2+pcDNA的细胞,差异有统计学意义(P<0.05), 见图5。
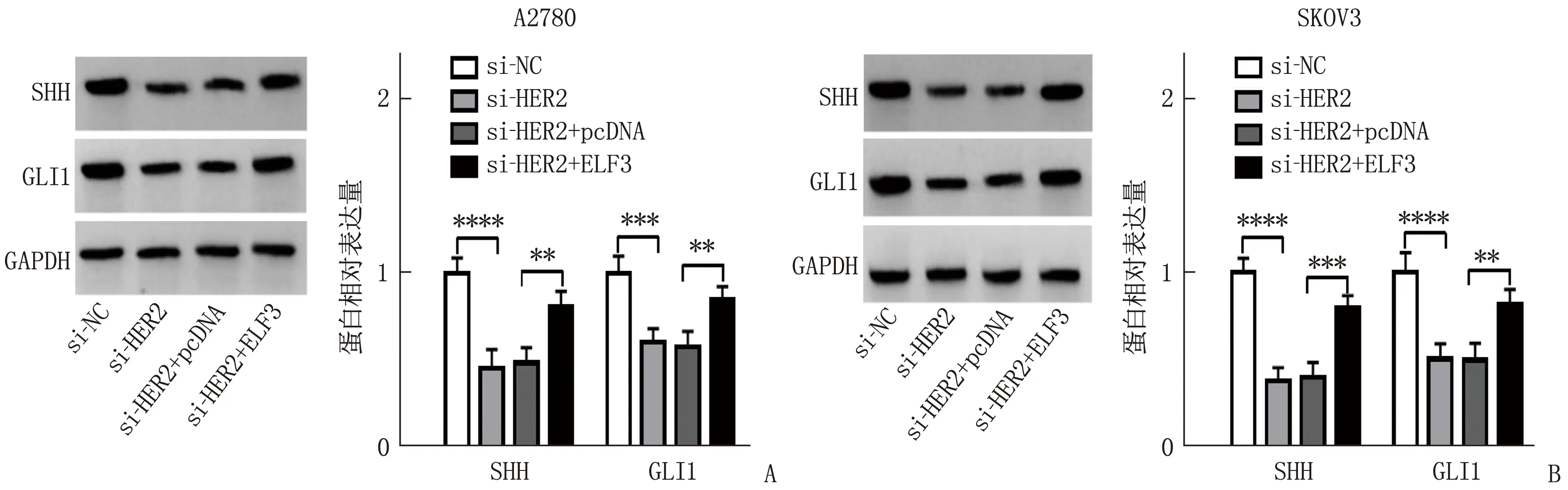
A: A2780细胞中SHH和GLI1蛋白相对表达量; B: SKOV3细胞中SHH和GLI1蛋白相对表达量。两者比较, ∗∗P<0.01, ∗∗∗P<0.001, ∗∗∗∗P<0.000 1。图5 HER2对ELF3/SHH通路的调控作用
3 讨 论
HER2是一种跨膜酪氨酸激酶蛋白,主要通过与表皮生长因子受体家族成员形成二聚体或通过与ECD蛋白作用而活化[13], 可通过抑制肿瘤细胞凋亡而促进肿瘤细胞生长。研究[14]表明, HER2蛋白能够通过增强血管生成能力而促进肿瘤细胞侵袭,进而影响肿瘤发展。HER2基因异常表达与肿瘤的致瘤转化及发展密切相关。HER2低表达可限制卵巢癌生长, HER2过表达能够增强紫杉烷在卵巢癌中的抵抗性[15-16], 但其调控卵巢癌的机制还有待研究。本研究发现, HER2在卵巢癌组织和卵巢癌细胞中显著高表达。Ki67是一种增殖标志蛋白,主要存在于G1期的核周区,通过使染色体与有丝分裂纺锤体相互作用而发挥作用,能够反映肿瘤增殖情况[17]。本研究分析了Ki67在卵巢癌组织和癌旁组织中的表达情况,发现Ki67在卵巢癌组织中高表达。本研究还发现, HER2低表达可抑制卵巢癌细胞活力和侵袭能力,并促进卵巢癌细胞凋亡,表明HER2可能促进卵巢癌发展。
ELF3是一种上皮细胞特异性转录因子,可调控肿瘤细胞增殖、迁移以及上皮-间充质转化等多种生物学进程[18-19]。研究[20]表明, ELF3异常高表达可通过介导哺乳动物雷帕霉素靶蛋白(mTOR)促进卵巢癌发展,且能增强卵巢癌细胞对顺铂的耐药性。此外, ELF3能通过抑制微小RNA-485-5p(miR-485-5p)的转录而增强卵巢癌细胞的转移能力[21]。KAR A等[22]研究结果提示, ELF3表达水平与HER2阳性的肿瘤患者预后有关。本研究分析了HER2对卵巢癌细胞表型的调控作用是否与ELF3有关, Genemania在线数据库预测结果显示HER2可能结合ELF3, Gepia数据库分析结果显示ELF3在卵巢癌组织中高表达, Kaplan-Meier Plotter网站显示ELF3与卵巢癌患者预后有关,蛋白免疫印迹实验和免疫沉淀实验证实HER2能够结合ELF3。本研究还发现, ELF3过表达可逆转HER2低表达对卵巢癌细胞凋亡和侵袭的影响。由此说明, HER2能够通过调控ELF3介导卵巢癌细胞恶性生长。SHH信号通路在卵巢癌的发展中具有重要作用[23]。本研究分析了SHH信号通路是否参与HER2和ELF3对卵巢癌细胞凋亡、侵袭的调控,发现卵巢癌细胞转染ELF3过表达质粒后,HER2敲低对SHH信号通路相关蛋白(SHH和GLI1蛋白)表达的抑制作用得到缓解。既往研究[11]显示, SHH信号通路能够通过促进基质金属蛋白酶7的表达以及调控抗凋亡蛋白(含杆状病毒IAP重复蛋白5)而介导卵巢癌的发展。由此提示, HER2通过激活ELF3/SHH通路调节卵巢癌细胞凋亡和侵袭。
综上所述, HER2沉默通过调控ELF3/SHH通路促进卵巢癌细胞凋亡和抑制卵巢癌细胞侵袭,靶向抑制HER2或可成为卵巢癌的一种有效治疗策略。但本研究纳入的组织样本量较少,且未开展体内实验对体外实验结果进行验证,未来还需进一步深入研究加以证实。

