SLE患者血清外泌体环状RNA的差异表达分析*
徐 莹,周 茹,张欣洲,马华林**
(1.暨南大学第二临床医学院/南方科技大学第一附属医院/深圳市人民医院血液内科,广东 深圳 518020;2.暨南大学第二临床医学院/南方科技大学第一附属医院/深圳市人民医院肾内科/深圳市肾脏病重点实验室)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种弥漫性结缔组织疾病,其特征是典型的自身免疫介导的炎症。尽管使用免疫抑制和新疗法后,SLE患者10年生存率有所提高,但仍有部分患者因活动性疾病和内部器官严重受损而死亡[1]。
外泌体广泛存在于外周血、尿液、脑脊液和其他体液中[2-4]。因此,我们可以检测组织、细胞和体液中的外泌体及其含量。该特征对于疾病尤其是肾脏疾病的诊断和临床治疗很重要。许多研究表明circRNA可用于多种疾病的诊断和疗效评估的生物标志物[5-7]。
本研究以外泌体circRNA为切入点,对SLE患者和正常人群血清外泌体中circRNA的表达情况进行比较,为探究SLE可能的发病机制及诊断和治疗提供理论基础。
1 资料与方法
1.1 一般资料
收集我院风湿免疫科10例女性SLE患者为SLE组,10例来自体检的女性健康志愿者作为正常对照组(NC组),SLE组年龄19~52岁,平均(34.2±1.3)岁;NC组年龄20~54岁,平均(33.6±1.5)岁,两组在性别、年龄等均无差异(P>0.05),SLE组患者均未使用激素和免疫抑制剂。研究方案经暨南大学第二临床医学院(深圳市人民医院)伦理委员会批准,所有参与对象均签署知情同意书。
1.2 血清标本收集
两组抽血前一晚22:00后禁食禁水。采血后3 000rpm离心约10min,吸取上层清液保存于-80℃冰箱备用。
1.3 外泌体分离提取
根据试剂说明书,使用ExoQuick试剂沉淀试剂盒(SBI公司,美国)分离血清中外泌体,分离后将外泌体储存于-80°C备用。
1.4 血清Exosome circ RNA测序
血清Exosome circ RNA测序详见图1,测序由广州永诺生物科技有限公司完成。提取样品总RNA并使用DNase I消化DNA后去除rRNA,富集环状RNA。将环状RNA片段化后用随机引物进行逆转录合成第一链cDNA,接着使用含有dUTP的dNTP合成第二链cDNA。使用磁珠对PCR富集的文库进行片段筛选,质控合格后上机测序。QC1:检测总RNA浓度、纯度、完整性;QC2:证实99%以上的rRNA都已被去除;QC3:证实RNA被打断成200bp左右的片段;QC4:检测文库的质量浓度、片段大小、摩尔浓度。
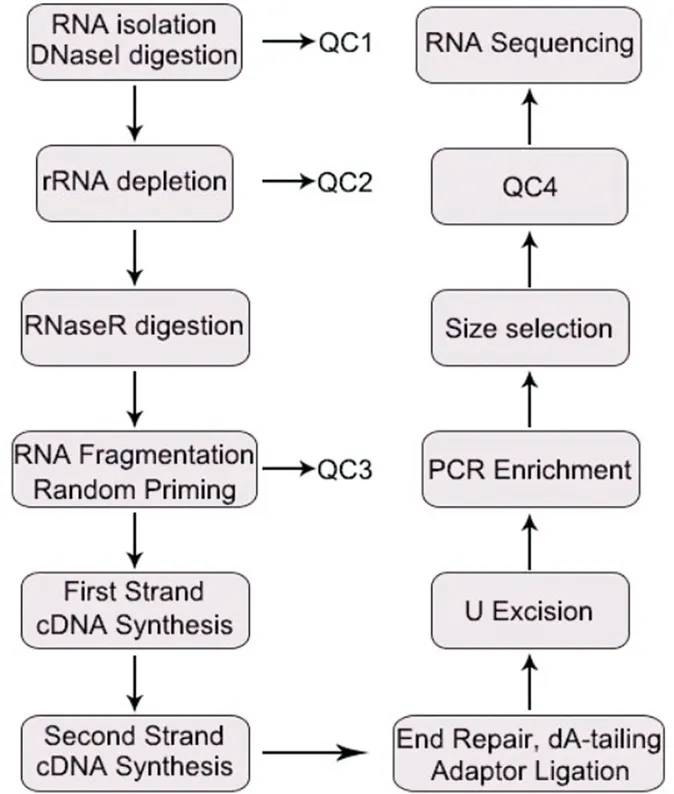
图1 circ RNA基因测序主要实验过程
1.5 生物信息学分析
基因本体(Gene Ontology,GO)分析和pathway分析参照我们以前描述的方法[8]。
1.5.1 GO分析
GO数据库包含了基因参与的生物过程、所处的细胞位置、发挥的分子功能三方面功能信息,并将粗细不同的功能概念组织成DAG(有向无环图)的结构。利用GO的知识体系和结构特点,旨在发掘与基因差异表达现象关联的单个特征基因功能类或多个特征功能类的组合。我们将基因功能分为biological process、cellular component、molecular function共3个大类别。
1.5.2 Pathway分析
与GO分析类似,我们同样将差异基因使用GenMAPP v2.1向KEGG pathway数据库映射,并对代谢通路做统计检验,P<0.05为标准。
2 结 果
2.1 Total RNA质检和浓度测定结果
RNA提取和纯化后,运用Qubit3.0荧光计对两组的总RNA进行浓度和纯度检测,结果见表1。
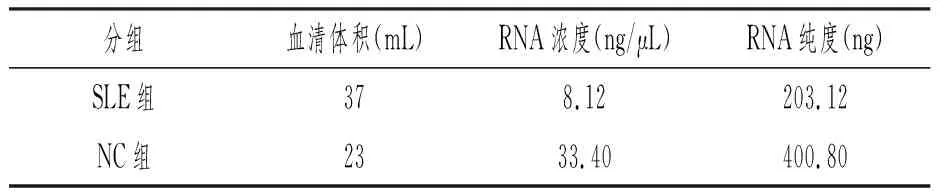
表1 SLE组和NC组血清外泌体总 RNA 浓度
2.2 circRNA的种类及来源
SLE患者血清外泌体中circRNA的种类较对照组有所减少,来源主要为内含子,见表2。
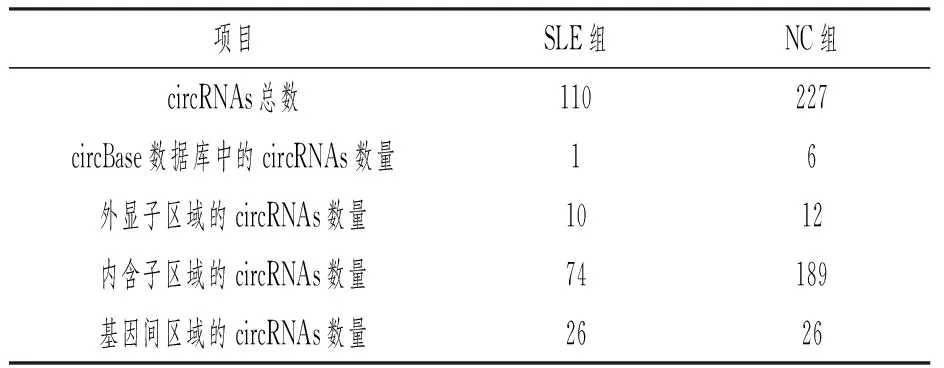
表2 SLE 和NC组血清和尿液中的外泌体 circRNA 种类
2.3 SLE患者和NC患者血清外泌体中circRNA的差异表达
在SLE患者和对照组的血清外泌体间,有121种circRNA物种表现出明显不同。其中,上调有54种 (见表3),下调有67种(见表4)。这些circRNA大多来自内含子。相应的基因包括snoU13、SNORA31、SNORA51、SNORD112和其他核小RNA。在表达上调的circRNA中,chrY:13651007 | 13860076的log2Ratio为27.729,差异最显著;在表达下调的circRNA中,chr2:233244474 | 233272478的log2Ratio为-27.111,差异最显著,对应的基因为snoU13。该基因主要表达为核仁小RNA,并在RNA处理和修饰中起作用。
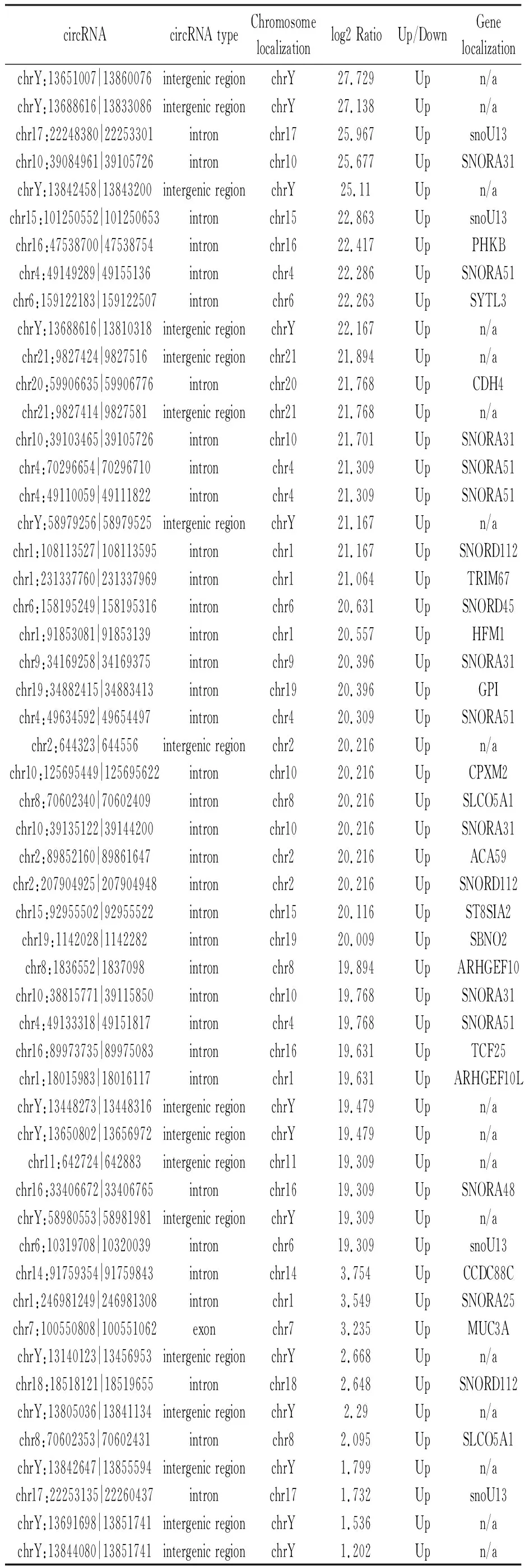
表3 SLE组和NC组比较血清中显著上调的circRNAs
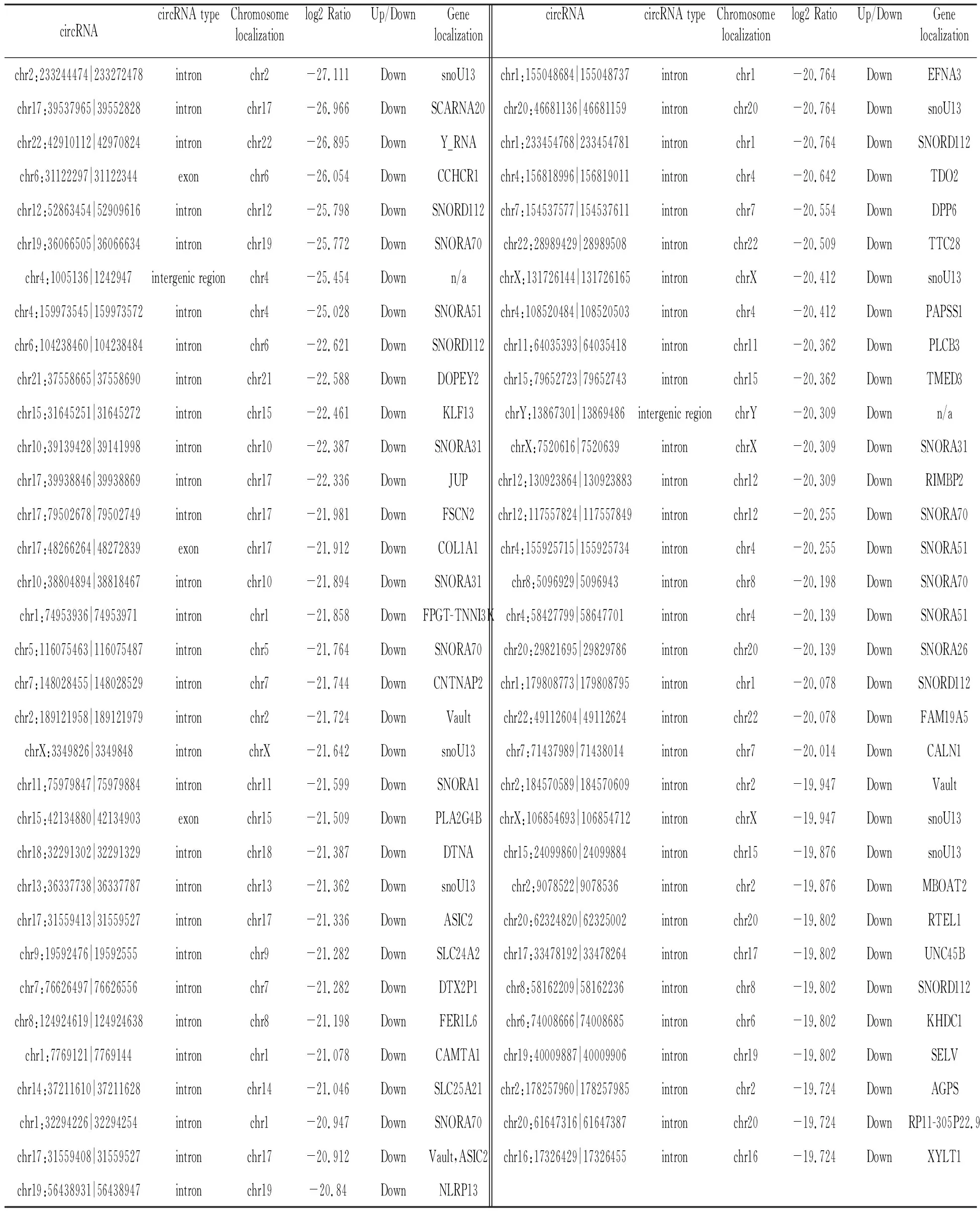
表4 SLE组和NC组比较血清中显著下调的circRNAs
2.4 生物信息学分析
使用GO和KEGG途径分析靶基因的潜在功能。 GO分析表明,靶基因与血清外泌体中的细胞进程,多细胞有机体、色素沉着,发育过程以及对刺激的反应有关(图2)。 此外,对于评估的circRNA,获得了包含靶基因的显著相关途径。我们将差异基因使用GenMAPP v2.1向KEGG pathway数据库映射,并对代谢通路做统计检验,根据P<0.05为标准。结果共筛选到29条代谢通路,其中我们列出前20条途径(图3)。其中Platelet activation信号通路是SLE发病机理中的重要信号通路(图4)。
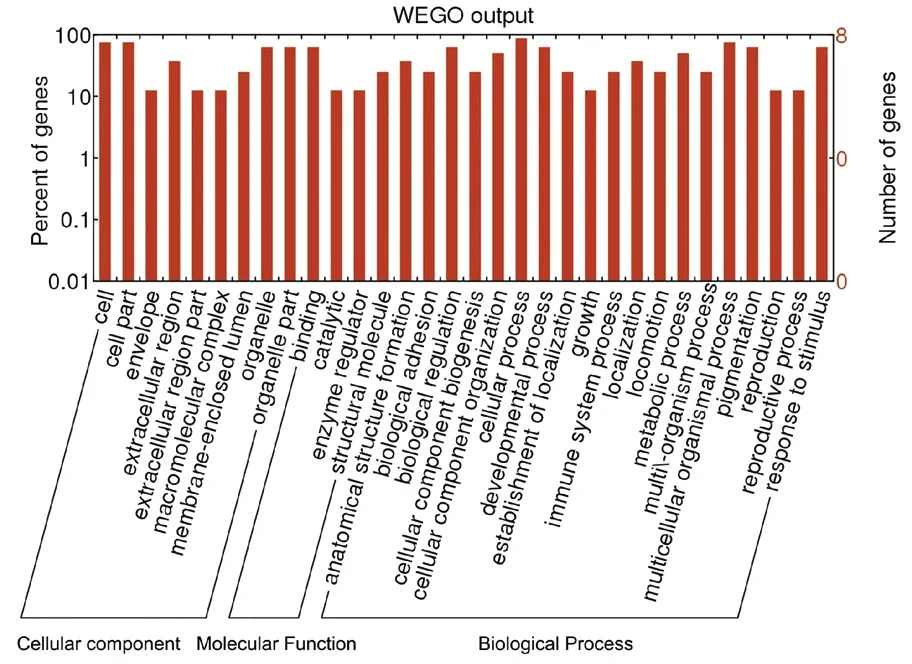
图2 SLE患者与对照组血清外泌体相比差异表达circRNA的GO注释(包括生物过程、细胞成分和分子功能)
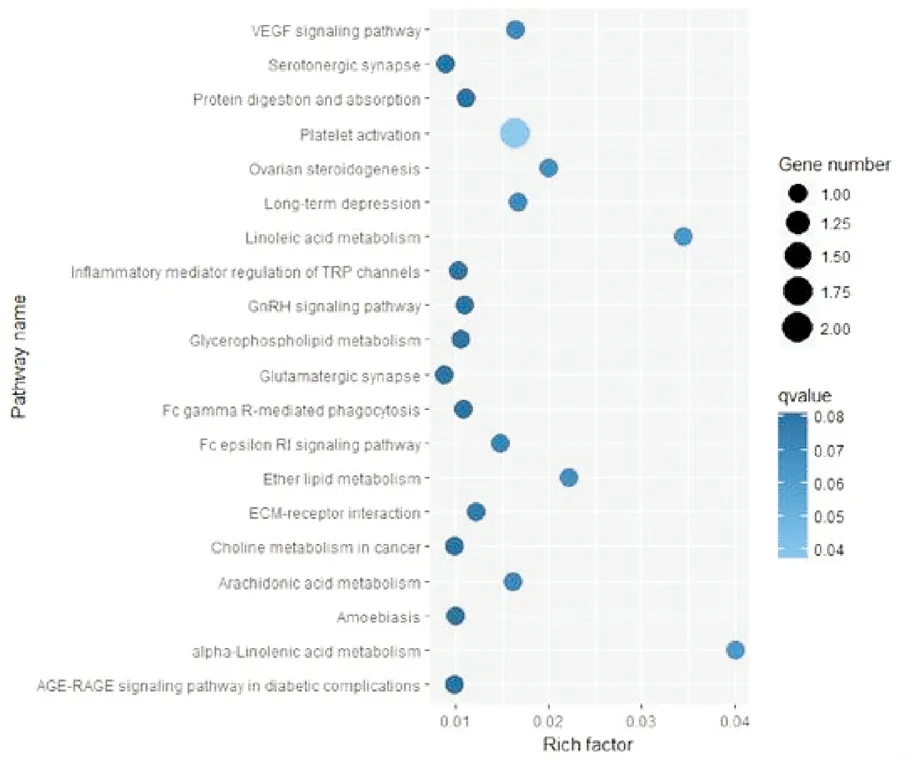
图3 SLE患者与对照组比较血清外泌体中差异表达circRNAs预测靶点KEGG通路分析(圆圈的蓝色越深,通路富集越显著;圆圈越大,通路的基因数量越多)
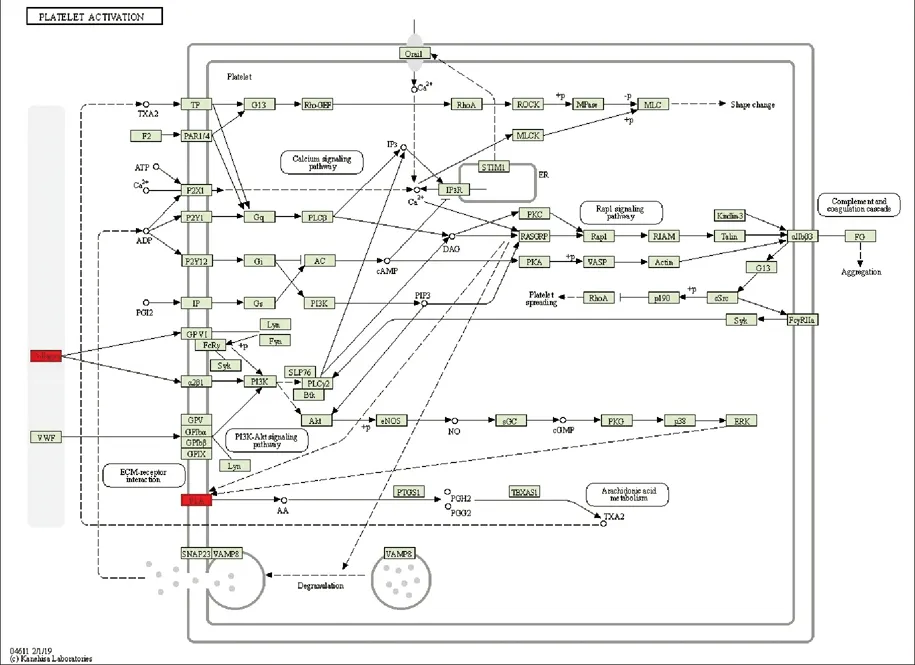
图4 Platelet activation信号通路(红色标记表示具有差异表达的基因)
3 讨 论
由于circRNA的高度稳定性,可以从体液中轻松获得circRNA,circRNA可以用作临床疾病诊断,治疗效果和药敏分析的生物标志物[5]。近来研究表明:一些circRNA充当竞争性内源RNA并参与基因表达调控[9]。在该研究中,我们从差异表达的circRNA对应基因包括SNORA31,SNORA51,SCARNA20,SNORA70,SNORD112和其他小核仁RNA(snoRNA),主要为内含子来源的circRNA。更多的研究表明,snoRNA可以进一步加工形成较短的RNA片段,而这些短片段snoRNA具有microRNA样功能。这一发现表明snoRNA可以作为microRNA的前体[10]。一些研究[11-12]证明,不同基因来源的circRNA存在于细胞的不同部位,并表现出不同的功能。我们在本研究中获得的circRNA相应基因主要来自编码snoRNA的内含子。
研究表明[13],核苷酸序列的snoRNA可以通过转录后水平的碱基互补配对与mRNA特定碱基序列配对,从而调节基因表达。这一发现与以下事实相吻合:内含子衍生的circRNA在转录水平上增强基因表达并在基因调控中发挥作用。 circRNA通过转录前后对mRNA的切割和修饰在mRNA水平上调节基因表达[12]。此外,仅在细胞应激反应的早期阶段才能检测到snoRNA的存在。不可否认,患者在SLE的发生和发展中会受到感染、创伤、缺氧和其他压力。提示相应的表达circRNA的特异性snoRNAs,如:snoU13、SNORA31 和 SCARNA20等可以作为SLE早期肾脏损伤的特异性标志物。
Platelet activation信号通路在多种类型的哺乳动物细胞中具有重要的功能。我们的结果表明,Platelet activation信号通路在SLE患者的血清外泌体中异常激活,为研究SLE发病机理和探索新疗法提供了实验基础。我们认为,参与调节该信号通路的干预措施可能是治疗SLE和相关疾病的有效手段。
总之,我们揭示了SLE患者血清外泌体中存在circRNA的异常表达,这些异常表达的circRNA可能参与SLE发病,为SLE的诊断、治疗和预后提供新的理论基础。
——外泌体与老年慢性疾病相关性的研究进展

