纳米泡在诊疗领域中的研究进展*
何 流,谭 洁,罗斌华
(湖北科技学院医学部药学院,湖北 咸宁 437100)
超声成像具有无创、高灵敏度和安全等优点,是临床上应用最广泛的成像方法之一,其原理是病变组织与正常组织存在声阻抗差异,检测这种差异就能识别病变的区域范围[1]。为了改善成像效果,常需要加入超声造影剂。目前临床上使用的超声造影剂主要是粒径1~8μm的微泡,它是由生物相容性材料包载惰性气体(如氮气、二氧化碳及氟碳烷烃等)组成,可实现心血管系统的造影成像,具有成像分辨率高的特点;然而,由于其粒径太大无法透过血管壁进入血管外组织,因而限制了它的临床应用[2]。
纳米泡是指粒径处于纳米范围内的超声造影剂。当粒径小于700nm时,由于高渗透性长滞留效应(enhanced permeability and retention,EPR)[3],纳米泡有可能穿透肿瘤的血管壁间隙,从而实现血管外组织的成像。制备纳米泡所用的气体,早期是用空气或者氧气等,但是这些气体在体内的稳定性较差,需要现配现用,且制备成纳米泡后图像的对比度较差[4];后来采用氟碳烷烃类(如全氟戊烷、全氟丙烷及全氟丁烷等),它显著提高了成像的对比度,且成像时间长,具有良好的体内外稳定性。制备纳米泡所用的生物相容性材料主要包括天然高分子材料(如磷脂、胆固醇等)与合成高分子材料(如聚乳酸、聚乙二醇、聚丙烯酸及聚乳酸-羟基乙酸共聚物等),这些材料不会产生溶血效应,具有无毒或者低毒等优点。纳米泡除了作为超声造影剂,增强成像效果外,亦可以作为核磁共振成像的造影剂、药物递送系统的载体,并具有开放血脑屏障的作用[5],下文将分别介绍纳米泡在这几个方面的研究进展。
1 超声成像
当超声波照射至体内时,由于人体组织的不均匀性,所以会发射一定强度的散射波。当超声探头检测到背向散射的信号时,就会产生待测物体的轮廓图像—即超声成像。然而当体内的散射信号强度较低,导致所产生的图像对比度较差时,必须使用超声造影剂来提高成像的对比度[6]。
目前研究的纳米泡超声造影剂主要包载氟碳烷烃类化合物,其成像对比度和体内稳定性均优于氮气、二氧化碳、空气和氧气等[7]。首先,纳米泡能够实现心血管系统成像,成像分辨率满足临床需求。李攀等[8]制备了包载全氟丙烷的脂质纳米泡,其平均粒径是650nm;纳米泡贮存三个月,粒径无明显变化,表明该纳米泡具有较好的稳定性;耳缘静脉注射纳米泡后,兔子的肝脏超声成像效果明显增强。其次,纳米泡的粒径比肿瘤血管内皮细胞间的间隙小,使得纳米泡可以穿透肿瘤血管实现血管外组织成像,而且可以在纳米泡的表面进行靶向修饰,实现主动靶向成像。如范校周[9]在纳米泡上接枝针对前列腺癌的特异性配体后,不仅可以穿过肿瘤血管壁,而且还能与前列腺肿瘤细胞特异性结合,与未靶向修饰的纳米泡相比,其成像效果更好;李春芳[10]则利用超声波法制备了包载全氟丙烷的纳米泡,并通过正负电荷吸引的原理,在纳米泡的表面连接抗血管内皮生长因子的抗体(抗VEGF抗体),研究表明,该纳米泡的粒径在100~600nm范围内,通过EPR效应,透过裸鼠皮下瘤血管内皮间隙,在肿瘤组织中聚集,提高了皮下瘤成像的对比度。
然而,纳米泡作为造影剂还需要从以下几方面进行改善。首先,纳米泡的粒度分布显著影响血管外成像效果。PDI(多分散系数)是评价粒度分布的重要指标,PDI越小,粒径越均一,成像效果越稳定。由于在纳米泡的制备过程中PDI的重现性较差,同时在贮存期间会发生纳米粒子的聚集沉淀,可能使得纳米泡无法穿透肿瘤血管实现血管外成像,所以改善纳米泡粒径的均一性与稳定性是亟待解决的问题。其次,目前临床上使用的超声造影剂主要是微泡,鲜有纳米泡产品上市,表明将纳米泡从实验室制备转向工业化生产仍然面临着巨大的挑战,是众多科技工作者与工程技术人员合作并深入研究的课题[11]。
2 药物递送系统
纳米泡递送系统涉及EPR效应、空化效应和声孔效应,使得药物和氟碳烷烃可以精准地、长时间地作用于靶组织,不仅提高了治疗效果,减少药物的毒副作用,也改善了成像质量。另外,在纳米泡的表面进行特殊的靶向修饰(如连接配体、官能团等),便可进一步提高药物的递送效率[12]。
纳米泡在外界超声波的作用下,会发生两种情况:当施加的超声波强度较小时,纳米泡会发生有规律的收缩(正压)和膨胀(负压),并作用于血管内壁使其内皮细胞间的空隙增大,使药物进入肿瘤细胞内或者细胞间隙,这是非惰性空化;当施加的超声波强度达到一定阈值时,纳米泡就会发生破裂,分裂成粒径更小、数量更多的纳米泡碎片粒子,这是瞬态空化效应(图1)[11],同时,在瞬态空化效应产生的热能、化学能、机械能等的作用下,细胞膜的通透性显著增加,为纳米泡释放的药物提供通道,这样药物更容易透过血管内皮细胞间的间隙而滞留于肿瘤组织中,从而实现EPR效应[13]。Guo等[14]利用酯化反应将FH多肽偶联到包载阿霉素的脂质纳米泡表面,制成多肽-纳米泡复合物,在外界超声波的作用下,该多肽-纳米泡发生瞬态空化效应,药物释放量显著增大,释放的阿霉素被肿瘤细胞吸收,且吸收取决于暴露时间和超声强度;同时,还发现该纳米泡经过超声作用后,在肿瘤中观察到药物浓度显著增加,从而有更强的肿瘤抑制作用。然而,该纳米泡的载药量偏低,从而限制了其抗肿瘤的能力,如何提高载药量就是一个亟待解决的问题。

图1 纳米泡的瞬态空化和非惰性空化
药物与纳米泡之间的结合方式是影响载药量的重要因素之一。因为纳米泡的内核有大量的氟碳烷烃,占据了较大的空间,导致核内药物的载药量偏低(图2)[15]。文献报道[16],以两亲性的药物为载体材料,通过特殊的制剂技术,制备出包载氟碳烷烃的新型载药纳米泡,药物的缓释特性与载药量皆得到改善,同时也可以实现两种药物的协同治疗效果。Liang等[17]将亲水性的喜树碱与疏水性的氟尿苷通过酯键相互连接,合成两亲性药物,随后包载全氟丙烷,实验证明,该药物递送系统的稳定性良好,载药量为56.7%。喜树碱与氟尿苷分子都具有一定的抗癌效果,但是它们对于肝、肾以及泌尿系统都有毒性,而制成纳米泡后不仅可以使药物聚集于靶位,减少其毒副作用,还可以通过体内酸性条件的水解实现协同给药,增强抗肿瘤效果并减少耐药性。

图2 药物递送系统
但是,很多易发生水解、光解和氧化等反应的药物可能就不太适合采用上述工艺进行包载,以免药物发生降解,所以,应该针对不同药物的性质筛选出合适的处方与工艺以提高纳米泡的包封率和载药量。另外,辅料的毒性也宜做长期、系统性的研究,有助于进一步降低制剂的毒副作用,例如:十二烷基硫酸钠(SDS)作为乳化剂能够改善纳米泡载药微粒的分散性,亦作为增溶剂能够提高包封率和载药量,但是SDS具有溶血效应,长期服用可能会使人体产生不良反应,所以,其加入量必须根据试验结果来决定[18]。
3 开放血脑屏障
血脑屏障是由脑和脊髓的毛细血管内皮组成的屏障,可阻止有害成分进入大脑。而正常的脂溶性小分子物质(如神经营养因子、神经营养肽、细胞因子等),则易于通过血脑屏障[19]。
血脑屏障虽然保护了中枢神经系统不受外界环境的干扰,但是当大脑出现疾病需要治疗时,药物却因为无法透过血脑屏障而不能完全发挥治疗作用[20]。通过对药物的结构进行改性,使其可以进入血脑屏障,例如多肽性药物糖基化(糖基化是在糖基转移酶的作用下,将糖转移至蛋白质的过程)以降低氢键的键能或者用聚乙二醇进行改性都可以提高药物的透过性。但是并不是所有的药物都能靠修饰来提高透过性[21];另外一种方式是用甘露醇和阿拉伯胶的高渗溶液使脑细胞脱水收缩,细胞间隙增大,血脑屏障打开,该方法在临床上已经广泛应用[22]。Neuwelt等[23]用此法可以使酶和单克隆抗体进入脑内的量增加3至4倍。但是开放的面积太大也可能会使一些毒素或者异物进入大脑,使脑细胞坏死,同时甘露醇与阿拉伯胶浓度过高也会对大脑造成严重的毒副作用。
纳米泡在聚焦超声的作用下,发生瞬态空化效应,可以短暂的开放血脑屏障,使载体进入脑内成像或者给药(图3)[24]。纳米泡的粒径小,开放面积也比甘露醇小,使得毒素或者异物不易进入大脑,减少患者的脑部损伤[11]。Cheng等[25]将普朗尼克加入至DPPC、DPPA和DPPE的混合物中制备载体,然后包载气体制备脂质纳米泡。结果表明,该纳米泡在经颅聚焦超声的作用下可以打开血脑屏障,且效果优于微泡。Cheng等[26]研究在聚焦超声的作用下,普朗尼克-脂质纳米泡的浓度对血脑屏障开放的影响,实验表明:当将该纳米泡的浓度以1∶1、1∶10和1∶100三个浓度进行稀释,在超声的作用下,都能成功打开血脑屏障,且纳米泡的浓度越大,成像时间越长。将纳米泡的血脑屏障开放技术与递药系统相结合,就为某些脑部疾病(如脑瘤、阿尔茨海默病、帕金森综合症等)提供了新的诊疗思路[27]。

图3 聚焦超声作用下纳米泡开放血脑屏障的示意图
4 磁共振成像
与超声成像类似,磁共振成像也是一种无创性的成像技术,在临床应用极为广泛,主要优点是可以得到高分辨率的软组织成像对比图[28]。为了进一步提高磁共振成像的对比度,常需加入造影剂,传统的磁共振成像造影剂主要是铁化合物、锰螯合物、钆螯合物等[29]。
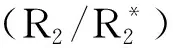
5 展 望
综上所述,纳米泡可实现成像和给药一体化的治疗模式,这不仅有不可估量的医学价值和经济效益,还有巨大的科研前景[33]。未来纳米泡的研究还需要从以下几方面进一步完善:对于制备纳米泡所需的惰性气体与辅料的生物毒性,需做长期、系统性的研究;此外,虽然文献报道制备出来各种各样的纳米泡,并证明具有良好的成像效果,但是市场上却鲜有纳米泡造影剂的产品,这说明纳米泡的处方和工艺仍需改进,稳定性有待提高,才能满足临床的需求。

