铁调节蛋白2高表达对MPP+诱导的PC12细胞损伤的影响
(青岛大学基础医学院,山东省神经相关疾病的机制与重点防治实验室,山东省沿海地区神经退变疾病协同创新中心,山东 青岛 266071)
帕金森病(Parkinson’s disease,PD)是一类常见的神经系统退行性疾病,PD主要的病理改变是中脑黑质致密部多巴胺(DA)能神经元的变性死亡,进而引起纹状体DA含量显著降低[1]。虽然导致这一病理改变的确切病因目前仍不清楚,但脑内黑质铁异常聚集被认为是一种重要的致病因素[2]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)是一种常用的PD小鼠造模的神经毒素,可以选择性地损伤黑质中的DA能神经元并且诱发PD。MPTP在星形胶质细胞中可被代谢为1-甲基-4-苯基吡啶阳离子(MPP+),之后再通过DA转运体进入DA能神经元并导致其氧化应激水平升高[3]。目前研究发现,MPTP诱导的PD小鼠模型的黑质中,铁水平升高且DA能神经元丢失[4]。MPP+能够引起细胞内铁的聚集,增强转铁蛋白受体1(TFR1)和二价金属转运蛋白1(DMT1)的表达[5-6]。
铁调节蛋白2(IRP2)在维持细胞铁稳态中发挥着重要作用[7-10]。本课题组前期研究显示,MPP+诱导的PD细胞模型内IRP2表达水平下降[11],这提示IRP2蛋白在MPP+诱导的PD模型中可能发挥潜在作用。但高表达IRP2如何影响MPP+的细胞毒性仍不清楚,本实验旨在探讨IRP2高表达在MPP+诱导PC12细胞损伤中的作用。
1 材料和方法
1.1 实验材料
PC12细胞购于中国科学院上海生命科学研究所;MPP+、CCK-8试剂盒购买于美国Sigma公司;胰酶购于美国Biosharp公司;多功能酶标仪购于芬兰Perkinelmer公司;LipotamineTM2000购于美国Invitrogen公司;IRP2抗体购自美国Abcam公司;β-Actin抗体购于美国CST公司;Myc-vector空载质粒和携带IRP2基因的Myc-IRP2质粒来自实验室前期构建。
1.2 PC12细胞培养
将PC12细胞置于含体积分数0.10的胎牛血清及100 kU/L青霉素和链霉素(1∶1)的DMEM培养基中,在37 ℃、含体积分数0.05的CO2培养箱中传代培养,每2~3 d传代一次,待PC12传到第3代且细胞融合度约90%时用于后续实验。
1.3 MPP+溶液浓度的筛选
将处于对数生长期的PC12细胞接种于96孔板中,待细胞生长24 h且完全贴壁以后,分别加入含有不同浓度(0、1、2、3、4、5 mmol/L)MPP+的DMEM培养基,每种浓度设置6个复孔。将孔板置于37 ℃、含体积分数0.05的CO2培养箱中培养24 h后,每孔中加入CCK-8溶液10 μL,将孔板在培养箱中孵育1~4 h,使用酶标仪测量各组溶液在波长450 nm处的吸光度(A)值。计算各组细胞存活率。细胞存活率=[(A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%。选择引起细胞损伤的最低浓度,用于后续实验。
1.4 分组及处理
将每孔约1×105个PC12细胞接种于96孔板中,培养24 h后使用LipotamineTM2000将Myc-vector和Myc-IRP2质粒分别转染PC12细胞。后在37 ℃、含体积分数0.05的CO2培养箱中培养6~8 h后,将包含有LipotamineTM2000的DMEM培养基换成含体积分数0.10胎牛血清的DMEM培养基,继续培养24 h后备用。然后依据处理方式不同将细胞分为4组:①vector组:Myc-vector质粒转染后在含有体积分数0.10胎牛血清的DMEM培养基中培养24 h;②vector/MPP+组:Myc-vector质粒转染后在含2 mmol/L MPP+的DMEM培养基中培养24 h;③IRP2组:Myc-IRP2质粒转染以后在含体积分数0.10胎牛血清的DMEM培养基中培养24 h;④IRP2/MPP+组:Myc-IRP2质粒转染后在含2 mmol/L MPP+的DMEM培养基中培养24 h。
1.5 免疫印迹法检测PC12细胞中IRP2相对表达水平
将培养好的细胞接种于96孔板,待PC12细胞融合度约50%时,按1.4步骤处理细胞48 h后,收集PC12细胞,提取细胞总蛋白后,加入5×loading buffer,于水中煮沸10 min进行变性。并按照SDS-PAGE凝胶配置说明书配制150 g/L分离胶以及50 g/L的浓缩胶。加入20 μg蛋白样品至凝胶孔中,进行SDS-PAGE蛋白电泳,PVDF转膜,然后以50 g/L脱脂奶粉室温封闭2 h。根据目的蛋白分子量裁剪PVDF膜条带,分别加入IRP2(1∶1 000)和β-actin(1∶10 000)单克隆抗体4 ℃孵育过夜,并以β-actin作为内参照,TBST洗膜后加入二抗并室温孵育1 h,TBST洗膜。然后加入ECL化学发光液显影并拍照。使用Image J软件分析IRP2蛋白条带灰度值,IRP2蛋白相对表达量以IRP2蛋白灰度值/β-actin蛋白灰度值计算,结果取3次重复实验的均值。
1.6 PC12细胞活力的检测
vector组、vector/MPP+组、IRP2组和IRP2/MPP+组细胞经1.4步骤处理后,置于96孔培养板中,每组细胞设置6个复孔,每孔中加入CCK-8溶液10 μL,置于37 ℃、含体积分数0.05的CO2培养箱中孵育1~4 h后,采用酶标仪测量各组溶液在波长450 nm处的吸光度(A)值。计算各组细胞存活率。细胞存活率=[(A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%。
1.7 统计学处理
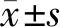
2 结 果
2.1 诱导PC12细胞损伤的最低MPP+药物浓度
CCK-8测定法检测结果显示,MPP+浓度为0、1、2、3、4、5 mmol/L培养基中的PC12细胞的存活率分别为(94.04±1.92)%、(87.39±2.32)%、(76.44±5.63)%、(44.64±3.48)%、(32.57±2.96)%,不同浓度间比较差异均有显著性(F=207.30,P<0.05)。其中,2 mmol/L为引起细胞损伤的最低浓度,因此后续实验均采用2 mmol/L浓度的MPP+溶液诱导PC12细胞损伤。
2.2 各组PC12细胞中IRP2蛋白的表达水平比较
免疫印迹法检测结果显示,vector组、vector/MPP+组、IRP2组、IRP2/MPP+组细胞中IRP2蛋白的相对表达量分别为0.62±0.15、0.50±0.11、1.04±0.09、0.71±0.02,组间比较差异均具有统计学意义(F=15.38,P<0.05)。其中,相较于vector和vector/ MPP+组,IRP2组和IRP2/ MPP+组细胞中IRP2蛋白的相对表达量明显升高(P<0.05)。见图1。

A~D分别代表vector组、vector/MPP+组、IRP2组及IRP2/MPP+组图1 各组PC12细胞中IRP2蛋白的表达水平Fig.1 Protein expression level of IRP2 in each group of PC12 cells
2.3 IRP2高表达对MPP+损伤PC12细胞存活率的影响
CCK-8测定方法检测结果显示,vector组、vector/MPP+组、IRP2组、IRP2/MPP+组细胞存活率分别为(101.67±4.70)%、(80.25±5.23)%、(69.39±8.91)%、(58.62±5.27)%。IRP2高表达对MPP+损伤PC12细胞影响的比较采用2×2析因设计方差分析,其中两因素分别为“转染类型(是否转染IRP2质粒)”和“损伤处理(是否进行MPP+处理)”,结果显示,F转染类型=111.41,P<0.05;F损伤处理=39.71,P<0.05;F转染类型*损伤处理=4.34,P<0.05。单独效应结果显示,未给予MPP+处理时,两种转染类型平均值差值为0.32,P<0.05;给予MPP+处理时,两种转染类型平均值差值为0.22,P<0.05;转染类型为vector时,两种MPP+处理方式的平均值差值为0.21,P<0.05;转染类型为IRP2时,两种MPP+处理方式的平均值差值为0.11,P<0.05。
3 讨 论
MPP+是一种常见的PD小鼠造模的神经毒素,由其前体MPTP透过血脑屏障被位于星形胶质细胞线粒体中的单胺氧化酶-B迅速催化生成[12]。MPP+可以通过DA转运体进入DA能神经元阻断线粒体NADH氧化呼吸链,此过程同时伴有氧自由基的增加和谷胱甘肽的减少,并导致DA能神经元氧化应激水平升高[5],引起DA能神经元的死亡。MPP+处理PC12细胞被视为一种经典的PD细胞模型制备方法[13]。本研究使用的PC12细胞是一种大鼠的儿茶酚胺类细胞,在形态、生理、生化及功能等方面接近于人中脑DA能神经元。
尸检研究显示,PD患者的DA能神经元中铁水平明显增高,同时PD患者黑质部位出现铁聚集,提示脑内铁稳态的失衡是PD中神经元死亡的关键机制[14]。铁稳态在细胞内受到精密调控[15-16],当细胞内铁含量缺乏时,IRPs可与铁反应元件(IRE)结合;当细胞内铁充足时,IRPs与IRE的结合便被破坏[8-9,17-18]。在正常生理状况下,IRP2在脑内的表达水平是动态平衡的,但在病理情况下,IRP2的表达水平将会改变,进而造成细胞内铁代谢调控紊乱、异常蛋白聚集、细胞周期调控失衡、神经炎症以及氧化还原稳态失衡等,导致神经退行性疾病的发生[19-21]。IRP2敲除小鼠会表现出PD样症状,其特征是共济失调、运动迟缓、震颤以及中枢神经系统中的铁代谢失衡[8,22]。同时,本实验室前期的研究结果显示,在MES23.5细胞内以MPP+制备PD模型后,IRP2在细胞内的表达量发生了异常改变[11]。目前IRP2在PD中的作用仍存在一定争议。
本研究首先采用0、1、2、3、4、5 mmol/L浓度的MPP+处理PC12细胞,并使用CCK-8法检测细胞存活率,确定2 mmol/L的MPP+处理浓度是造成PC12细胞损伤的最低浓度,并选取作为后续实验中MPP+诱导损伤PC12细胞的浓度。此后采用免疫印迹法检测vector组、vector/MPP+组、IRP2组和IRP2/MPP+组细胞中IRP2表达水平,结果显示,IRP2组、IRP2/MPP+组细胞中IRP2的表达水平均明显升高,提示IRP2高表达质粒转染成功。采用CCK-8法检测上述各组的细胞存活率,两因素析因设计的方差分析结果显示,“转染类型”和“损伤处理”两因素存在协同作用。单独效应结果显示,转染IRP2质粒和进行MPP+处理均可独立造成PC12细胞的损伤。以上结果提示,IRP2的高表达不仅可以直接造成PC12细胞的损伤,还能够加剧MPP+对PC12细胞的损伤,这说明IRP2的稳态在维持细胞正常生理活动中发挥着重要作用。IRP2在细胞内的表达水平受到精细调控,其过高或过低表达都会造成细胞的损伤,但IRP2高表达造成损伤的机制仍需要实验进行探究。目前IRP2在PD中的作用仍存在一定争议,有研究指出,IRP2基因的突变不是PD黑质铁积聚的常见原因[23],造成这种争议的原因可能是未将IRPs/IRE结合亲和力纳入检测范围,单纯检测IRP2的表达量不足以判断IRP2与铁聚集的相互联系,因此在后续实验中可以进一步检测IRPs/IRE结合亲和力在PD细胞模型中是否有改变。除此之外,也需要考虑IRP2是如何参与到MPP+对PC12细胞的损伤过程中的,MPP+一方面可以通过抑制线粒体复合体Ⅰ,造成线粒体功能障碍,影响ATP合成,导致细胞死亡[24-25];另一方面则是通过诱导细胞DMT1和TFR1的高表达,从而使细胞摄铁功能增强,造成铁在细胞内聚集和活性氧的生成,进而导致细胞发生氧化应激[11,26]。IRP2是否参与以上过程,其高表达导致细胞受损的具体机制,均需进一步的实验验证。
综上所述,本研究初步探讨了IRP2高表达对MPP+诱导损伤的PC12细胞存活率的影响,发现IRP2高表达能显著下调PC12细胞存活率,也会加剧MPP+诱导的PC12细胞损伤。提示在MPP+诱导的PD细胞模型中维持细胞内IRP2稳态对细胞存活有着积极作用,为阐明IRP2的调控异常在PD中的作用提供了实验室数据参考。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
作者贡献:姜宏、贾凤菊、姚征洋参与了研究设计;姜宏、贾凤菊、姚征洋、杜希恂、陈曦、焦倩、傅琳参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byJIANGHong,JIAFengju, andYAOZhengyang. The manuscript was drafted and revised byJIANGHong,JIAFengju,YAOZhengyang,DUXi-xun,CHENXi,JIAOQian, andFULin. All the authors have read the last version of the paper and consented submission.
——一道江苏高考题的奥秘解读和拓展

