人NK细胞的体外扩增及其基因表达通路的研究
张红 吴昊2 姜磊2 鲁晓晴
(1 青岛大学公共卫生学院,山东 青岛 266071; 2 青岛大学华赛医学细胞和蛋白质药物研究院)
自然杀伤(NK)细胞是机体重要的先天性免疫细胞,也是抵御病毒感染或者恶性肿瘤的第一道防线[1]。NK细胞主要分布在外周血中,占外周血单个核细胞(PBMC)的比例为5%~20%,在肿瘤患者体内,其抗肿瘤免疫的作用会受到限制[2-3]。因此必须在体外扩增培养大量有活性的NK细胞以满足患者临床治疗的需要。
研究表明,细胞因子对NK细胞影响各不相同,多细胞因子联合应用能更好促进NK细胞增殖和活化[4-9]。然而如何对影响NK细胞增殖活化的因素进行选择和优化,从而达到最佳效果,迄今为止,尚无一致结论。本研究首先从NK细胞的扩增数量、表型以及功能实验等方面对NK细胞体外扩增方法进行验证,以期为NK细胞免疫治疗提供理论基础和实验依据;然后再通过磁性细胞分选(MACS)技术获得不同培养阶段纯化后的NK细胞,进行转录组测序(RNA-seq)分析[10-11],进一步探讨NK细胞体外增殖活化的信号通路,为基于NK细胞药物的开发提供新思路。
1 材料与方法
1.1 材料和设备
人淋巴细胞分离液购于美国Alere公司,IFN-γ ELISA试剂盒购于美国R&D生物科技公司,重组人IL-2(rhIL-2)、rhIL-12、rhIL-15、rhIL-18、rhIL-21和抗人CD16单克隆抗体均为同立海源生物科技有限公司产品;鼠抗人CD56、CD3流式抗体购于美国BD公司,免疫磁珠、分选器以及分选柱均购于德国Miltenyi公司,肿瘤细胞株K562-GFP购买于美国ATCC细胞库。
1.2 细胞培养
选取健康志愿者6例(健康体检者,男女不限,年龄18~45岁),每例志愿者均无菌采集外周血50 mL作为样本,分离PBMC,每例样本的PBMC分别使用包被过CD16抗体的T25细胞培养瓶以密度1.5×109个/L进行培养,并且每瓶均加入5 mL人淋巴细胞无血清培养基(含体积分数0.05的人灭活自体血清,以及体积分数0.001的rhIL-2、体积分数0.003的rhIL-12、体积分数0.002 5的rhIL-15、体积分数0.005的rhIL-18、体积分数0.001的rhIL-21);每2~3 d补充上述培养液一次,并在第0、3、5、7、10和14天时对每例样本的培养液在倒置显微镜下观察细胞的扩增情况;分别于第0、10、14天收集每例样本的细胞进行后续表型和功能实验的检测。采用含体积分数0.10 FBS的RPMI 1640培养基于37 ℃、含体积分数0.05 CO2培养箱中对肿瘤细胞株K562-GFP进行传代培养,取生长旺盛的细胞备用。
1.3 流式细胞术检测NK细胞表型
收集每例样本培养第0、10、14天的细胞,并将细胞密度调整为1×109个/L,将上述细胞荧光标记CD3-APC、CD56-PE抗体,用于流式细胞仪检测。每个时间点的NK细胞均设置同型的IgG阴性对照,在4 ℃条件下避光孵育20 min后,使用PBS漂洗2次,加入100 μL PBS重悬细胞后,用流式细胞仪检测和分析NK细胞表型,即CD3-CD56+细胞所占比例。
1.4 NK细胞体外杀伤活性检测
取生长旺盛的K562-GFP靶细胞悬液进行计数,调整细胞密度为1×108个/L,在12孔板上根据效靶比依次为5∶1、10∶1和 20∶1加入相应细胞密度的NK效应细胞(每例样本培养第0、10、14天的NK细胞),同时设置只有K562-GFP靶细胞的对照孔,置于细胞培养箱共培养4 h,收集细胞,采用流式细胞术检测各组NK细胞的杀伤活性。杀伤活性的计算公式:[(对照组K562-GFP活细胞数-实验组K562-GFP活细胞数)/对照组K562-GFP活细胞数]×100%。
1.5 ELISA方法检测不同时间点NK细胞IFN-γ的分泌情况
提取每例样本培养第0、10、14天的NK细胞,以ELISA方法检测细胞中IFN-γ的分泌情况,严格按照试剂盒说明书进行操作。每个时间点的NK细胞设置3个复孔,结果取均值。
1.6 纯化NK细胞并行RNA-seq和基因富集分析
根据上述对NK细胞进行细胞表型和功能实验的检测结果,筛选出最优的3例志愿者样本,筛选标准为NK细胞纯度、杀伤活性以及IFN-γ分泌量均较高者。分别收集这3例最优志愿者体外培养第0、10、14天的细胞进行MACS,先用CD3磁珠进行阴性分选,再用CD56磁珠进行阳性分选,获得纯化后的NK细胞,即CD3-CD56+细胞,计算NK细胞的纯化效率(3例样本不同时间纯化效率的平均值)。对每例样本每一个时间点纯化后的NK细胞分别进行RNA-seq分析,委托北京贝瑞和康生物技术有限公司完成。对RNA-seq结果,以|log2(Fold Change)|>2且P<0.05为标准筛选出不同时间点NK细胞中差异表达基因(DEGs),并对DEGs进行GO功能和KEGG通路富集分析。
1.7 统计学分析
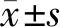
2 结 果
2.1 NK细胞的体外扩增情况以及表型分析
从第1天开始,体外扩增的NK细胞形态发生改变,变亮变圆,逐渐出现抱团聚集现象。NK细胞在培养前5 d生长较为缓慢,最快增殖时间为培养的第7~14天(图1)。当细胞培养至第10天时,细胞数量达到(37.27±4.29)×106个,当细胞培养至第14天时,细胞的数量达到(48.93±4.43)×106个。使用流式细胞仪分析培养至第0、10、14天时NK细胞(CD3-CD56+)的比例,结果详见图2A~C,其中Q1区为NK细胞所在区域,第14天时NK细胞(CD3-CD56+)的比例超过90%。

A~C分别为培养第0、10、14天的NK细胞图1 NK细胞体外扩增情况Fig.1 In vitro amplification of NK cells

A~C分别为流式细胞仪检测第0、10、14天时NK细胞(CD3-CD56+)所占比例图2 NK细胞表型检测Fig.2 NK cell phenotype
2.2 NK细胞对K562细胞的杀伤活性分析
析因设计的方差分析显示,时间、效靶比、时间和效靶比交互对NK细胞的杀伤活性均有显著影响(F时间=4 086.28,F效靶比=2 857.25,F时间*效靶比=341.18,P<0.05);单独效应分析显示,在效靶比相同时,第10天和第14天时NK细胞杀伤活性均较第0天明显增强,在同一时间点,不同效靶比的NK细胞对K562细胞的杀伤活性比较差异具有显著性(F=124.40~5 512.00,P<0.05)。见表1。
2.3 不同时间点NK细胞IFN-γ的分泌情况比较
检测结果显示,第0、10、14天时NK细胞IFN-γ分泌量分别为(1.42±0.13)、(41.22±1.18)和(45.85±1.23)μg/L,不同时间点比较差异有显著性(F=1 697.00,P<0.05),其中第14天与第0、10天时比较差异均具有统计学意义(q=67.17、7.75,P<0.05)。

表1 不同效靶比和不同时间点时NK细胞对K562细胞的杀伤活性比较Tab.1 Comparison of killing activity of NK cells against K562 cells at different effector/target ratios and different time points
2.4 不同时间点NK细胞纯化效率
检测结果显示,这3例最优志愿者不同时间点的NK细胞经过MACS纯化以后,NK细胞(CD3-CD56+)的比例达到(94.69±1.33)%。
2.5 不同时间点NK细胞的RNA-seq分析结果
RNA-seq分析结果显示,与第0天相比,培养至第10天时NK细胞中上调DEGs有1 458个,下调DEGs有1 748个;与第0天相比,培养至第14天时NK细胞中上调DEGs有1 077个,下调DEGs有1 103个。与第10天相比,培养至第14天时NK细胞中上调DEGs有0个,下调DEGs有4个。GO功能和KEGG通路富集分析结果显示,这些DEGs主要与炎症反应、免疫反应、细胞分裂、细胞增殖相关,而且显著富集在细胞周期、成骨细胞分化、造血细胞调控、NF-Kappa B等信号通路上。
3 讨 论
NK细胞活化是指通过IL等外界因子的刺激作用,使NK细胞比作用前具有更强的杀伤活性,从而使机体在抗病毒感染、抗肿瘤和免疫调节等方面发挥重要作用[12]。由于目前对NK细胞活化相关基因组信息的研究有限,导致对NK细胞生长发育和功能调控的许多机制均不明了,限制了其进一步的应用。本研究通过MASC方法获得纯化后不同培养时间的NK细胞并进行RNA-seq分析,筛选出DEGs,为探讨NK细胞活化的基因表达通路以及进一步解决临床应用中所遇到的问题,提供研究方法和手段。
本研究中NK细胞体外扩增情况和表型分析结果显示,当细胞培养至第14天时,细胞数量达到(48.93±4.43)×106个,NK细胞(CD3-CD56+)的比例超过90%,这表明该培养方法不仅可以有效诱导PBMC成为NK细胞,使其大量增殖并且保证了扩增纯度。NK细胞杀伤活性和IFN-γ分泌量检测结果显示,第10、14天NK细胞杀伤活性较第0天明显增强,在同一时间点,随着效靶比提高,杀伤活性均逐步增强;培养至第14天的NK细胞IFN-γ分泌量均高于第10、0天。这表明该培养方法可以提高NK细胞的杀伤活性和细胞毒作用。本研究建立的NK细胞体外扩增培养方法,无需饲养层细胞,也无需基因改造,就可直接从PBMC中获得高质量、高杀伤活性和高扩增倍数的NK细胞,从而提高了NK细胞临床应用的安全性[13-16]。本研究RNA-seq结果显示,第10、14天NK细胞与第0天NK细胞比较,DEGs均增多,且第10天DEGs多于第14天,表明在现有培养方案下,体外培养至第10天的NK细胞处于增殖活化的关键时期,到第14天时NK细胞已经处于平台期。第10天和第14天NK细胞相比只有4个DEGs,表明这两组的组间差异较小,样本间表达模式的相似度较高。GO功能和KEGG通路富集分析结果均显示,这些DEGs与炎症反应相关,这表明炎症反应可能在NK细胞活化发挥作用方面扮演着重要角色。
本研究的创新之处在于首先通过建立NK细胞体外扩增培养方法,比较分析健康人NK细胞在不同时间点的扩增情况、杀伤活性和细胞毒性,探讨该培养方法对于NK细胞体外增殖活化不同时期的影响,对未来临床NK细胞药物的开发提供参考。此外通过对不同时间点纯化后NK细胞进行RNA-seq分析,了解不同培养阶段NK细胞的基因表达情况,为后续深入研究NK细胞的特性、探讨体外增殖活化潜在的分子调控机制提供了研究方法和研究手段。
目前NK细胞活化的途径有两种假说,即“丧失自我”和“压力诱导”[17-19]。活化的NK细胞通过不同的机制发挥功能,许多研究表明炎症反应与NK细胞的活化密切相关[20-22]。本研究的GO功能和KEGG通路富集分析结果也显示这些DEGs与炎症反应相关,因此本文重点探讨和炎症反应有关的NF-Kappa B信号通路。事实上,通过与炎症反应相关的细胞因子使NK细胞活化,从而对肿瘤细胞进行杀伤的治疗手段已经应用于临床[23-24]。研究表明NF-Kappa B信号通路的特异性阻断剂MG132可以部分下调NK细胞的细胞毒活性,并同时抑制NK细胞的增殖,这可能是通过调节IFN-γ、FASL、perforin等杀伤分子的表达从而发挥其调控NK细胞活化的作用[25]。然而,关于调控NK细胞活化的具体细节并不清楚,还需要进一步的探索和研究。
本研究也存在一些局限性,如样本量较小,无法更好地设置生物学重复,并且只是在生物信息学分析下的理论研究,下一步还应进行一些分子生物学实验的验证,从而进一步阐明NK细胞体外活化的具体机制和作用。
综上所述,本研究从方法学的角度探索CD16抗体联合5种细胞因子体外扩增培养NK细胞方法的有效性,并在NK细胞扩增数量、表型检测和功能实验方面进行验证,为NK细胞免疫治疗提供理论基础和实验依据,从而为进一步解决临床应用所遇到的问题提供研究方法和手段。另外,本研究还通过对不同时间点纯化后的NK细胞进行RNA-seq分析,寻找与维持NK细胞增殖活化相关的信号通路,为基于NK细胞药物的开发提供新思路。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和知情同意:本研究涉及的所有实验均已通过青岛大学医学部伦理委员会的审核批准(文件号QDU-HEC-2022163)。所有实验过程均遵照《赫尔辛基宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
EthicsApprovalandPatientConsent: All experimental protocols in this study were reviewed and approved by The Ethics Committee of Qingdao University Faulty of Medicine (Approval Letter No. QDU-HEC-2022163, and all experimental protocols were carried out by following the guidelines of Declaration Helsinki. Consent letters have been signed by the research participants or their relatives.
作者贡献:张红、鲁晓晴、姜磊、吴昊参与了研究设计;鲁晓晴、张红参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byZHANGHong,LUXiaoqing,JIANGLei,andWUHao. The manuscript was drafted and revised byLUXiaoqingandZHANGHong. All the authors have read the last version of the paper and consented submission.

