烯唑醇与血清蛋白的立体选择性作用机制
陈 冉, 郭 栋,2, 何汝坚, 殷 霞, 范 军*, 章伟光*
(1. 华南师范大学化学学院, 广州 510006; 2. 广州研创生物技术发展有限公司, 广州510663)
手性异构体的物理化学性质相同,但其生物活性、毒理、代谢和降解等性质在手性环境下差异显著[1]。例如S-萘普生的抗炎、镇痛和解热效果是R-萘普生的28倍[2];S-华法林对血栓栓塞性疾病的预防和治疗效果是R-华法林的4倍以上,这归因于2种异构体与细胞色素酶(CYP2C9)的作用差异[3]。因此,研究手性药物分子与蛋白的立体选择性作用具有重要意义。
目前,UV-Vis吸收光谱、荧光光谱、电子圆二色光谱和分子对接技术被广泛应用在各种小分子与蛋白质的结合特性研究中[4-6]。YUAN等[7]采用多谱学技术和分子对接技术研究乳酸与人血清蛋白(HSA)的相互作用,发现了L-乳酸更易于与HSA结合。CUI等[8]研究发现D-胞嘧啶与HSA的相互作用强于L-胞嘧啶,两者的相互作用主要为疏水力。本课题组[9]采用紫外光谱和荧光光谱研究了R,S-1-(3-甲氧基苯)乙胺、R,S-1-(4-甲氧基苯)乙胺、R,S-四氢萘胺、R,S-2-辛醇和R,S-乳酸甲酯与血清蛋白的作用,血清蛋白与这些化合物表现出立体选择性。
烯唑醇是一种广谱三唑类杀菌剂,被广泛应用在小麦、水果、蔬菜和茶树等抗菌[10]。烯唑醇有一个手性中心和一对对映异构体。研究表明:R-烯唑醇的抗真菌活性显著高于S-烯唑醇[10-11];在生物积累时两者表现为立体选择性,S-烯唑醇在人工土壤[12]中和黄粉虫幼虫体内[13]优先积累;两者的药代动力学差异显著,给兔静脉注射烯唑醇对映体后,在血浆中S-烯唑醇的清除率是R-烯唑醇的1.57倍[14]。然而,它们未能揭示2种烯唑醇对映异构体表现出立体选择性的作用机制。在本研究中,采用UV-Vis吸收光谱法、荧光光谱法和分子对接技术研究了烯唑醇对映体与HSA或BSA的结合差异,为烯唑醇的立体选择性作用机制提供理论参考。
1 实验部分
1.1 主要试剂
人血清蛋白(HSA,纯度≥96%,A1653)购自上海西格玛奥德里奇贸易有限公司。牛血清蛋白(BSA,纯度≥98%,A104912)购自上海阿拉丁生化科技股份有限公司。R-烯唑醇和S-烯唑醇(e.e.>98%)由广州研创生物技术发展有限公司提供,结构如图1所示。磷酸二氢钠和磷酸氢二钠(分析纯)购自天津市大茂化学试剂厂。
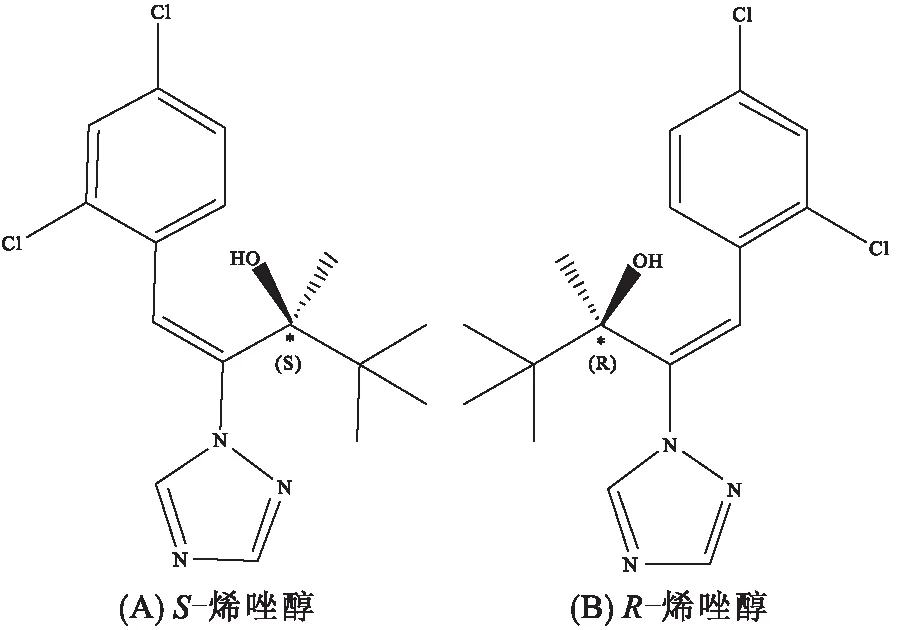
图1 烯唑醇对映异构体的分子结构
1.2 UV-Vis吸收光谱的测定
精密称取9.98 mg HSA置于100 mL的容量瓶中,加入PBS(pH 7.4)缓冲溶液溶解,配制成浓度为1.5 μmol/L的溶液。向HSA溶液(3 mL,1.5 μmol/L)中依次加入一定体积的R-烯唑醇(600 μmol/L)后摇匀,使R-烯唑醇的浓度分别为 0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 μmol/L。将R-烯唑醇和HSA混合液在25 ℃的水浴中保持5 min后在紫外可见分光光度计(UV-2700,日本岛津)上记录了这一系列溶液在200~400 nm波长范围内的紫外吸收光谱。S-烯唑醇与HSA作用实验与R-烯唑醇类似,以S-烯唑醇替代R-烯唑醇。
BSA与R-烯唑醇和S-烯唑醇相互作用实验与HSA类似,BSA的浓度为1.5 μmol/L,烯唑醇对映体在BSA溶液中的浓度分别为0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 μmol/L。
1.3 荧光光谱的测定
溶液配制方法与1.2节相同,HSA和BSA的浓度均为1.5 μmol/L,R-烯唑醇和S-烯唑醇的浓度分别为0、6.1、15.3、30.7、46.0和61.3 μmol/L。将混合溶液分别在293、303和313 K下孵育30 min后,使用荧光分光光度计(F-4600,日本日立)记录这一系列血清蛋白溶液在300~530 nm波长范围内的荧光光谱,激发波长为280 nm,狭缝宽度为5 nm。
1.4 分子对接模拟法
BSA和HSA晶体结构的PDB ID分别为3V03和1HA2。首先,使用Pymol 2.3软件除去蛋白质结构中所有配体和水分子,并以pdb格式保存;使用Autodock 4.2软件对HSA进行加氢和电荷计算操作,设置为刚性对接模式。同时,将R-烯唑醇和S-烯唑醇的稳定异构体模型文件保存为pdb格式,对其加氢和加电荷处理。然后,调整网格框12.6 nm×12.6 nm×12.6 nm,间距参数为0.058 6 nm,使用Autodock 4.2软件对HSA和R-烯唑醇进行了对接,得到了R-烯唑醇在HSA中最可能的结合位点范围。为了进一步精确模拟烯唑醇与HSA间的相互作用,将网格距离和间距参数分别缩小为7 nm×7 nm×7 nm和0.037 5 nm。S-烯唑醇与HSA对接的网格距离和间距参数和R-烯唑醇与HSA对接的网格距离和间距参数一致。上述计算均使用Lamarckian遗传算法。最后,基于能量最低原理,找到了R-烯唑醇和S-烯唑醇与HSA最有利的对接模型,使用Auto Dock Tools 1.5.6软件包进行分析。
R-烯唑醇和S-烯唑醇与BSA的分子对接方法与之类似,网格距离和间距参数分别为7 nm×7 nm×7 nm和0.037 5 nm。
2 结果与讨论
2.1 紫外-可见吸收光谱分析
图2为血清蛋白在滴加R-烯唑醇和S-烯唑醇前后的紫外吸收光谱图。随着R-烯唑醇和S-烯唑醇的浓度从0增大至8 μmol/L,HSA和BSA在波长280 nm附近的吸收峰强度增加,说明R-烯唑醇和S-烯唑醇与血清蛋白作用形成了复合物;而在波长250 nm附近的吸收峰归属于烯唑醇CC键、CN键和苯环n→π*和π →π*跃迁,随烯唑醇浓度增大,吸收峰强度不断增强。随烯唑醇浓度的进一步增大,血清蛋白在波长280 nm处的特征吸收峰发生蓝移,这归因于加入R-烯唑醇和S-烯唑醇使得血清蛋白的肽链伸展,色氨酸和酪氨酸残基上疏水基团暴露后疏水作用减弱,亲水作用增强,n→π*和π →π*跃迁增强。最终,加入烯唑醇对HSA和BSA的构象产生影响[15]。

图2 不同烯唑醇对映体的浓度对HSA和BSA紫外吸收光谱的影响
药物与血清蛋白间的结合常数(KA)可以反映两者的结合能力。通过修正的Hildebrand-Benesi方程可得KA[16]:
(1)
通过式(1)计算可知,R-烯唑醇和S-烯唑醇与HSA作用的紫外结合常数KA分别为8.85×103mol/L和4.02×103mol/L,而两者与BSA作用的紫外结合常数KA分别为9.14×103mol/L和3.94×103mol/L,这说明R-烯唑醇与血清蛋白的结合更稳定。
2.2 荧光光谱分析
2.2.1 烯唑醇对血清蛋白的荧光猝灭 荧光光谱研究可以获得小分子与蛋白的结合位点、结合常数和结合机理等信息。HSA/BSA的荧光归因于血清蛋白中色氨酸、酪氨酸和苯丙氨酸残基的荧光发射。图3为293 K下加入烯唑醇对映体后HSA/BSA溶液的荧光谱图,随着R-烯唑醇浓度从0增加至61.3 μmol/L,HSA的荧光发射显著降低,说明了R-烯唑醇与HSA的相互作用是HSA的内源性荧光猝灭。同时,HSA的最大发射峰波长从350 nm蓝移到347 nm,说明加入R-烯唑醇后,HSA中的色氨酸残基微环境发生了改变。图3B中给出了S-烯唑醇对HSA荧光的影响,变化规律与R-烯唑醇的一致。对于BSA,随R-烯唑醇和S-烯唑醇浓度的升高,其荧光强度显著下降,最大发射峰发生微小蓝移。
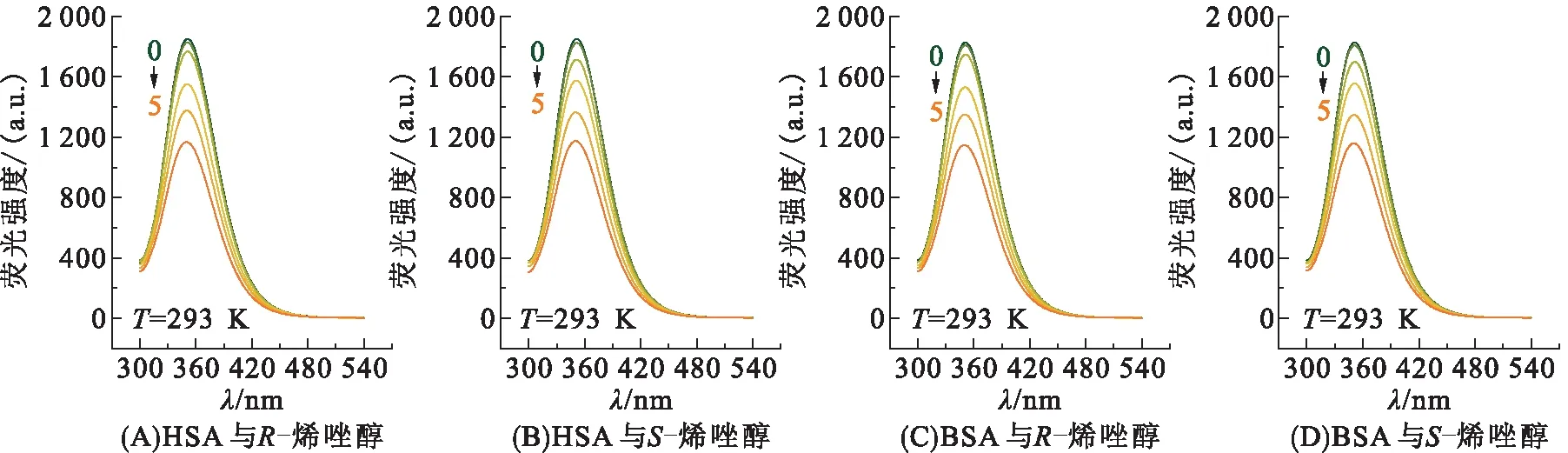
图3 HSA和BSA在加入烯唑醇对映体前后的荧光光谱
2.2.2 荧光猝灭类型确定 荧光猝灭分为静态猝灭和动态猝灭。动态猝灭是由猝灭剂与激发态分子间的碰撞引起的荧光猝灭;静态猝灭是指猝灭剂和基态分子形成无荧光的复杂化合物,温度升高可能导致结合较弱的复合物解离发生荧光猝灭。静态猝灭常数也具有温度依赖性,温度升高会使静态猝灭常数降低。然而,当温度升高引起的荧光增强程度大于分子碰撞引起荧光猝灭程度,即出现静态猝灭常数增大的反常现象[17]。猝灭类型可以通过Stern-Volmer方程来判断:
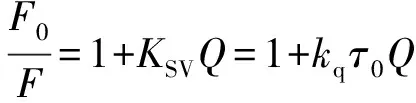
(2)
其中,F0和F对应于加入猝灭剂(烯唑醇)前后血清蛋白的荧光强度,KSV是Stern-Volmer 猝灭常数,Q是猝灭剂的浓度,kq是生物大分子的猝灭速率常数,τ0为生物大分子内源性荧光寿命,对于HSA或BSA,τ0约为1×10-8s。绘制F0/F与Q的曲线如图4所示,F0/F与Q间具有良好的线性关系,说明烯唑醇对血清蛋白的荧光猝灭是单一静态猝灭或动态猝灭[18]。表1中,kq均在1013数量级,远大于各种猝灭剂对生物大分子的最大碰撞速率常数(约2.0×1010L/(mol·s)),说明烯唑醇对血清蛋白的猝灭类型属于静态猝灭。猝灭常数KSV随温度升高而增大。因此,KSV和kq随温度的变化规律都表明烯唑醇对血清蛋白的荧光猝灭行为属于静态猝灭机理[19]。
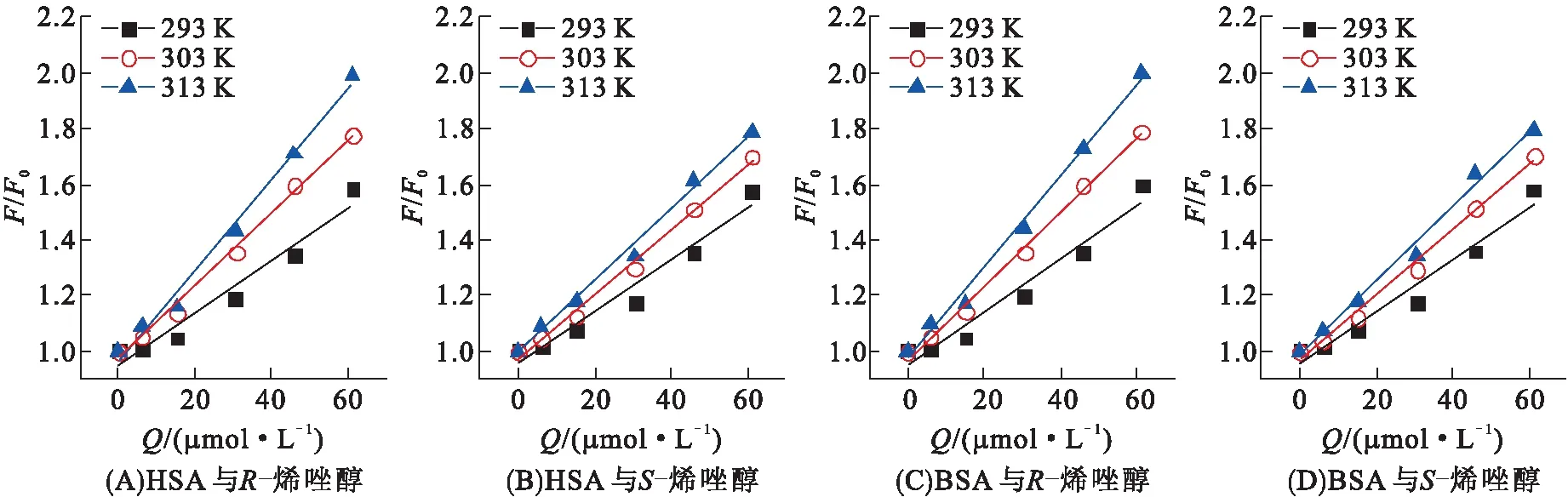
图4 不同温度下烯唑醇与HSA、BSA的Stern-Volmer图
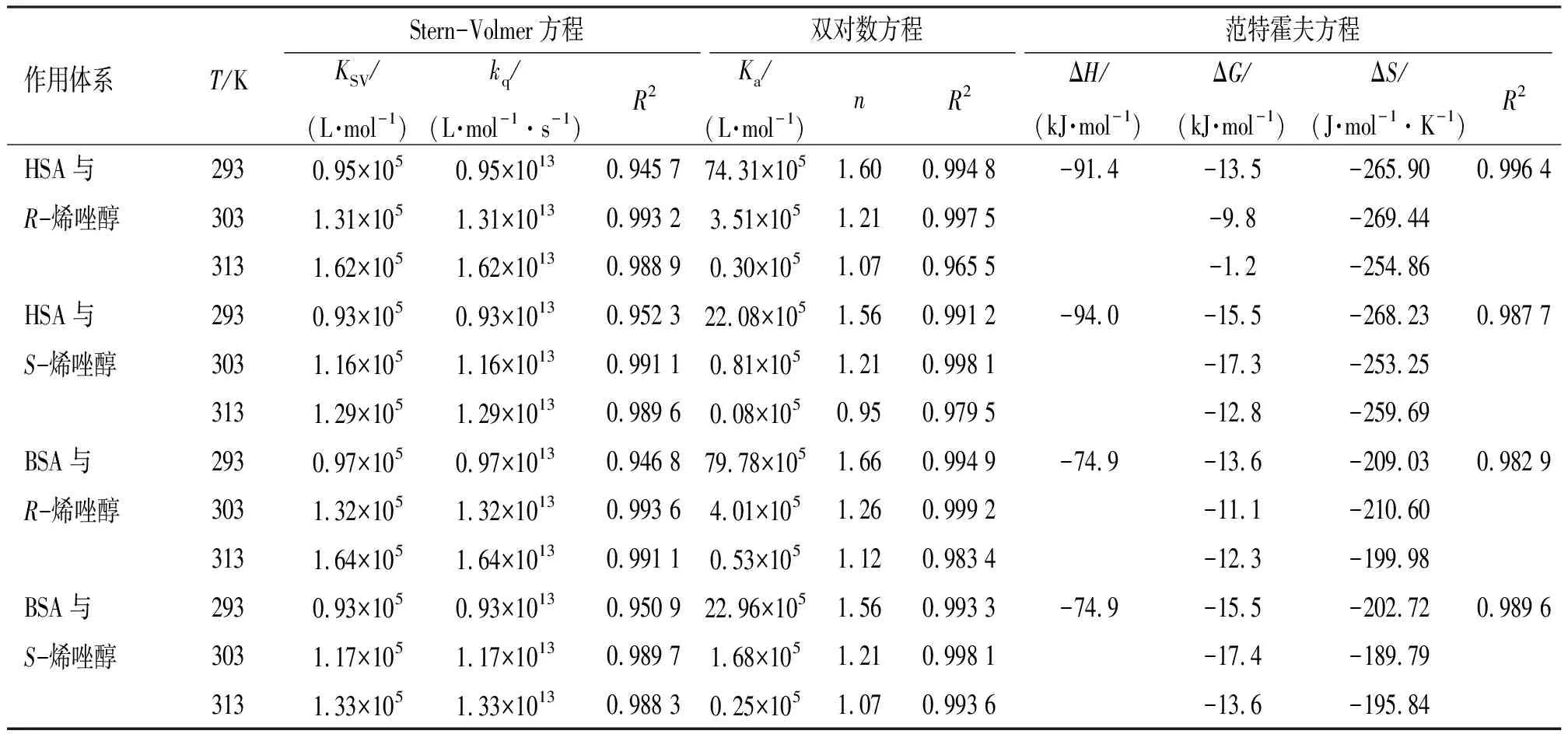
表1 不同温度下HSA和BSA与烯唑醇对映体的结合常数(Ka)、结合位点数(n)和热力学参数
2.2.3 手性结合常数和结合位点数n采用双对数方程得到烯唑醇与血清蛋白作用的结合常数(Ka)和结合位点数(n)[20]:
lg[(F0-F)/F]=lgKa+nlgQ。
(3)
表1中,随温度升高,Ka逐渐减小,说明烯唑醇对血清蛋白的荧光猝灭属于静态猝灭。在3个温度下,R-烯唑醇与血清蛋白的结合常数均大于S-烯唑醇与血清蛋白的结合常数。n在0.95~1.66范围内变化,表明烯唑醇与血清蛋白结合达到稳定时,血清蛋白上有1个结合位点被烯唑醇占据。
2.2.4 烯唑醇与血清蛋白相互作用力类型预测 热力学参数可以确定药物与血清蛋白间的相互作用力种类,如范德华力、氢键、静电作用和疏水相互作用等。通过范特霍夫方程来计算烯唑醇和血清蛋白作用过程的热力学参数ΔH、ΔS和ΔG:
(4)
其中,K是不同温度下的结合常数,R为理想气体常数(8.314 J/(mol·K))。
ΔH和ΔS的符号和大小是判断蛋白质与小分子结合形式的重要依据。若ΔH<0且ΔS<0,则氢键和范德华力占主导作用[21]。表1中,R-/S-烯唑醇与HSA作用的ΔH分别为-91.4 kJ/mol和-94.0 kJ/mol,而两者与BSA作用的ΔH均为-74.9 kJ/mol。R-烯唑醇和S-烯唑醇与血清蛋白作用的ΔS在-199.98~-269.44 J/(mol·K)范围内。ΔH和ΔS均为负值,说明了烯唑醇与血清蛋白作用时,范德华力和氢键占主导地位。同时,ΔG均小于零,说明烯唑醇与血清蛋白的结合是自发进行的。
2.3 分子对接法研究烯唑醇与血清蛋白作用机制
采用分子对接技术模拟HSA或BSA和烯唑醇对映体的结合。图5为R-烯唑醇和S-烯唑醇与HSA(A、B)和BSA(C、D)间相互作用的最优状态,形成复合物时涉及的氨基酸残基见表2。
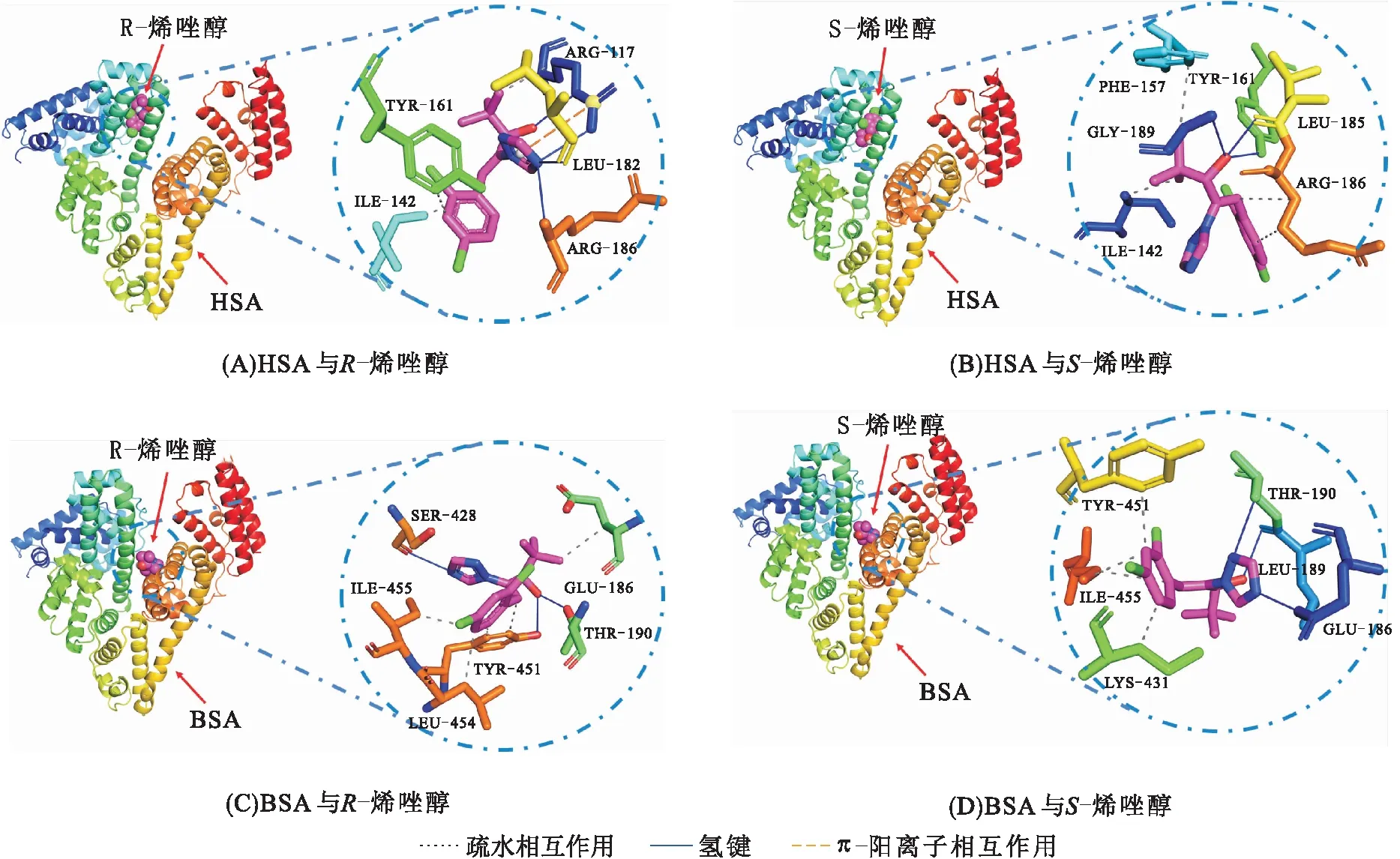
图5 HSA-烯唑醇和BSA-烯唑醇复合物的分子对接结果
R-烯唑醇与HSA的ARG117、ILE142和TYR161形成疏水相互作用,与氨基酸残基ARG117、LEU182、ARG186形成了4个氢键 (距离分别为0.252、0.232、0.201、0.322 nm),还与ARG117形成了弱的π-阳离子相互作用;S-烯唑醇与HSA中氨基酸残基ILE142、PHE157和ARG186存在疏水作用,与TYR161(0.219 nm)、LEU185(0.185 nm)、GLY189(0.337 nm)形成了3个氢键。这说明烯唑醇与血清蛋白间通过疏水作用、氢键和π-阳离子相互作用结合,氢键对增强复合物的稳定性具有重要作用。同时,R-烯唑醇-HSA复合物的对接能量为-26.4 kJ/mol,S-烯唑醇-HSA复合物的对接能量为-23.6 kJ/mol,说明R-烯唑醇-HSA复合物更稳定。
烯唑醇与BSA的氨基酸残基间存在氢键和疏水相互作用。R-烯唑醇和S-烯唑醇与BSA作用的对接能量分别为-27.6 kJ/mol和-23.3 kJ/mol,说明R-烯唑醇与BSA的结合更稳定。

表2 HSA-烯唑醇和BSA-烯唑醇复合物的分子对接参数Table 2 The molecular docking parameters for binding between HSA- and BSA-diniconazole complexes
3 结论
采用UV-Vis吸收光谱、荧光光谱和分子对接技术研究了烯唑醇对映体与血清蛋白的结合差异。血清蛋白与烯唑醇结合时表现出立体选择性,与R-烯唑醇的结合更强。加入烯唑醇后,血清蛋白的构象发生改变,其特征吸收峰蓝移,荧光猝灭。分子对接的结果表明R-烯唑醇和S-烯唑醇与HSA和BSA之间的作用力主要是范德华力和氢键。研究结果为进一步研究烯唑醇在生物体内的代谢和降解行为提供了理论参考。

