分子动力学模拟探索乳克鲁维酵母来源的β-半乳糖苷酶热变性条件
曹 锟, 王若男, 熊兴东, 吴 赟*, 刘新光*
(1. 广东医科大学广东省医学分子诊断重点实验室/衰老研究所/生物化学与分子生物学研究所, 东莞 523808; 2. 广东医科大学科研平台服务管理中心, 东莞 523808)
β-半乳糖苷酶是一类能够水解半乳糖苷键的糖苷酶,通常由4个亚基组成四聚体,一般可催化乳糖分解为一分子的葡萄糖和一分子的半乳糖[1-3]。该酶广泛存在于动植物、微生物体内,目前已经发现不同来源的β-半乳糖苷酶具有较高的序列同源性和结构相似性,表明该酶的保守性较高[4-5]。近年来,该酶在蛋白质工程、酶工程和食品工业方面的用途越来越广泛。β-半乳糖苷酶在食品加工方面的应用主要包括以下3个方面:(1)食品级的β-半乳糖苷酶已被广泛生产应用,这有利于解决世界上约70%~90%的成年人体内由于缺乏该酶而导致的乳糖不耐受问题;(2)该酶能导致乳糖的水解并显著提高乳制品的甜度,将该酶应用在食品生产加工方面能够减少甜味剂的用量,降低生产成本;(3)该酶能降解细胞壁多糖并释放出游离的半乳糖,进而加快植物乙烯的生成,最终促进果蔬软化和成熟[6-8]。
鉴于β-半乳糖苷酶作为食品添加剂具有上述几个重要作用,因此,探索该酶的生物活性与温度的关系具有一定的意义,进一步确定该酶的最适酶解温度及热变性条件能够为食品加工领域提供理论基础[9-10]。然而,考虑到工业应用价值及其安全性,目前只有微生物体内的β-半乳糖苷酶是被广泛应用于商业酶源,如乳克鲁维酵母和脆壁克鲁维酵母[11-12]。因此,本研究以乳克鲁维酵母体内的β-半乳糖苷酶为研究对象,针对其1 025个氨基酸残基进行了分子动力学模拟,该模拟体系的难点在于原子总数多、计算量大,本研究将采用显式溶剂模型计算β-半乳糖苷酶的构象变化、热变性温度以及不同温度条件下影响β-D-半乳吡喃糖GAL配体小分子的结合微环境,最终揭示乳克鲁维酵母体内的β-半乳糖苷酶的温度耐受性机制。
1 材料与方法
1.1 分子模拟的条件
本研究中乳克鲁维酵母体内的β-半乳糖苷酶结构(code:3ob8)来自于Protein Data Bank(PDB)蛋白质数据库(http:∥www.rcsb.org/)。通过Gromacs 2020.4软件构建了4个独立的模拟体系,即温度条件分别被设置为35、50、65、80 ℃,对应的开尔文单位为308.15、323.15、338.15、353.15 K,接下来对该酶1 025个氨基酸残基分别进行总时长为 50 ns的分子动力学模拟。选择这4个温度的依据分别是:35 ℃为生物体的最适生长温度,可代表正常状态下的β-半乳糖苷酶;50~65 ℃是经过预实验测试的大致变性起始温度,也是大多数蛋白比较常见的开始发生变性的温度区间[13-15];80 ℃是能使自然界大多数蛋白趋于完全变性状态的温度[16-17],本研究以此温度作为该酶在乳克鲁维酵母体内可能的完全变性条件。采用Gromos43a1分子力场、SPC水模型,并将该酶的晶体构象放置于立方周期盒子中作为起始构象,设定其与盒子的边界最小距离为1.0 nm,模拟系统的周期性边界条件适用于X、Y、Z3个方向。为了中和蛋白体系的电荷,在体系中加入0.15 mol/L NaCl盐溶液。采用蛙跳算法计算每个原子的运动,以粒子网格算法(Particle Mesh Ewald)计算静电相互作用能量[18]。接下来,通过最速下降法进行400步能量最小化,并对每个模拟体系进行总时长为50 ps的位置约束模拟。正式动力学模拟的初速度被设定为随机初始速度。
1.2 模拟结果的分析
首先,采用Gromacs 2020.4软件的gmx rms、gmx gyrate、gmx rmsf和gmx sasa工具分别计算了蛋白的均方根误差(Root Mean Square Deviation,RMSD)、回旋半径(Radius of gyration,Rg)、溶剂可及表面积(Solvent Accessible Surface Area,SASA)以及每个氨基酸残基的α-C的均方根波动值(Root Mean Square Fluctuation,RMSF),并通过VMD-1.9.1可视化软件观测4个不同模拟轨迹中蛋白构象的变化。然后,参考文献[18-21],用gmx distance工具测量了β-半乳糖苷酶的底物——GAL糖分子结合位点残基之间的距离,并分别采用Origin8.5 和 PyMOL 软件绘制图形及结构图。
2 结果与分析
2.1 β-半乳糖苷酶的三维结构概况
乳克鲁维酵母体内的β-半乳糖苷酶的结构是由4个相同亚基组成的同源四聚体,每个亚基由1 025个氨基酸残基组成,其相对分子质量约为118 500。三维构象的主要特点是多数β-折叠区域暴露在蛋白表面,而α-螺旋则位于蛋白中心区域(图1A),这一特征与大多数蛋白的结构特点呈相反状态。GAL糖分子、Mg2+和Mn2+离子的主要结合位点位于α-螺旋之中,β-折叠则对蛋白骨架的稳定起关键作用。在模拟体系中添加了水分子和NaCl盐离子,能量优化后的立方体盒子参数x、y、z均为13.992 78 nm(图1B),展示了该蛋白的立方体模拟体系。
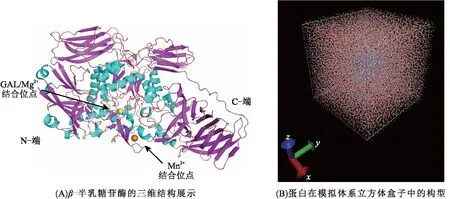
图1 β-半乳糖苷酶结构及其模拟体系构型展示
2.2 蛋白整体构象变化的原子表述
为了监测蛋白平衡状态的构象与原始结构之间的平均偏差,采用RMSD来评价体系是否达到平衡状态。由图2A可知:35 ℃时,β-半乳糖苷酶最先达到平衡状态,对应的RMSD也是最低的,约为0.35 nm;50 ℃时,β-半乳糖苷酶的RMSD升高较为明显,并且该酶未达到平衡状态,结合文献[22]的结果:β-半乳糖苷酶的熔解温度大约为51 ℃,因此,判断50 ℃大致可以代表该酶的熔解温度临界值,而该酶在50 ℃条件下的模拟结果则能够代表其在熔解温度时的各项指标;65 ℃和80 ℃时,β-半乳糖苷酶的RMSD的最大值大于0.51 nm,在50 ns内无法达到平衡状态,说明这2个温度条件下的蛋白结构非常不稳定,已经发生了变性,故将65 ℃和80 ℃定义为变性条件。SURVE和MAHONEY[22]已证实β-半乳糖苷酶的熔解温度大约为51 ℃,因此,本研究设置的模拟条件中的50 ℃能够代表该酶的熔解温度。
RMSF的变化能够评价蛋白质碳骨架的每个原子相对于其平均位置的涨落,由此可以判断不同温度时蛋白的变性程度。由图2B可知:35 ℃时,β-半乳糖苷酶对应的RMSF最低,此时的蛋白具备正常的酶活力,则将35 ℃的结果视为正常值;80 ℃时,β-半乳糖苷酶有大量氨基酸残基的RMSF远高于正常值且呈现剧烈的波动,说明蛋白质碳骨架在变性状态下的不稳定性增加。这些结果说明高温将导致该酶的空间结构被破坏。
蛋白质碳骨架的回旋半径随模拟时长的变化能够代表结构的松散程度。由图2C可知:经过50 ns的模拟,35 ℃时β-半乳糖苷酶对应的α-C的Rg平均值约为 3.20 nm;在50 ℃、65 ℃时,该酶对应的α-C的Rg平均值分别为 3.24、3.23 nm,这表明当处于熔解温度临界值(50 ℃)时,该酶的结构开始改变;80 ℃时,该酶的氨基酸残基呈现出刚性,大量的成键已被破坏,对应的α-C的Rg平均值为3.32 nm。这些结果表明,乳克鲁维酵母体内的β-半乳糖苷酶从50 ℃开始呈现不同程度的变性,当温度升高至80 ℃时,蛋白构象已经趋于完全变性的状态。
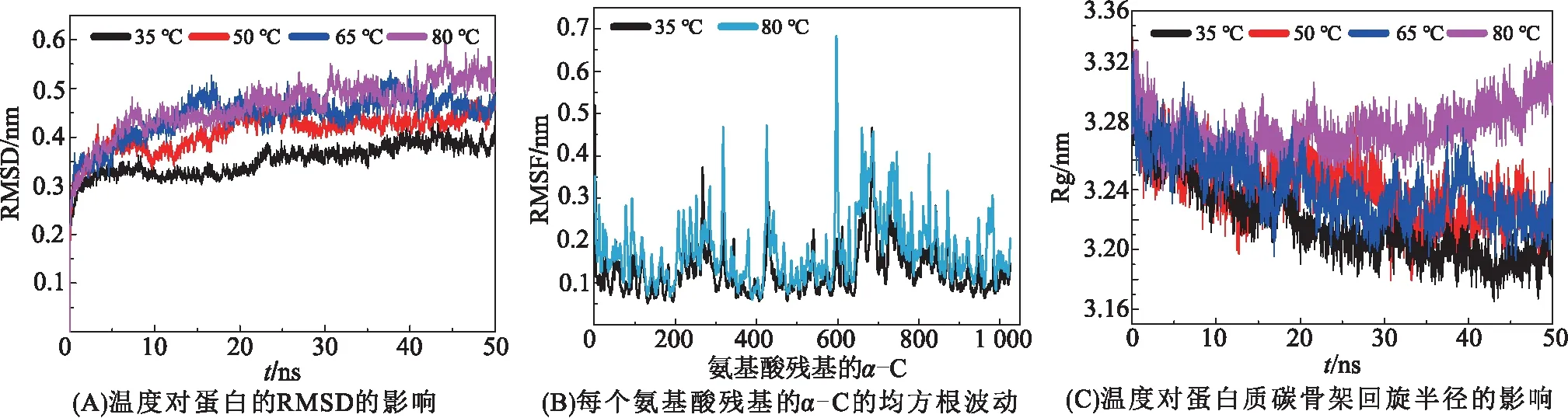
图2 模拟过程中β-半乳糖苷酶整体的波动性展示
2.3 蛋白构象的溶剂可及表面积
由蛋白整体的SASA随着时间变化情况(图3A)可知:经过50 ns的模拟,35 ℃时的SASA平均值为383.58 nm2,达到β-半乳糖苷酶的熔解温度(50 ℃)时则升高到 388.52 nm2,更进一步证实了50 ℃为变性起始温度。而在变性条件(65 ℃、80 ℃)下对应的SASA平均值分别为386.1、386.57 nm2。这些数据的变化趋势与RMSD、Rg的变化趋势保持一致,表明当大于50 ℃后,蛋白将发生不可逆的变性。将GAL结合位点残基Asn-88、Asp-187、His-389、Glu-414、His-416、Asn-481、Glu-482、Glu-551、His-554和Asp-623归为一个组,并统计了该组对应的SASA平均值。与35 ℃时的SASA平均值(17.82 nm2)相比,80 ℃时的GAL的结合位点的SASA平均值高达19.34 nm2(图3B)。这些结果表明,高温促使GAL的结合位点残基被暴露在蛋白表面,这与正常状态下的GAL活性中心被包埋在蛋白骨架之中相矛盾,故可判断高温导致的变性残基不利于GAL的结合。
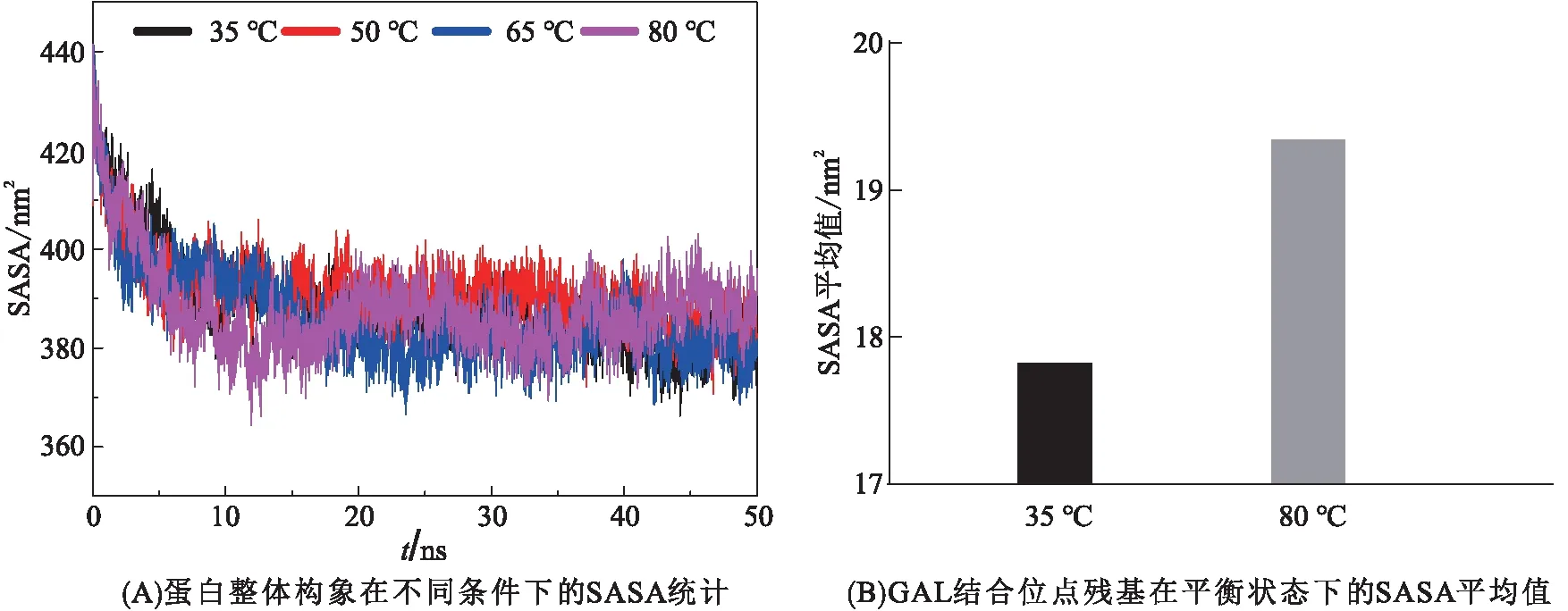
图3 温度对β-半乳糖苷酶溶剂可及表面积的影响
2.4 35 ℃和80 ℃条件下β-半乳糖苷酶二级结构变化以及GAL的结合能力
为了鉴定β-半乳糖苷酶在正常条件与变性条件下的二级结构变化,采用do_dssp插件解析了蛋白二级结构各组分的含量[23]。与35 ℃时的结果相比,80 ℃时β-半乳糖苷酶的二级结构出现较大的改变(图4A、B):35 ℃时平均有358个氨基酸残基形成β-转角,269个氨基酸残基参与形成无规卷曲;然而在80 ℃时,平均有333个氨基酸残基形成β-转角,287个氨基酸残基参与形成无规卷曲。这些数据说明,高温会导致β-半乳糖苷酶中一部分氨基酸残基由β-转角转化为无规卷曲,从而改变二级结构各组分的含量占比并破坏了蛋白质结构的稳定性,最终使酶丧失生物活性。
因此,上述分子模拟的数据进一步证实温度过高会导致β-半乳糖苷酶变性。接下来,研究了GAL糖分子的结合位点残基Asn-88、Asp-187、His-389、Glu-414、His-416、Asn-481、Glu-482、Glu-551、His-554和Asp-623的空间成键并测量了残基之间的空间距离。结果(图4C、D)表明:35 ℃时的β-半乳糖苷酶内部依靠约13个氢键紧密结合GAL糖分子,而与之形成鲜明对比的是,80 ℃时的结合位点残基对之间的空间距离变大,这种现象是由于结合位点残基被暴露在蛋白表面而造成的,表现在Asn-88与Glu-551、Asp-623与Glu-482、His-554与His-416的距离分别为1.40、1.77、1.62 nm,空间距离越大越不利于GAL的结合,即β-半乳糖苷酶失去了催化β-D-半乳吡喃糖的功能。
3 小结
本研究采用分子动力学模拟的计算方法研究β-半乳糖苷酶的温度耐受性,分析并揭示了不同温度条件对该酶稳定性及酶活性产生的影响。结果表明:β-半乳糖苷酶在35 ℃时的蛋白结构及氨基酸波动性比较稳定;当温度升高至50 ℃,β-半乳糖苷酶的Rg和SASA均增大,说明蛋白结构逐渐失去柔性,该蛋白二级结构各组分的含量占比也会随之改变。这与SURVE等[11]报道的β-半乳糖苷酶的熔解温度约为51 ℃的结论相一致。更重要的是,本研究首次报道了当温度高于熔解温度的临界值(50 ℃)时,GAL糖分子的活性中心残基将会暴露在蛋白表面,这将导致β-半乳糖苷酶丧失催化GAL的能力,进一步造成该酶无法降解细胞壁多糖、无法解决人体的乳糖不耐受等关键问题。因此,在乳制品发酵、催熟果蔬软化及增加甜度、饲料加工等方面,必须严格控制温度低于50 ℃,以确保β-半乳糖苷酶的活性。总之,本研究在原子水平上探索了β-半乳糖苷酶的熔解温度临界值,揭示了β-半乳糖苷酶活性及温度耐受性等关键信息,为相关的食品生产加工以及发酵提供理论支持,具有一定的工业应用价值。
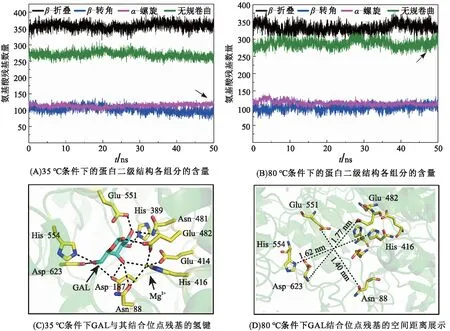
图4 温度对β-半乳糖苷酶二级结构及其与GAL分子结合能力的影响

