非酒精性脂肪性肝病患者血清同型半胱氨酸、叶酸及维生素B12水平变化的临床意义
施春晶 吕俊衍 张 丹 文 玉 罗粟风 普光宇 李明珂 陈 杭 马岚青
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗、肥胖和代谢综合征密切相关的代谢性疾病,目前已成为全球范围内慢性肝病的常见病因,全球患病率约为25%且呈升高及低龄化趋势[1-2]。NAFLD 已逐渐成为肝细胞癌和终末期肝病的主要病因,预测其将成为肝移植的常见适应证[3]。随着生活方式的改变和肥胖的流行,中国的NAFLD 患病率亦逐年升高,每年新发病例约占4%[4]。因此,对NAFLD 预防和治疗的研究显得十分重要。
同型半胱氨酸(Hcy)是一种非必需α-氨基酸,是蛋氨酸甲基化反应生成的重要中间产物。肝脏能分解代谢饮食中的大部分蛋氨酸,85%的Hcy转硫作用在肝脏进行,因此肝脏是Hcy 的重要代谢器官,Hcy 代谢异常可导致高同型半胱氨酸血症(HHcy)[5]。叶酸是由蝶啶、对氨基苯甲酸及谷氨酸残基组成的一种水溶性B 族维生素,机体自身不能合成,需通过外源性补充。饮食中的叶酸经二氢叶酸还原酶先转化为二氢叶酸,然后转化为四氢叶酸(THFA),再通过维生素B6、维生素B12和甜菜碱共同作用的一系列酶反应转化为5-甲基四氢叶酸(5-MTHF),作为甲基供体参与蛋氨酸循环[6]。维生素B12主要通过饮食获取,其是甲基化过程中的重要辅助因子,参与蛋氨酸、胸腺嘧啶等的合成[7]。叶酸和维生素B12是Hcy 代谢途径所必需的辅助因子,可影响血清Hcy 水平。研究显示NAFLD 患者的血清Hcy 水平通常显著升高,HHcy可能是NAFLD 发病的危险因素[8]。目前HHcy 诱发NAFLD 的机制尚未明确,亦无特异性检查方法和有效药物用于NAFLD 的早期诊断和治疗。本研究探究了NAFLD 患者的血清Hcy、叶酸和维生素B12水平的变化及其临床意义,以期为NAFLD 的预防和治疗提供新思路。
1 资料与方法
1.1 一般资料
选择2017 年5 月至2018 年12 月在昆明医科大学第一附属医院体检中心接受无创肝纤维化诊断系统FibroTouch 检查的199 名体检者作为研究对象。纳入标准:(1)无饮酒史,或男性每周摄入乙醇<140 g、女性每周摄入乙醇<70 g);(2)入组前1 年内未曾服用叶酸、B 族维生素、茶碱,以及激素、甲氨蝶呤、四环素、他莫昔芬、抗结核药物等可影响血清Hcy 水平和导致肝脂肪变性的药物;(3)无病毒性肝炎、药物性肝炎、自身免疫性肝病、肝豆状核变性、糖原贮积病等导致NAFLD 的疾病;(4)无严重心、脑、肺、肾等器官疾病和严重神经、精神疾病。本研究经医院医学伦理委员会审核批准[(2021)伦审L 第4 号],所有受试者均签署知情同意书。
1.2 方法
1.2.1 收集临床资料 收集受试者的年龄、身高、体质量、腹围资料。计算体质指数(BMI):BMI=体质量(kg)/身高(m)2。
1.2.2 血清学指标检测 受试者于抽血前一晚开始禁食、禁饮12 h,于次日清晨抽取4 mL 空腹肘静脉血,采用循环酶法检测血清Hcy 水平(正常值范围5~15 μmol/L),免疫化学发光法测定血清叶酸(正常值范围5.38~20 ng/mL)、维生素B12水平(正常值范围211~911 pg/mL)。1.2.3 肝脏FibroTouch 检查 使用FibroTouch 仪器及配套设施(购自无锡海斯凯尔医学技术有限公司)对受试者肝脏行脂肪衰减参数(FAP)和肝脏硬度(LSM)测定,由具有操作资格证书的医生参照FibroTouch 用户手册[9]定人定机完成。测量时患者取仰卧位,右手置于脑后,身体略向左侧弯曲以最大限度扩展肋间隙,选择右侧腋前线至腋中线第7 至第9 肋间隙为检测区域,保持探头与体表垂直,避开血管、囊肿、结节等可能干扰检测准确率的部位。每例受试者至少进行10 次有效测量,取有效测量结果的中位数为最终结果(检测偏差值≤中位数的33%且成功率≥60%为有效测量)。1.2.4 分组标准 参照FibroTouch 用户使用手册[9],采用FAP 值评价肝脏脂肪变程度:FAP≤240 dB/m为 正 常;240 dB/m<FAP≤265 dB/m 为 轻 度;265 dB/m<FAP≤295 dB/m 为中度;FAP>295 dB/m为重度。依据《瞬时弹性成像技术诊断肝纤维化专 家 共 识(2018 年 更 新 版)》[10]和METAVIR 纤维化评分系统[11],采用LSM 值评价NAFLD 组的肝纤维化程度:LSM<6 Kpa 为F0 级;6 Kpa≤LSM<7 kPa 为F1 级;7 kPa≤LSM<7.9 kPa 为F2 级;7.9 kPa≤LSM<10.3 kPa 为F3 级;LSM≥10.3 kPa 为F4级。本研究根据FAP 值将受试者分为健康对照组(55例)和NAFLD 组(144 例),再将NAFLD 组分为轻度、中度和重度肝脂肪变性组(39 例、46 例、59 例),根据LSM 值分为NAFLD 非肝纤维化组(F0 级70 例)和NAFLD 合并肝纤维化组(F1 级及以上74 例)。
1.3 统计学分析
数据应用SPSS 20.0 软件进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,相关性分析采用Pearson 直线相关分析,NAFLD 危险因素分析采用多因素logistic 回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 NAFLD 组与健康对照组的一般资料比较
与健康对照组相比,NAFLD 组的腰围明显增加,BMI 和血清Hcy 水平明显升高,血清维生素B12水平明显降低,差异均有统计学意义(P均<0.05)。两组男女比例的差异有统计学意义(P<0.001)。两组年龄和血清叶酸水平的差异均无统计学意义(P均>0.05)。见表1。

表1 NAFLD 组与健康对照组的观察指标比较
2.2 轻度、中度和重度肝脂肪变性组的血清学指标比较
3 组的血清Hcy、叶酸和维生素B12水平差异均无统计学意义(P均>0.05),提示血清Hcy、叶酸和维生素B12均不能作为NAFLD 患者肝脂肪变性严重程度的评价指标。见表2。
2.3 NAFLD 非肝纤维化组与NAFLD 合并肝纤维化组的血清学指标比较
两组的血清Hcy、叶酸和维生素B12水平差异均无统计学意义(P均>0.05),提示血清Hcy、叶酸和维生素B12均不能作为NAFLD 是否合并肝纤维化的评价指标。见表3。
2.4 NAFLD 及NAFLD 合并肝纤维化的危险因素分析
分别对NAFLD 组与健康对照组、NAFLD 非纤维化组与NAFLD 合并肝纤维化组的数据进行多因素Logistic 回归分析, 以是否诊断为NAFLD、NAFLD 是否合并肝纤维化为应变量, 将变量血清Hcy、叶酸和维生素B12水平纳入方程进行分析,结果显示血清Hcy 和维生素B12为NAFLD 的危险因素(P均<0.05),而血清叶酸不是NAFLD 的危险因素(P>0.05),血清Hcy、叶酸和维生素B12均不是NAFLD 合并肝纤维化的危险因素(P均>0.05)。见表4。

表2 轻度、中度和重度肝脂肪变性组的血清学指标比较(x±s)

表3 NAFLD 非肝纤维化组与NAFLD 合并肝纤维化组的血清学指标比较(x±s)
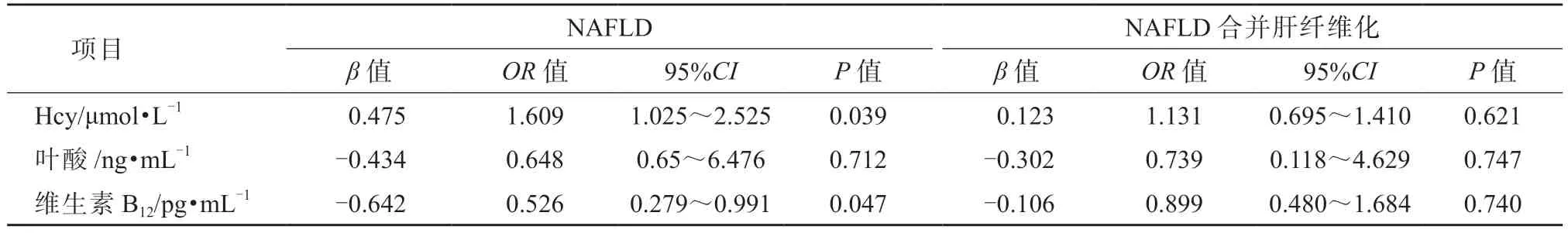
表4 NAFLD 及NAFLD 合并肝纤维化的危险因素的logistic 回归分析
2.5 血清Hcy 水平与血清叶酸、维生素B12水平的相关性分析
Pearson 直线相关分析显示,健康对照组的血清Hcy 水平与血清叶酸、维生素B12水平无明显相关性,NAFLD 组的血清Hcy 水平与血清叶酸、维生素B12水平呈直线负相关。见图1。

图1 NAFLD 组的血清Hcy 与血清叶酸、维生素B12的相关性分析 A 血清Hcy 水平与血清叶酸水平 B 血清Hcy水平与血清维生素B12水平
3 讨论
NAFLD 是一种存在个体差异性的代谢性疾病,其病因、发病机制和自然转归方面均具有高度异质性。NAFLD 的发生受饮食、遗传、肠道微生物变化、合并疾病和代谢状态等多种因素相互作用的影响[12]。摄入的食物及其代谢产物与NALFD 的发生密切相关,调整饮食等非药物干预方法可能可以作为NAFLD 防治的重要措施[13]。
国内外研究显示,血清Hcy 水平在NAFLD 患者中普遍升高,HHcy 可能是NAFLD 发生、发展的独立危险因素[14-15]。血清Hcy 水平升高可导致肝组织炎性细胞浸润,可诱导氧化应激反应,造成肝细胞损伤,血清Hcy 水平与肝纤维化及肝细胞损伤的严重程度密切相关[16]。此外,血清Hcy水平升高还可诱导内质网应激上调胆固醇调节元件结合蛋白(SREBP)的表达,增加胆固醇合成及活化腺苷酸活化蛋白激酶(AMPK),进而激活脂肪酸氧化并抑制脂肪酸合成,使肝脏内脂肪过量沉积而发生肝脂肪变性,从而引发NAFLD[17]。上述研究提示,血清Hcy 水平与NAFLD 密切相关,血清Hcy 水平升高可能可以作为NAFLD 发生、发展的预测指标。本研究结果也显示,NAFLD 患者的血清Hcy 水平较健康人群明显升高,其可能在NAFLD 的发病中起着一定的作用。
Hcy 在机体的主要代谢方式是通过叶酸依赖途径重新甲基化生成蛋氨酸,或通过胱硫醚-β-合成酶转化为胱硫氨酸[18]。Hcy 再甲基化过程中,5,10-亚甲基四氢叶酸还原酶(MTHFR)在维生素B12参与下催化5,10-亚甲基四氢叶酸盐(5,10-MTHF)还原为5-MTHF,蛋氨酸合成酶(MS)以维生素B12为辅助因子,5-MTHF 提供甲基供体催化Hcy 再甲基化,使甲基从5-MTHF 转移到Hcy中,形成新的蛋氨酸,用于蛋白质合成或转化为S-腺苷同型半胱氨酸(SAH),SAH 可通过SAH 水解酶可逆地转化为Hcy[19]。由此可见,叶酸是重要的甲基供体,维生素B12是甲基转移酶的重要辅助因子,血清Hcy 与血清叶酸、维生素B12之间呈负相关。本研究结果也显示,NAFLD 患者的血清Hcy 水平与血清叶酸、维生素B12水平呈直线负相关。体内血清Hcy 水平主要受遗传和饮食等因素影响,遗传因素是MTHFR 基因突变导致酶活性降低,饮食因素是膳食中缺乏叶酸和维生素B12[20]。当叶酸和维生素B12缺乏或利用障碍时可阻碍Hcy再甲基化途径,导致血清Hcy 水平升高进而参与NAFLD 的发生。Dai 等[17]的研究显示NAFLD 患者的血清Hcy 水平升高,伴有血清叶酸和维生素B12水平降低,HHcy 是导致NAFLD 的独立危险因素。本研究结果显示,与健康对照组相比,NAFLD 组的血清Hcy 水平升高,血清维生素B12水平降低,两者是NAFLD 的危险因素,这与上述研究相符。外源性补充叶酸、维生素B12可使Hcy 再甲基化重新合成蛋氨酸,从而降低血清Hcy 水平,这可能可以减轻肝细胞损伤,抑制肝细胞的脂质合成,缓解肝脂肪变性。
研究表明,Hcy 与心脑血管疾病、2 型糖尿病等多种疾病有关,HHcy 已被证明是冠心病、原发性高血压的独立危险因素,叶酸联合维生素B12治疗可有效降低慢性心血管疾病合并HHcy 患者的血清Hcy 水平,减少心血管不良事件的发生[21]。NAFLD 是一种多系统疾病,可影响肝外多器官的代谢调节,增高2 型糖尿病、心血管疾病的发生风险[22]。高血清Hcy 水平可促进血管平滑肌细胞增殖,可诱导血管内皮功能障碍及炎性细胞因子产生从而诱发炎性反应,并可促进血小板聚集和抑制纤溶作用导致微血栓形成,这些机制均有助于动脉粥样硬化斑块形成,共同促进了心血管不良事件的发生[23-24],故HHcy 可能是预防NAFLD 并发心血管不良事件的有效靶点。
有研究表明血清叶酸和维生素B12水平与NAFLD 的严重程度密切相关[25-26]。Mahamid 等[27]的研究显示低血清叶酸和维生素B12水平与较高的非酒精性脂肪性肝炎(NASH)组织病理学分级显著相关。Bertol 等[28]的研究发现,高血清维生素B12水平与肝脂肪变性及纤维化的严重程度呈正相关。然而,本研究结果显示血清Hcy、叶酸和维生素B12均不能作为NAFLD 患者肝脂肪变性严重程度及是否合并肝纤维化的评价指标,与上述研究结论不符,推测原因可能是:(1)NAFLD 的发生、发展受多种因素的共同影响,NAFLD 患者可能会改变饮食习惯,导致血清Hcy、叶酸和维生素B12水平发生了变化;(2)目前NAFLD 的发病机制尚未完全明确,尚无临床指南推荐或限制相关维生素的摄入以预防NAFLD;(3)本研究结果可能存在偏倚,今后可进行前瞻性研究来验证。此外,本研究还显示NAFLD 组与健康对照组的男女比例存在差异(P<0.001),NAFLD 组的男性占比高于女性。Della Torre[29-30]的研究也显示男性患NAFLD 的风险较女性高,这可能与雌激素水平、免疫反应和肝脏代谢的性别特异性调节等因素相关。
综上所述,本研究显示NAFLD 患者的血清Hcy 水平高于健康人群,血清维生素B12水平低于健康人群,临床上对NAFLD 患者进行血清Hcy、叶酸和维生素B12水平的监测具有重要临床意义。外源性补充叶酸和维生素B12可有效降低血清Hcy水平,这可能成为NAFLD 防治的新策略。个体化补充叶酸和维生素B12是否能有效降低NAFLD 合并HHcy 患者的血清Hcy 水平,进而抑制NAFLD进展,有待进一步的临床研究。

