IL-34 基因敲除对小鼠肠黏膜通透性的影响
丁 琴 李文文 刘 渊
IL-34 是集落刺激因子-1 受体(CSF-1R)的组织特异性配体,存在于包括鱼类、两栖动物、鸟类和哺乳动物等在内的所有脊椎动物中,是一种新型细胞因子。IL-34 作为IL 家族中的一个新成员,在疾病诊断和治疗中具有特殊的生理功能和重要的病理作用,并有广阔的临床应用前景。研究发现,IL-34 与风湿性关节炎、炎症性肠病(IBD)和干燥综合征等疾病的炎性反应过程有关[1-2]。IL-34 在IBD 患者和实验性结肠炎患者中高表达,并且其表达水平随炎性反应程度的加重而升高[3]。
在多细胞动物中,肠黏膜是宿主与共生菌群相互作用的主要场所。肠黏膜屏障是哺乳动物与肠道细菌共同进化形成的一种高度特异分化的黏膜。它由物理和化学成分构成,可以满足肠道对营养物质消化和吸收的需求,维持宿主与共生菌群和平共存,同时保护机体免受感染。由营养不良、感染或其他疾病引起的肠黏膜屏障功能紊乱,会导致肠黏膜通透性增高[4]。研究表明,肠黏膜通透性增高与多种消化系统疾病有关,如IBD、肠易激综合征、腹腔疾病和早期结肠癌等[5]。
肠上皮作为防御肠道病原微生物的物理屏障,在黏膜免疫系统尤其是天然免疫中具有重要作用。天然免疫信号通路可维持组织和器官的内稳态,如肠道微生物群、肠上皮细胞的增殖和凋亡及肝再生等[6-7]。肠上皮提供了一种选择性的、可渗透的屏障,可以调控肠黏膜通透性,其作用主要是通过细胞间的紧密连接结构来实现的。紧密连接蛋白复合物由跨膜蛋白和细胞内支架蛋白组成,ZO-1 和Occludin 是主要的跨膜蛋白[8]。
本研究观察了IL-34 基因敲除后小鼠肠黏膜通透性的变化情况,并探讨了相关机制,以期进一步了解肠道的免疫调控机制,为探索肠黏膜屏障受损相关疾病的潜在治疗靶点提供实验依据。
1 材料和方法
1.1 实验动物和细胞
选取20 只6 周龄、SPF 级、雄性的C57BL/6 野生型(WT)小鼠(购自上海斯莱克实验动物有限责任公司)作为研究对象。每笼5 只,饲养于南通大学实验动物中心,室温保持在21~23 ℃,湿度为50%~60%,12 h 光照和12 h 黑暗交替环境,自由进食、饮水。经适应性喂养7 d 后,采用随机数表法将小鼠分为WT 组(WT 小鼠)和KO 组(IL-34-/-小鼠,由北京华夏凯奇公司设计并敲除),每组10 只。实验期间每周测量和记录两组小鼠的体质量。实验过程中无小鼠死亡。Caco-2 细胞购自上海中国科学院细胞库并保存于-80 ℃冰箱。
1.2 方法
1.2.1 肠道通透性测定 两组小鼠均于第14 周称重后禁食14 h,然后给予0.2 mL 异硫氰酸荧光素标记的葡聚糖(FITC-dextran,60 mg/100 g)灌胃,灌胃后4 h,通过心脏穿刺取血0.8~1.0 mL[9]。采用FITC标记法检测小鼠肠道通透性。取小鼠血样在4 ℃下以3 000 r/min 离心5 min,获取上层清液。用同体积PBS 溶液稀释后,使用荧光分光光度计检测荧光强度,激发波长为480 nm,发射波长为520 nm。1.2.2 组织病理学检查 采用颈椎脱臼法处死小鼠,迅速取出小鼠远端结肠组织,使用预冷的PBS溶液反复冲洗以去除结肠组织表面残留物(至少冲洗3 遍),快速将结肠组织置于4%多聚甲醛溶液中,常温下固定。经过水洗、常规脱水后石蜡包埋,4 μm 厚度切片,行H-E 染色,光镜下观察结肠黏膜的形态学改变。
1.2.3 实时荧光定量PCR 检测 采用实时荧光定量PCR(real-time qPCR)法检测小鼠结肠组织中ZO-1 和Occuldin 的表达水平。选取两组小鼠的近端结肠样品并保存于RNAlater 溶液中,4 ℃过夜,之后将样品保存于-80 ℃冰箱。使用试剂盒抽提结肠组织RNA,反转录合成cDNA,以cDNA 为模板进行扩增反应,根据Genebank 中目的基因序列设计引物,引物由生工生物工程(上海)有限公司合成,序列见表1。PCR 反应条件:95 ℃预变性10 s,之 后95 ℃ 10 s、60 ℃ 20 s、81 ℃ 1 s,共45 个 循环。以β-actin 作为内参,采用2-ΔΔCt法计算ZO-1和Occuldin 的相对表达量。除培养基,再加入含IL-34(100 ng/mL)的培养基,培养24 h。之后收集各组细胞。
1.2.6 蛋白质印迹法检测ZO-1 和Occuldin 的表达 收集细胞进行蛋白质抽提,行SDS-PAGE 电泳,加入一抗、二抗孵育,1 h 后按照化学发光试剂盒使用说明书进行ECL 化学发光和曝光显影,使用凝胶成像分析系统进行显影和灰度值分析。
1.3 统计学方法

表1 引物序列
1.2.4 免疫组织化学法检测结肠组织ZO-1 和Occuldin 的表达 将结肠组织的石蜡包埋标本切片,常规脱蜡,封闭液封闭10 min,滴加一抗,4 ℃过夜,滴加免疫组织化学检测试剂盒内的试剂Ⅲ,冲洗后再加试剂Ⅳ(按照试剂盒使用说明书进行操作),PBS 反复冲洗,用新鲜配制的DAB 液显色,苏木素复染。光镜下观察ZO-1 和Occuldin蛋白的染色情况。
1.2.5 Caco-2 细胞培养 Caco-2 细胞用含20%胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素的DMEM培养液,在37 ℃、5% CO2及饱和湿度培养箱中培养,每日倒置显微镜观察细胞2 次,隔日更换1 次培养液,待细胞生长至80%密度时开始传代。将Caco-2 细胞传代后铺6 孔板,饥饿处理16~18 h 后随机分为3 组,其中正常对照组不进行处理;IL-34 组加入含IL-34(100 ng/mL)的培养基,培养24 h;CSF-1R 抑制剂组先加入GW2580(100 ng/mL)预处理2 h 后,移
应用SPSS 22.0 软件进行数据分析。计量资料以均数±标准差(x±s)表示,两组间比较采用配对样本t检验,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 敲除IL-34 基因对小鼠体质量的影响
本研究通过连续14 周监测KO 组和WT 组的体质量变化情况,发现两组的体质量变化情况差异无统计学意义(P>0.05)。见图1。
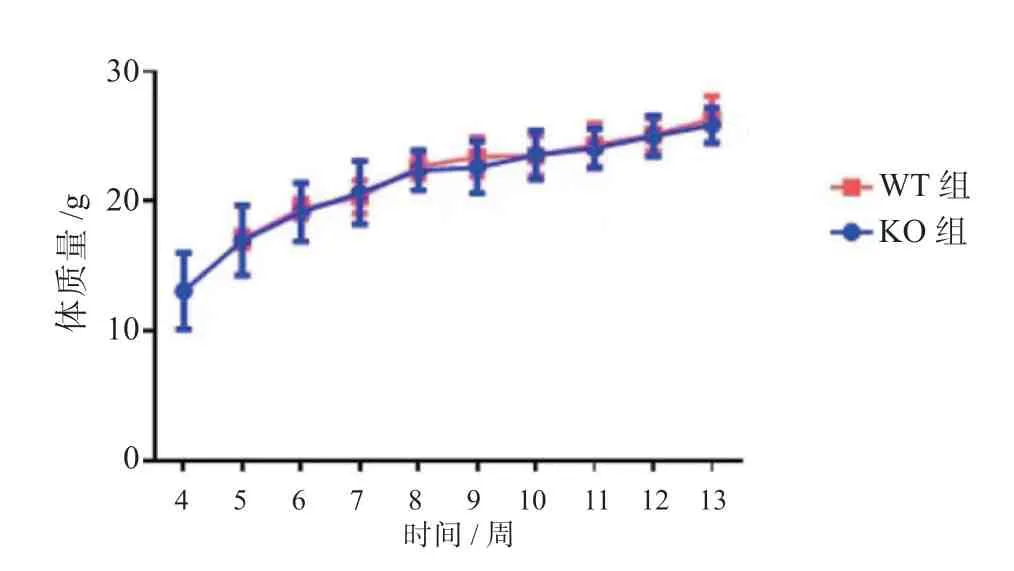
图1 两组小鼠的体质量变化
2.2 敲除IL-34 基因对结肠病理形态学的影响
H-E 染色结果显示,WT 组和KO 组的结肠组织均无明显损伤表现,肠黏膜上皮完整、连续,结肠腺体结构清晰、排列整齐,间质分布均匀,无明显炎性细胞浸润、溃疡、胶原纤维增生等。见图2。
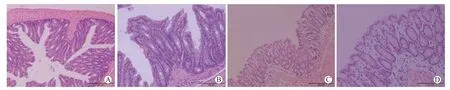
图2 两组小鼠结肠组织的病理图像 H-E 染色 A WT 组 ×200 B WT 组 ×400 C KO 组 ×200 D KO组 ×400
2.3 敲除IL-34 基因对小鼠结肠黏膜通透性的影响
由图3 所示,KO 组的血清FITC-dextran 水平明显高于WT 组,差异有统计学意义(P<0.01),这表明KO 组的结肠黏膜通透性较高。
2.4 敲除IL-34 基因对小鼠结肠ZO-1 和Occludin表达的影响
Real-time qPCR 检测结果显示,与WT 组比较,KO 组的结肠组织中ZO-1 mRNA 和OccludinmRNA的相对表达量均显著降低,差异均有统计学意义(P均<0.05),见图4。免疫组织化学染色结果显示,KO 组结肠组织中ZO-1 和Occludin 的表达水平均较WT 组显著降低(P均<0.05),见图5。
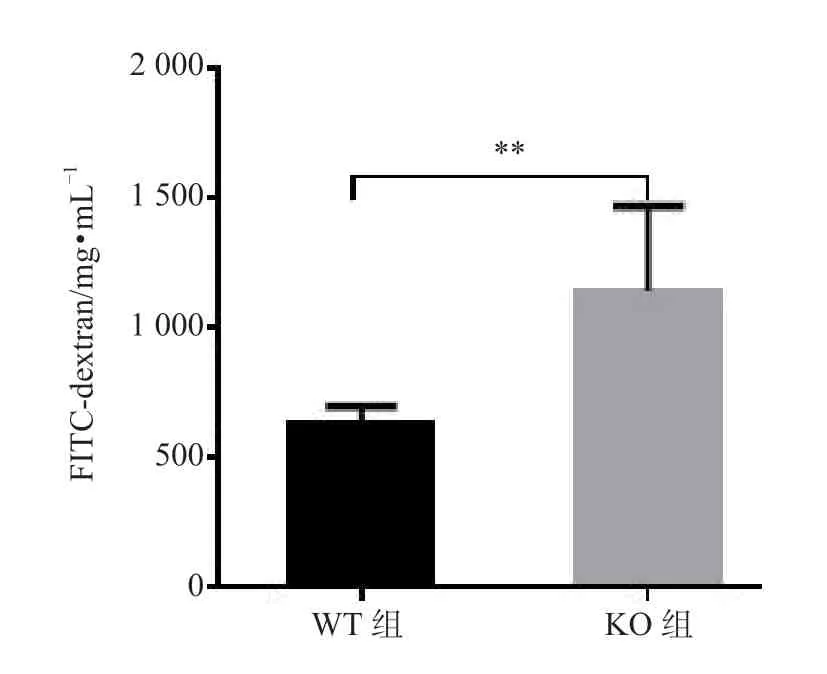
图3 两组小鼠的血清FITC-dextran 表达水平
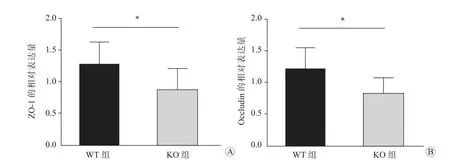
图4 两组小鼠结肠组织中ZO-1 mRNA 和OccludinmRNA 的相对表达量 A 两组的ZO-1 mRNA 相对表达量 B 两组的OccludinmRNA 相对表达量
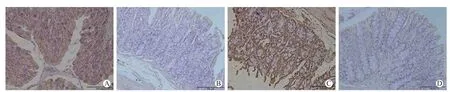
图5 两组小鼠结肠组织中ZO-1 和Occludin 的表达水平 免疫组织化学染色 ×400 A WT 组的ZO-1 表达水平 B KO 组的ZO-1 表达水平 C WT 组的Occludin 表达水平 D KO 组的Occludin 表达水平
2.5 上 调IL-34 对Caco-2 细 胞ZO-1 和Occludin 表达的影响
蛋白质印迹法结果显示,与正常对照组比较,IL-34 组Caco-2 细 胞ZO-1 和Occludin 的 表 达 水 平均升高,差异均有统计学意义(P均<0.05);CSF-1R 抑 制 剂 组Caco-2 细 胞ZO-1 和Occludin 的 表 达水平与正常对照组比较,差异均无统计学意义(P均>0.05)。见图6。
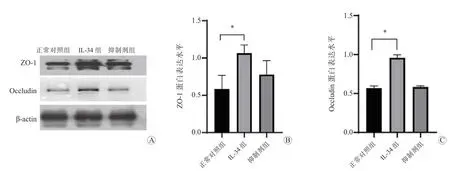
图6 各组Caco-2 细胞中ZO-1 和Occludin 的表达 A 各组ZO-1 和Occludin 蛋白电泳图 B 各组ZO-1 蛋白的表达水平 C 各组Occludin 蛋白的表达水平
3 讨论
肠黏膜屏障是一个复杂的防御系统,由外部的“解剖学”物理屏障和内部的“功能性”免疫屏障组成。物理屏障可阻止细菌黏附并调控其对宿主组织的扩散;免疫屏障则能够区分共生菌与病原微生物,负责共生菌的免疫耐受及病原微生物的免疫反应,两者的相互作用可维持肠黏膜的通透性[10-11]。
肠黏膜结构的完整性对于维持正常的肠道通透性是非常必要的。一旦肠黏膜屏障被破坏,肠道通透性增高,使肠腔抗原易于通过屏障,导致肠黏膜发生炎性反应及难以控制的免疫反应。本研究发现,IL-34 基因敲除对小鼠的体质量无明显影响,与WT 组比较,KO 组结肠组织无明显损伤表现,且无明显炎性细胞浸润。本研究利用FITCdextran 评价IL-34 基因敲除对小鼠肠黏膜通透性的影响,结果发现KO 组血清FITC-dextran 水平明显高于WT 组,这提示IL-34 基因敲除可增高肠黏膜通透性。
Caco-2 细胞系统是一种肠道体外模型,可用以评估化学物质穿透肠黏膜屏障的能力,以及研究其转运机制,利用Caco-2 细胞系统进行的药物和化学物质渗透性评价与其在人体内的试验数据有较理想的相关性[12]。紧密连接蛋白的表达或功能改变可能是肠黏膜通透性改变的机制[13]。紧密连接可使水、离子和溶质通过孔隙来调节选择性细胞旁通透性。紧密连接被破坏是造成肠黏膜屏障功能障碍和炎性反应的主要原因。炎性反应时紧密连接的变化可导致肠黏膜屏障功能异常,从而增高肠道通透性[14]。本研究评估了IL-34 基因敲除对ZO-1 和Occludin 表达的影响,结果显示与WT组比较,KO 组结肠组织中ZO-1 mRNA 和OccludinmRNA 的相对表达量显著降低;免疫组织化学结果显示,小鼠结肠组织中ZO-1 和Occludin 在IL-34缺乏时表达下调;此外,体外细胞实验结果表明,IL-34 可上调Caco-2 细胞中ZO-1 和Occludin 的表 达。这些结果提示IL-34 可能通过调节ZO-1 和Occludin的表达而调控肠道通透性,进而改变肠黏膜屏障的功能。
CSF-1R 是一种Ⅲ型高亲和力受体酪氨酸激酶,在髓系祖细胞中表达,可促进其发育、生存、增殖和正常功能,单核吞噬细胞主要依赖于CSF-1R 介导的信号通路[15]。研究显示,IL-34 刺激人单核细胞中ERK1/2 磷酸化的作用被CSF-1R 的特异性抑制剂或中和抗体所阻断,这表明CSF-1R 是IL-34的功能性受体[16]。IL-34 可在多种表达CSF-1R 的细胞中被观察到相应的信号通路激活,如髓系细胞、上皮细胞、内皮细胞、成纤维细胞、神经元和肿瘤细胞[17]。与IBD 合并结肠癌患者比较,CSF-1R基因在IBD 活动期或进展期患者中的表达水平较低[18]。IL-34 对CSF-1R 的刺激作用可导致人单核细胞中细胞外信号调节激酶(ERK)1/2 的磷酸化[17]。根据不同疾病背景及可能涉及的巨噬细胞亚群,抑制CSF-1R 活性可能具有抗炎或促炎作用[19]。本研究在体外细胞实验中发现,经CSF-1R抑制剂预处理及IL-34 刺激后,Caco-2 细胞中ZO-1和Occludin 的表达水平与正常对照组的差异无统计学意义,这表明IL-34 可能通过结合CSF-1R 而调控ZO-1 和Occludin 的表达,从而调节肠黏膜屏障功能。由于IL-34 也可通过与硫酸软骨素的低亲和力相互作用与其他受体结合[20],本研究是否涉及其他信号通路的调控需要进一步验证。
综上所述,IL-34 基因敲除后可能通过下调结肠组织中ZO-1 和Occludin 的表达,增高肠黏膜通透性,导致大量肠道来源的细菌及其产物移位,激活天然免疫系统,而过度活跃的天然免疫反应可能会造成机体肠道微环境紊乱及肠上皮损伤,导致肠道局部炎性疾病的发生,甚至引发系统性疾病。因此,对于这类消化道疾病,调节肠黏膜屏障功能可能是一种新的治疗和预防策略。

