早卵泡期长方案血清黄体生成素低的患者添加重组人促黄体生成素的临床结局研究
黄文娟
(南昌康健生殖医院生殖医学科,江西 南昌 330000)
血清黄体生成素(luteinizing hormone,LH)由垂体分泌产生,女性LH在促卵泡技术的促排卵、孕激素形成及分泌、促进雌激素等方面均可发挥非常重要的作用。近年来,随着体外受精-胚胎移植技术的发展与应用,促排卵方案也得到不断的完善与改进[1]。目前,辅助生殖技术中多采用促性腺激素释放激素激动剂对垂体进行降调,虽然可预防LH 峰提前出现,但由于患者之间存在个体差异,因此,部分患者降调后会出现LH 过低的情况,导致临床妊娠结局不理想。有研究[2]发现,在早卵泡期长方案中为LH 低患者添加重组人黄体生成素(recombinant luteinizing hormone,r-LH)可减少颗粒细胞凋亡,改善卵母细胞及胚胎质量,从而增加卵母细胞的成熟度。基于此,本研究旨在分析早卵泡期长方案LH低患者添加r-LH的临床结局,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月至2020年9月于本院进行早卵泡期长方案促排卵的80例患者的临床资料,根据患者促排卵后是否添加r-LH处理进行分组,其中未添加r-LH处理的40例患者作为对照组,添加r-LH处理的40例患者作为观察组。对照组平均年龄(29.41±3.21)岁;平均不孕时间(4.10±1.28)年;平均卵泡刺激素(follicle stimulating hormone,FSH)(6.23±1.43)IU/L;平均LH(4.35±1.33)IU/L,平均雌二醇(estradiol,E2)(33.45±13.46)μg/L。观察组平均年龄(29.67±3.59)岁;平均不孕时间(4.31±1.47)年;平均FSH(6.32±1.45)IU/L;平均LH(4.42±1.29)IU/L,平均E(233.63±13.41)μg/L。两组临床资料比较差异无统计学意义,具有可比性。本研究经本院医学伦理委员会审核批准。纳入标准:年龄<38岁;均使用早卵泡期长方案治疗;基础窦卵泡数≥6 个。排除标准:存在宫腔粘连、卵巢肿瘤、宫腔粘连、子宫内膜异位症者;流产≥3次者;治疗前3个月服用过避孕药者。
1.2 方法 对照组于患者月经第2~3 天给予其长效促性腺激素释放激素激动剂,给予注射用醋酸曲普瑞林(达菲林,法国Ipsen Pharma Biotech,国药准字H20140298)肌注,每次 3.75 mg,降调30~42 d后,若患者已达到降调标准[3(]无直径>10 mm的卵巢囊肿;FSH<5 IU/L,LH<5 IU/L,E2<50 μg/L;子宫内膜厚度≤5 mm;直径为4~5 mm 的卵泡占比>60%),给予促性腺激素(gonadotropins,Gn)每天75~300 IU/L,启动促排卵周期,直至HCG日。
观察组长效促性腺激素释放激素激动剂及降调后促性腺激素释放激素激动剂的用法用量同对照组,启动促排卵周期后,于周期中后期给患者添加r-LH,(乐芮,德国默克雪兰诺有限公司,规格:75 IU/支)治疗,每天或隔日75 IU,直至人绒毛膜促性腺激素(human chorionicgonadotropin,HCG)注射日。
1.3 HCG日注射标准 当2个主导卵泡直径≥20 mm,且直径≥16 mm的卵泡占直径≥14 mm卵泡的比例≥60%时,根据患者的病情给予10 000 IU的HCG(中国珠海丽珠制药有限公司,国药准字H44020673,2 000IU/支),注射36 h后采用阴道超声穿刺采卵,取卵日给予患者60 mg黄体酮注射液(浙江仙琚制药股份有限公司,国药准字H33020828,规格:1 m∶l20 mg)。受精后第3天或第5~6天选1~2枚优质胚胎进行移植。若患者存在卵巢过度刺激综合征的高危因素,如获卵数>20枚、移植前卵巢最大直径≥7 cm、HCG日注射雌激素≥5 000 μg/L,则进行全胚冷冻,取卵后第2~3次月经来潮时返回医院进行冻胚移植。
1.4 观察指标 ①比较两组降调后的性激素指标,于患者月经来潮第2~5天清晨,取其空腹状态下外周静脉血5 ml,以3 500 r/min 离心10 min,取血清,采用电化学发光法检测FSH、LH、E2及孕酮(progesterone,P)水平。②比较两组HCG 日的LH、P、E2水平及内膜厚度、Gn天数、Gn总量。③比较两组胚胎实验室数据,包括2 原核(pronuclear,PN)PN 受精率、2PN 卵裂率、优胚率、全胚冷冻率。④比较两组妊娠结局,包括种植率、临床妊娠率、抱婴率、早期流产率。
1.5 统计学方法 采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料以“”表示,组间比较采用t检验,计数资料以[n(%)]表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组降调后性激素指标比较 两组降调后FSH、LH、E2水平比较差异无统计学意义,见表1。
表1 两组降调后性激素指标比较()

表1 两组降调后性激素指标比较()
注:FSH,卵泡刺激素;LH,黄体生成素;E2,雌二醇
组别对照组观察组t值P值E2(μg/L)18.02±3.87 17.68±3.91 0.391 0.697例数40 40 FSH(IU/L)3.28±0.53 3.21±0.51 0.602 0.549 LH(IU/L)0.73±0.24 0.67±0.12 0.628 0.595
2.2 两组HCG 日性激素指标、内膜厚度、Gn 天数、Gn 总量比较 观察组LH、E2水平均高于对照组,P水平、Gn总量均低于对照组,差异有统计学意义(P<0.05);两组内膜厚度和Gn天数比较无统计学意义,见表2。
表2 两组HCG日性激素指标及内膜厚度、Gn天数、Gn总量比较()

表2 两组HCG日性激素指标及内膜厚度、Gn天数、Gn总量比较()
注:LH,黄体生成素;P,孕酮;E2,雌二醇;Gn,促性腺激素
组别对照组观察组t值P值Gn总量(IU)2 287.23±361.51 1 821.05±312.45 6.171 0.000例数40 40 LH(IU/L)1.25±0.32 2.41±0.84 8.162 0.000 P(μg/L)0.96±0.23 0.77±0.30 3.179 0.001 E2(μg/L)3 021.61±451.58 3 854.87±462.97 8.149 0.000内膜厚度(mm)12.21±2.46 11.87±2.10 0.665 0.508 Gn天数(d)10.34±1.81 10.58±1.42 0.660 0.512
2.3 两组胚胎实验室数据比较 观察组2PN 受精率、优胚率、种植率均高于对照组(P<0.05);两组2PN卵裂率比较差异无统计学意义,见表3。

表3 两组的胚胎实验室数据比较[%(n/N)]
2.4 两组妊娠结局比较 观察组全胚冷冻率低于对照组,临床妊娠率、抱婴率均高于对照组(P<0.05);两组早期流产率比较差异无统计学意义,见表4
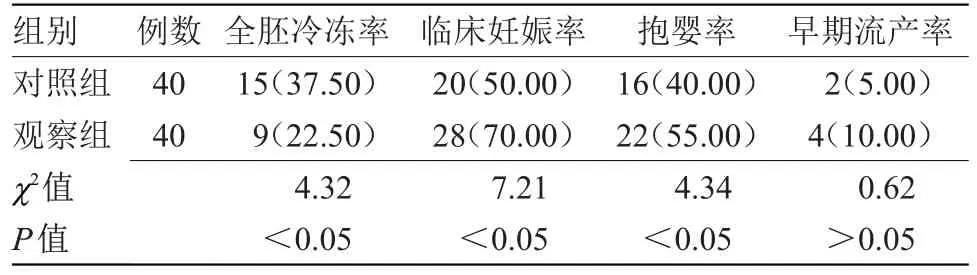
表4 两组妊娠结局比较[n(%)]
3 讨论
垂体前叶分泌的FSH和LH分别在卵巢卵泡颗粒细胞受体、卵泡膜细胞受体中发挥作用,可调控正常卵泡的发育和卵巢类固醇激素的合成。卵泡期,雌激素合成时,LH可为其提供底物(雄烯二酮),直至卵泡发育为中晚期;LH还能刺激主导卵泡颗粒细胞的孕激素受体表达,促进卵泡黄素化和孕激素的生成,使颗粒细胞增殖减缓,此时孕激素可强化雌激素的正反馈作用,使月经中期LH峰值形成[4]。排卵后,孕激素分泌会在LH作用下有所增加,形成黄体期,黄体期的正常维持需要依赖LH。在卵泡发育的早卵泡期开始,体内LH水平必须保持在阈值窗内才可为雌激素的合成提供所需底物,同时与FSH共同作用为卵泡和子宫内膜的正常发育提供保障,最终获得优质卵母细胞及良好的妊娠结局。若早卵泡期体内的LH水平较低,会影响雌激素、雄激素的合成,抑制卵泡发育成熟。LH水平较低会使卵泡内雌激素水平无法满足机体所需,影响卵母细胞的成熟及子宫内膜的容受性;LH水平超出上限值时,会抑制颗粒细胞增殖,发生中、小卵泡停止发育的情况,导致卵泡过早地黄体化,卵母细胞发育受损,妊娠率随之下降,增加流产风险,因此,在早卵泡期保持体内LH水平在适当范围内具有重要意义[5]。
体外受精-胚胎移植中早卵泡期长方案是最常用的促排卵方案,于外源性Gn的情况下进行的。但是由于患者的身体素质存在差异性,部分患者会出现过度抑制LH的情况,导致LH浓度水平较低,雌激素底物的合成减少,卵泡内环境中缺乏雌激素,不利于卵泡的成熟和子宫内膜增生,卵泡成熟时间延长,从而增加Gn用量,降低E2水平、卵子质量、受精率和胚胎质量,进而降低妊娠率[6]。因此,在早卵泡期长方案的促排卵过程中是否添加LH已成为生殖领域的重点关注问题,临床对Gn启动日LH水平较低者是否会对移植效果产生影响、是否需添加LH等问题尚未达成统一共识。目前,血清LH水平为0.5 IU/L是公认的垂体-卵巢轴过度抑制的标准。有研究[7]发现,大部分正常反应的患者通过降调内源性LH可促进促排卵卵泡发育,无需再另外添加外源性LH。但是我国学者[8]主张为患者添加r-LH,尤其对年龄较大的患者或降调后出现垂体过度抑制的患者。虽然LH较低情况下,FSH 也可诱导卵泡生长,但为患者注射HCG后,卵泡存在生长发育缺陷的风险,说明在卵泡发育过程中,LH不仅为芳香化酶提供雄激素底物,还可直接调节、刺激卵泡的形成。若LH低于阈值,会对卵泡的生长及卵母细胞成熟产生不良影响,增加外源性LH可在一定程度上提高胚胎着床率。LH高于峰值会抑制颗粒细胞的增殖,使卵泡闭锁、黄素化,增加LH注射剂量可使LH水平高于峰值,减少小卵泡数。本研究结果显示,两组降调后FSH、LH、E2水平比较差异无统计学意义。观察组HCG日的LH、E2水平均高于对照组,P水平、Gn总量均低于对照组,差异有统计学意义(P<0.05);两组内膜厚度、Gn天数比较差异无统计学意义;观察组2PN受精率、优胚率、种植率、临床妊娠率、抱婴率均高于对照组,全胚冷冻率低于对照组,差异有统计学意义(P<0.05);两组2PN卵裂率、早期流产率比较差异无统计学意义。提示为早卵泡期长方案中LH低的患者添加r-LH,可在一定程度上可降低全胚冷冻率。有研究[9]显示,添加r-LH可避免雌孕激素水平失调而影响子宫内膜的容受性。另外,早卵泡期长方案中Gn降调时间较长,因此,子宫内膜处于静止状态的时间会有所延长,可抑制子宫内膜的不规则生长。同时,体液中细胞因子的浓度减少可抑制局部炎症反应,改善生殖内环境,有利于胚胎着床。研究[10]发现,对早卵泡期长方案血清LH低患者添加r-LH可改善妊娠结局,一是补充r-LH后,LH会作用于卵泡膜细胞,刺激雄烯二酮的产生,使其含量增加,进而为E2的合成提供充足的底物,有利于卵泡发育;二是LH可通过颗粒细胞的旁分泌系统提高卵泡对刺激的敏感性,改善卵巢反应性。因此,添加r-LH可改善体内卵母细胞质量,对子宫内膜容受性具有促进作用,可提高受精率、优胚率、着床率、妊娠率。
综上所述,早卵泡期长方案血清LH低患者添加r-LH可改善其性激素水平及妊娠结局,但本研究样本量较少,所得结论仍需进行更多前瞻性研究和个体化用药时间、剂量的研究加以证实。

