快速溶剂萃取-水浴氮吹-高效液相色谱法检测土壤16种多环芳烃
许成君 王 芳 郑凯元 陈 清 李兵兵 李 宝 杨 柳 梁 莉
(大庆油田水务研究设计院)
0 引 言
多环芳烃(PAHs)由于其特殊的“三致效应”[1-2]一直以来都是环境领域重点关注的污染物。在我国土壤检测领域中对PAHs检测的相关研究也较为广泛,涉及了PAHs的萃取[3-6](索氏抽提、加速溶剂萃取、微波萃取、超声萃取)、浓缩(旋转蒸发浓缩、水浴氮吹浓缩)、净化[7-8](硅酸镁固相萃取柱、硅胶固相萃取柱、多环芳烃专用柱)、检测仪器[9-10](HPLC、GC-MS)等多个方面。根据经验判断,目前各实验室土壤中PAHs的检测结果误差主要源于PAHs的萃取、浓缩以及净化步骤。我国生态环境部于2016年发布了HJ 784—2016《土壤和沉积物 多环芳烃的测定 高效液相色谱法》[11],该标准中萃取方法引用了索式抽提法,对萃取液采取氮吹法进行浓缩,浓缩液使用硅酸镁固相萃取柱或硅胶固相萃取柱净化,但在标准中也注明了在通过验证并达到质控要求时,也可以采用其他提取、浓缩方法,这就使得相关检测实验室及检测人员在参照此方法时,需要对不同处理方法及处理条件下的检测规律及结果有一定的掌握,从而可以结合实际情况和实验室条件来决定浓缩和净化的方法。
本文采用高效液相色谱法来检测土壤中16种PAHs,通过对不同萃取方法、浓缩方法及净化方法的对比研究,优化相关处理步骤的实验条件,建立了土壤中PAHs的测定方法。该方法加标回收率高,操作耗时短,试剂用量少,重现性好,满足分析测试的需求,可为相关实验室及其科研人员提供参考。
1 实 验
1.1 仪器与试剂
VFFSE-6型加速溶剂萃取仪(中国维克托公司,66 mm不锈钢萃取池);HPLC1260型高效液相色谱仪(HPLC,美国安捷伦公司);R-215型旋转蒸发仪(瑞士布奇公司);DC-12型氮吹仪(上海安谱实验科技股份有限公司);固相萃取小柱(上海安谱实验科技股份有限公司);曼哈格PAH-Mix16 16种PAHs混标;百灵威内标及替代物。
1.2 实验方法
取20 g石英砂作为空白基质,在空白石英砂中分别加入混合标准溶液,配制成0.5 mg/kg的加标样品,对样品中PAHs进行萃取得到萃取液,在萃取液中加入一定量无水硫酸钠进行干燥。将处理后的萃取液进行浓缩,浓缩液通过活化固相萃取柱进行净化,净化液浓缩定容至1 mL进行HPLC检测。
本实验主要是通过对样品预处理条件进行优化,考察不同条件下样品中PAHs的回收率,筛选出最佳的预处理条件,构建合理的检测方法,再对该方法进行验证,具体实验设计见表1。
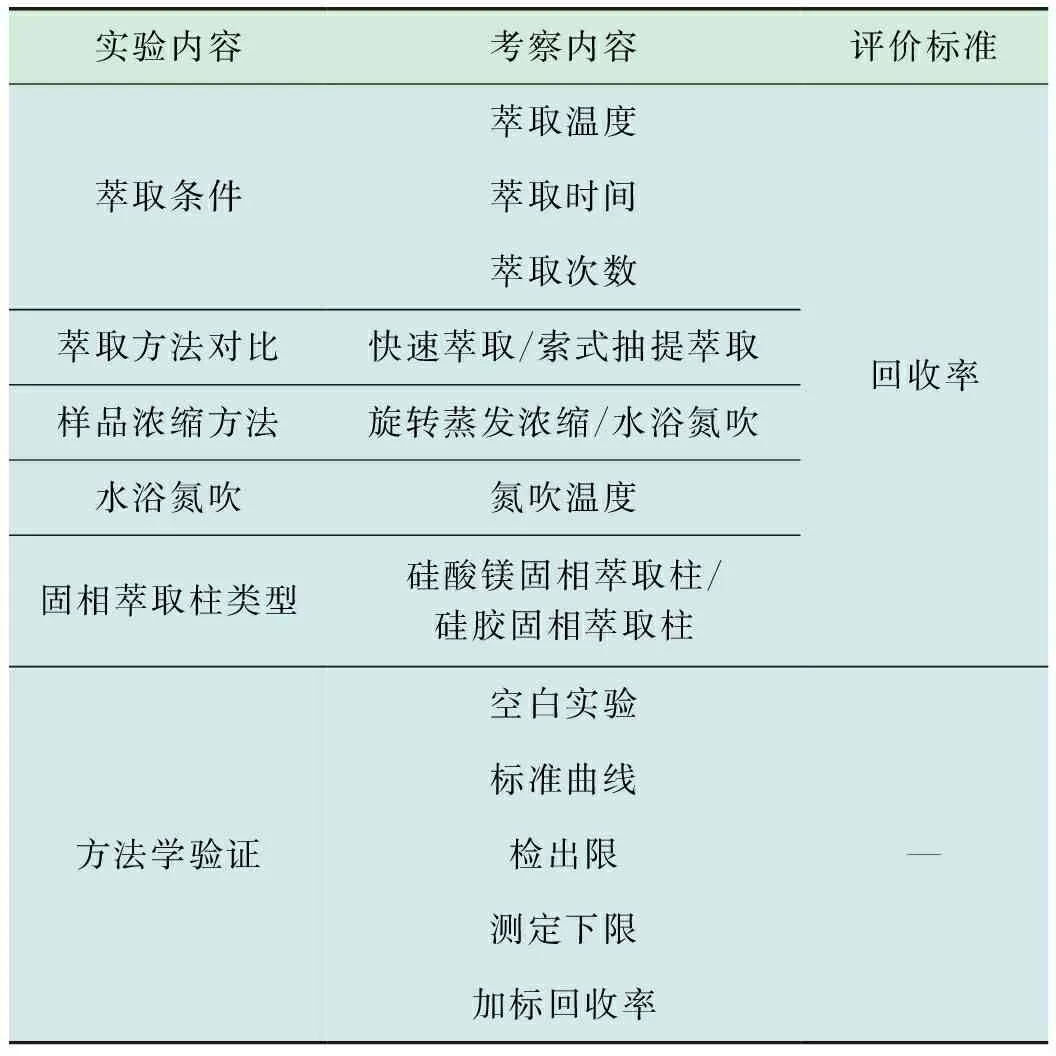
表1 实验设计
1.3 样品预处理
1)快速溶剂萃取:载气压力1.5 MPa;加热温度100,110,120℃;萃取时间12,16,20 min;萃取剂为1∶1(体积比)的正己烷、丙酮溶液,萃取次数1,2,3次。
2)索式抽提:将试样放入玻璃套管内,将套管放入索式抽提器中,加入100 mL萃取剂(体积比为1∶1的正己烷、丙酮溶液),加热回流18 h。
3)旋转蒸发浓缩:取萃取液置于圆底烧瓶中,在40℃条件下用旋转蒸发仪旋蒸至约1 mL,加入1 mL乙腈再次旋蒸至约1 mL,重复加入1 mL乙腈3次,将萃取剂完全转化为乙腈,经硅酸镁固相萃取柱净化后待测。
4)水浴氮吹:开启氮气,设置水浴氮吹温度分别为30,40,50℃,将提取液吹扫浓缩至1 mL,加入5 mL正己烷并浓缩至约1 mL,重复此浓缩过程3次,使溶剂完全转化为正己烷,经硅酸镁固相萃取柱净化后待测。
5)SPE柱净化:将浓缩液用硅胶柱或硅酸镁固相萃取柱进行净化。将1 mL提取液加入净化柱,用25 mL体积比为1∶1的正己烷、二氯甲烷溶液洗脱,收集洗脱液,氮吹浓缩至1.0 mL,加入3 mL乙腈浓缩至1.0 mL以下待测。
1.4 HPLC分析条件
ZORBAX Eclipse PAH色谱柱(5 mm,4.6 mm×250 mm),柱流速1.20 mL/min,柱温箱温度35℃,进样量10 μL;乙腈和水梯度洗脱,荧光检测器(RF-10AXL型)扫描波长见表2。
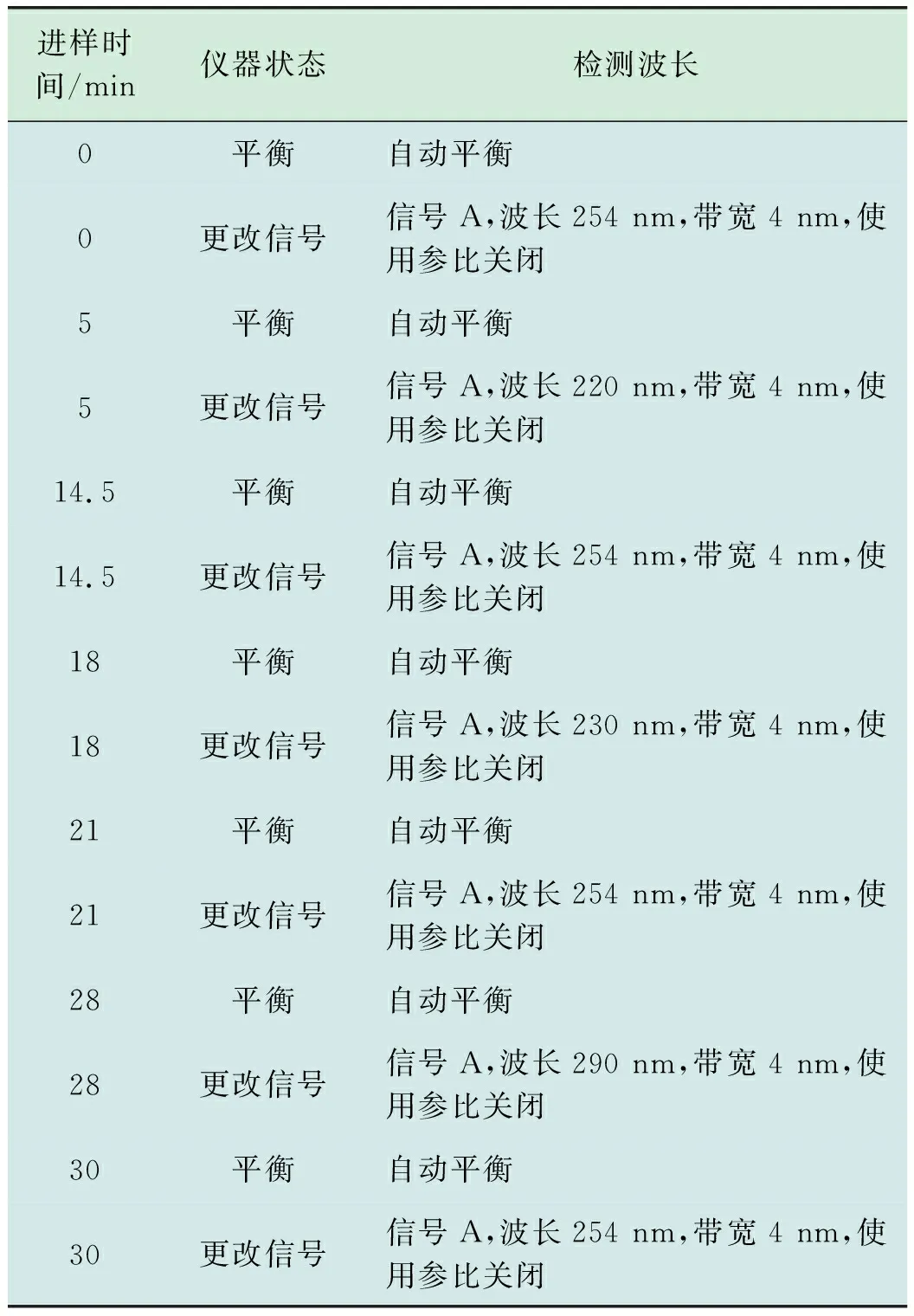
表2 洗脱时间及荧光检测器检测波长
2 结果与讨论
2.1 快速溶剂萃取温度优化
考察不同萃取温度条件下土壤中16种PAHs的回收率,判断萃取温度对萃取效率的影响,实验中选取萃取温度为100,110,120℃,实验结果见图1。
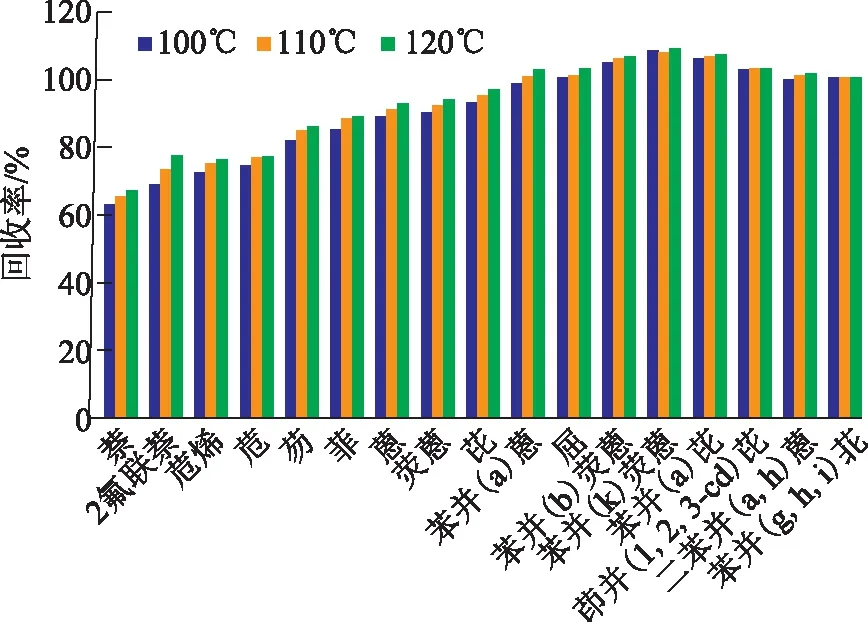
图1 萃取温度对各PAHs回收率的影响
由图1可见,萃取温度对低环芳烃萃取效果影响大于高环芳烃,高环芳烃在100~120℃的回收率变化不大,但是2~3环的低环芳烃的萃取效果随萃取温度的变化较为明显。由整体数据对比得出,在萃取温度为120℃时,各PAHs的回收率达到最高,为67.4%~109.1%,故在后续实验中选取萃取温度为120℃。
2.2 快速溶剂萃取时间优化
考察不同萃取时间条件下土壤中16种PAHs的回收率,判断萃取时间对萃取效率的影响,实验中选取萃取时间为12,16,20 min,实验结果见图2。
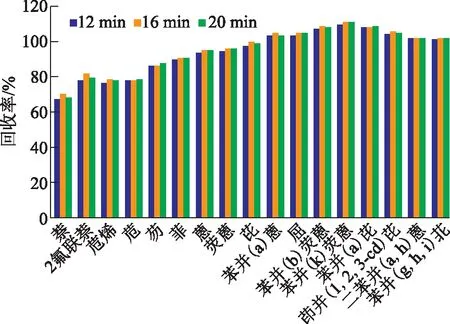
图2 萃取时间对各PAHs回收率的影响
由图2可见,多数PAHs回收率随着萃取时间增长先增高后降低,推断出现此现象的主要原因是萃取时间过短,部分PAHs溶解不充分,没有萃取完全,而萃取时间过长,部分PAHs又会出现损失而导致回收率降低,通过实验比对,确定快速溶剂萃取的最佳萃取时间为16 min,16种PAHs的回收率可达70.3%~110.2%。同时观察图2各PAHs回收率随萃取时间变化的情况,可知萃取时间的变化对低环数PAHs的影响较大。
2.3 快速溶剂萃取次数优化
考察不同萃取次数条件下土壤中16种PAHs的回收率,判断萃取次数对萃取效率的影响,实验中选取萃取次数分别为1,2,3次,实验结果见图3。
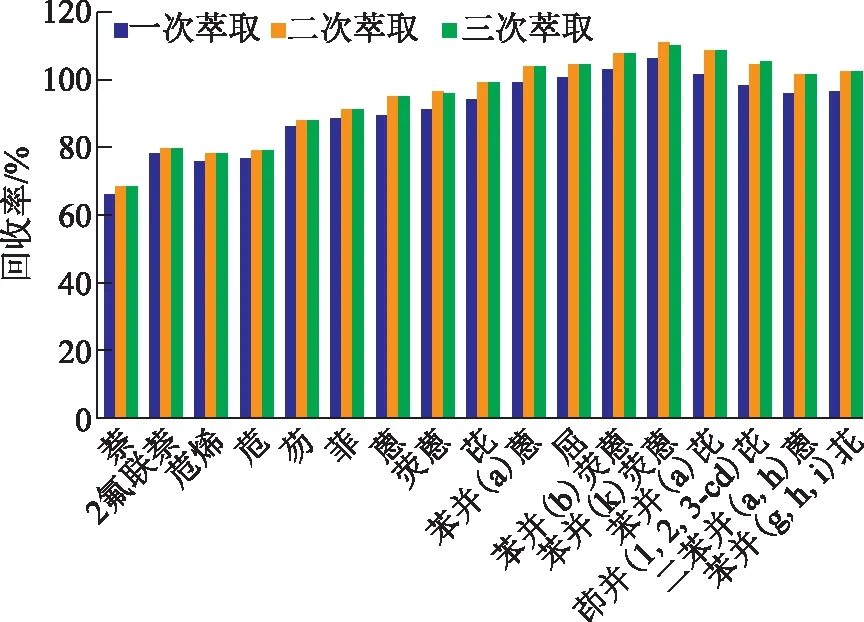
图3 萃取次数对各PAHs回收率的影响
由图3可见,各PAHs的回收率随萃取次数的增加而增加,当萃取次数达到两次后,再继续增加萃取次数,PAHs的回收率增加不显著,推断当萃取次数达到两次后萃取效果已比较完全,结合经济成本及环保性,确定快速溶剂萃取次数为两次,在该条件下16种PAHs的回收率可达68.1%~110.4%。同时观察图3各PAHs回收率随萃取次数的变化情况,可知快速溶剂萃取次数的变化对高环数PAHs影响较大。
2.4 快速溶剂萃取与索氏抽提萃取效果对比
针对同一样品分别考察快速溶剂萃取及索氏抽提萃取后各PAHs的回收率,对比两种萃取方法的处理效果,实验结果见图4。
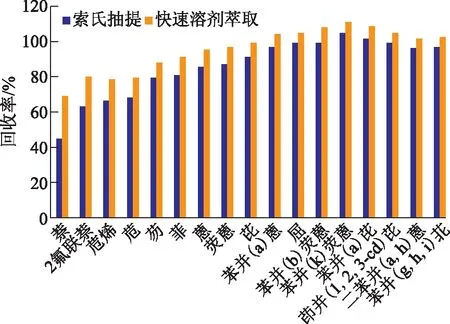
图4 快速溶剂萃取与索氏抽提萃取效果对比
由图4可以看出,对于大多数PAHs而言,快速溶剂萃取的回收效果更好,尤其是针对低环数的PAHs,与索氏抽提萃取相比,快速溶剂萃取样品的PHAs回收率明显提高,回收率为68.4%~109.8%,索式抽提的回收率仅为44.1%~104.1%。由此可见,与传统的索氏抽提相比,快速溶剂萃取具有萃取效果好、萃取时间短、溶剂使用量低的优点。
2.5 样品浓缩方法对比
此部分实验对旋转蒸发与水浴氮吹两种浓缩方法的效果进行了对比,实验结果见图5。
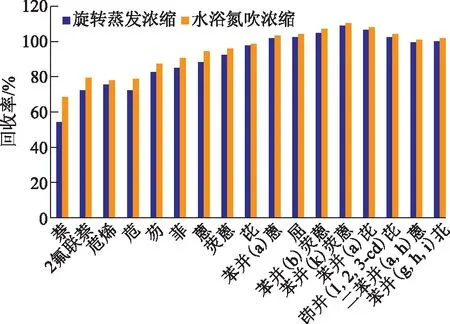
图5 样品浓缩方法对比
由图5可见,水浴氮吹处理后的样品各PAHs的回收率更高,尤其是低环数的PAHs的回收率明显高于旋转蒸发浓缩,水浴氮吹处理的样品回收率可达68.1%~110.4%,而旋转蒸发的回收率仅为54.1%~109.1%。与旋转蒸发相比,水浴氮吹浓缩适合处理液体体积少,定容体积小的样品,该浓缩方法可以实现样品无氧浓缩,具有同时处理多个样品、浓缩时间短的优点。
2.6 水浴氮吹温度条件优化
考察不同水浴氮吹温度条件下土壤中16种PAHs的回收率,判断水浴氮吹温度对萃取效率的影响,实验选取水浴氮吹温度为30,40,50℃,实验结果见图6。

图6 水浴氮吹温度对各PAHs回收率的影响
由图6可见,水浴氮吹温度主要是对低环芳烃的回收率影响较大,而高环数PAHs的回收率随氮吹温度的变化并不大。由整体数据对比得出,在水浴氮吹温度为30,40℃时,各PAHs的回收率相近,回收率为68.3%~110.3%,进一步提高氮吹温度,部分低环芳烃的回收率会降低,50℃时回收率为68.3%~110.3%。综合考虑回收效果以及实验时长,后续实验中选取水浴氮吹温度为40℃。
2.7 固相萃取柱类型优化
比较了硅酸镁固相萃取柱及硅胶固相萃取柱(填料均为1 g)对萃取效率的影响,结果见图7。
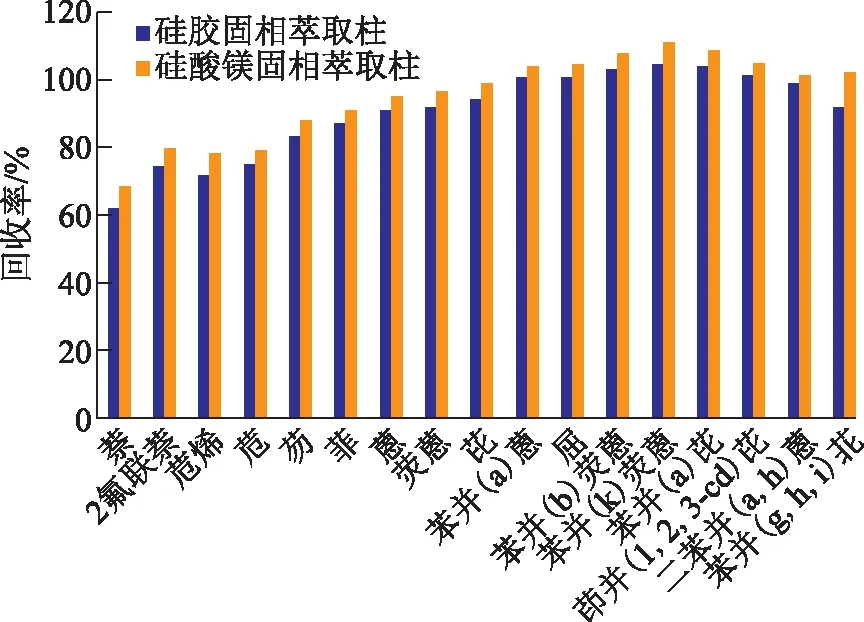
图7 固相萃取柱对PAHs回收率的影响
水浴氮吹浓缩后的样品经硅胶柱净化后PAHs的回收率在62.1%~104.3%,而经硅酸镁固相萃取柱处理回收率更高,为68.1%~110.4%,故选择硅酸镁固相萃取柱作为净化固相萃取柱更为适合。
2.8 方法学验证
2.8.1 空白实验
使用20~50目的石英砂,在400℃马弗炉中烘烤4 h,放置至室温后,采用体积比1∶1的丙酮、正己烷溶液超声洗涤,烘干后密封保存备用。经过前文优化条件后的快速溶剂萃取-水浴氮吹-硅酸镁固相萃取柱净化预处理步骤后,上机检测,检测结果均小于方法检出限。
2.8.2 标准曲线制作
采用曼哈格PAH-Mix16的16种PAHs混标,百灵威5种内标,替代物两种。分别移取适量的PAHs标准物质、替代物中间液,使用体积比1∶1的丙酮、正己烷溶液定容,使得PAHs及替代物的质量浓度分别为0.6,1.0,2.0,5.0,8.0,10.0 mg/L,内标的质量浓度为5.0 mg/L,绘制的标准曲线见表3。
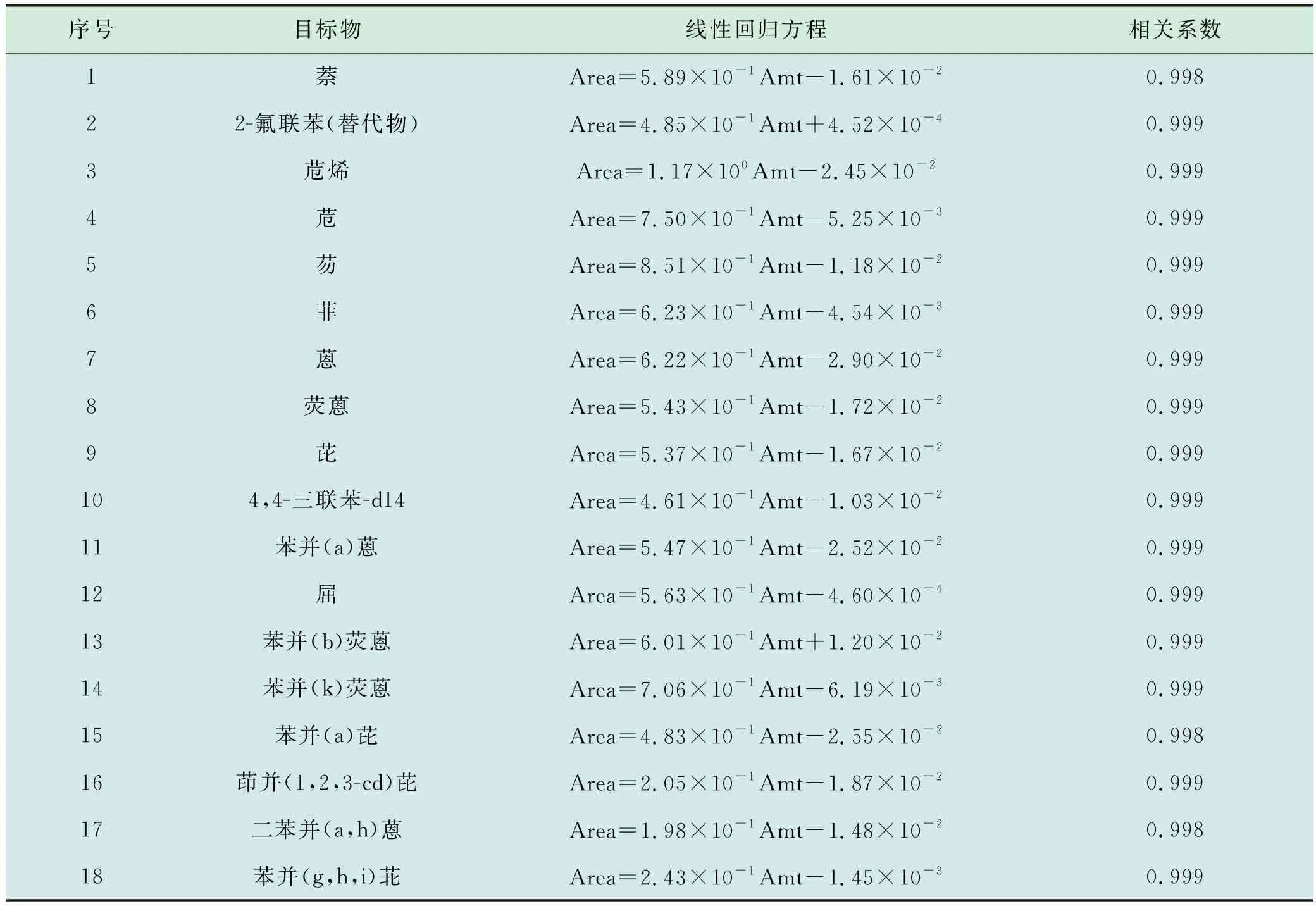
表3 标准曲线的线性方程及相关系数
2.8.3 方法回收率、相对标准偏差及替代物回收率
使用国际实验室能力验证机构(ERA)土壤质控样品,加入替代物,使用加压流体萃取法,硅酸镁小柱净化后,使用氮吹仪浓缩后定容至1 mL,上机检测,连续9次进样,计算16种PAHs的平均回收率、相对标准偏差,结果见表4。计算替代物回收率及相对标准偏差,结果见表5。
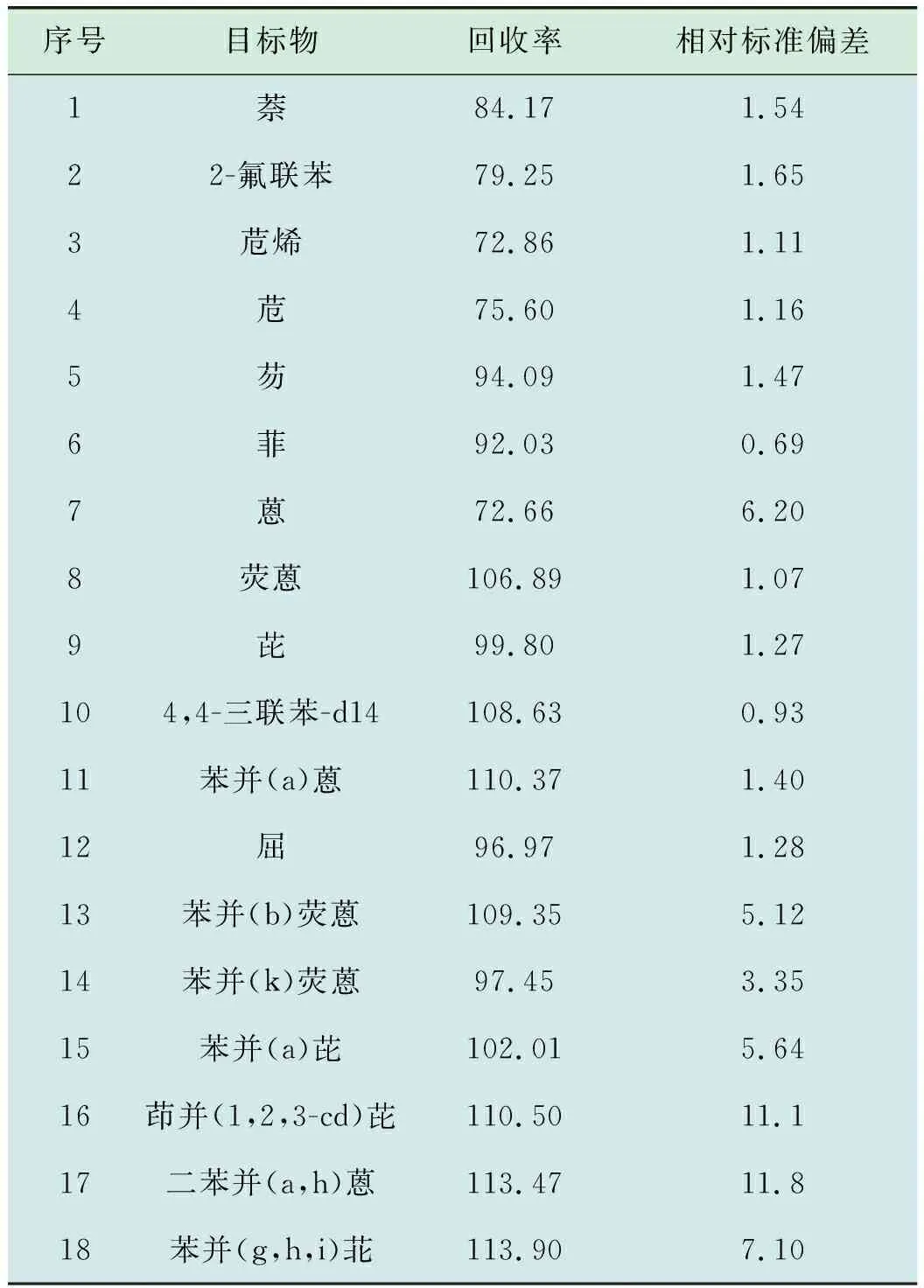
表4 方法回收率、相对标准偏差 %
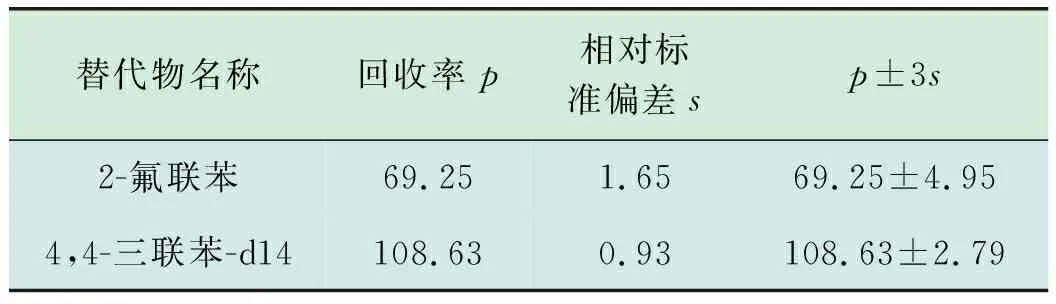
表5 替代物回收率及相对标准偏差 %
由表4、表5可知,各目标物检测值均在参考值范围内,相对标准偏差为 0.69%~11.8%,均小于30%,目标物回收率为72.66%~113.90%,替代物的加标回收率为69.25%,108.63%,均满足HJ 784—2016《土壤和沉积物多环芳烃的测定高效液相色谱法》中“各组分加标回收率在50%~120%之间,替代物加标回收率在60%~120%之间”的要求,可用于实际土壤样品中PAHs的检测。
2.8.4 方法检出限及测定下限
按照前文优化后样品分析的全部步骤,对含量为估计检出限2~5倍的样品进行7次平行测定,计算7次平行测定的相对标准偏差,计算检出限,4倍检出限为测定下限,检出限及测定下限分别为:0.21~0.47 μg/kg,0.84~1.88 μg/kg,具体计算结果见表6。

表6 方法检出限及测定下限 μg/kg
3 结 论
建立了快速溶剂萃取-水浴氮吹-高效液相色谱法检测土壤样品中16种PAHs的方法,通过对萃取过程、浓缩过程及净化过程的对比优化,得到如下结论。
1)快速溶剂萃取、水浴氮吹、硅酸镁固相萃取柱净化相较于索氏抽提、旋转蒸发、硅胶固相萃取有着更为良好的处理效果。
2) 经条件优化实验确定最佳处理条件为:萃取温度120℃,静态萃取时间16 min,萃取次数两次,水浴氮吹温度40℃,氮吹后浓缩液经硅酸镁固相萃取柱净化。
3)采用优化的实验方法进行加标实验,目标物回收率高,可达72.66%~113.90%,相对标准偏差为0.69%~11.8%,该方法适合实际土壤样品中PAHs的检测。

