不同肥料对番茄品质及连作土壤细菌群落结构的影响
孙彩霞, 刘玉红, 杨艳, 贺文员, 潘志彦
(1.浙江工业大学 环境学院,浙江 杭州 310032; 2.浙江省农业科学院 农产品质量安全与营养研究所,浙江 杭州 310021;3.浙江丰瑜生态科技有限公司,浙江 金华 321000)
连作障碍是指连续在同一土壤上栽培同种作物或近缘作物引起的作物生长发育异常、产量下降、土壤健康状况恶化及土传病害积累等现象[1]。连作障碍的发生有多种原因,包括养分过度消耗、土壤理化性质恶化、土壤有害微生物集聚、土壤微生物区系劣变和有毒物质(包括化感物质等)累积等[2-3]。土壤微生物在土壤养分循环及病虫害防治中起重要作用,被认为是评价土壤质量的关键生物指标之一[4],然而有研究表明,有些微生物会以病原菌的形式出现,入侵作物根部,引起作物病害[5]。土壤微生物群落受多种因素的影响,在连作土壤中,土壤微生物的群落组成和多样性主要受作物的根系分泌物和脱落物的影响[6],连作土壤环境的改变也会对农作物品质产生一定的影响[7]。
设施番茄连作的栽培模式在中国较为普遍,而长期的单一作物连作会导致土壤微生物多样性下降,病原菌数量增加,有益微生物数量减少[8]。有研究表明,番茄连作4年后,会导致番茄品质下降,土壤养分失衡,微生物量碳氮下降,土壤由细菌型向真菌型转变,出现地力衰竭等严重的连作障碍现象[9-11]。目前,利用有机肥对设施连作土壤进行改良具有很高的应用价值,同时还可替代化肥,减少设施农业生产过程中化肥的施用量[12]。有研究表明,通过施加有机肥可增加连作土壤中的有益微生物,如根际促生菌(plant growth promoting rhinoacteria,PGPR)的丰度[13]。本研究利用Illumina Miseq测序平台对施加不同肥料的番茄连作土壤进行高通量测序,分析不同的施肥量对番茄连作土壤细菌群落结构的影响,比较不同的肥料种类及施肥量在设施农业的可持续发展中的可行性,为设施农业的合理施肥提供理论依据。
1 材料与方法
1.1 材料
试验位于浙江省绍兴市马山镇金硕农业科技有限公司,供试作物为金珠樱桃番茄。
1.2 处理设计
供试作物分别在2个大棚中种植,每个大棚均包含7个处理。其中,T1为施用300 g·m-2农家肥,T2为施用300 g·m-2商品肥,T3~T6分别为施用150、300、450、600 g·m-2的腐植酸调理剂,以不施肥为空白对照(CK),每块样地大小为60 m2。上述肥料均由浙江丰瑜生态科技有限公司提供。
1.3 土壤样品的采集
2020年8月,采用五点取样法采集土壤样品,每个样点去除表面杂草,利用土钻采集0~10 cm的表层土。共采集7个土壤样本,将采集的土壤过2 mm筛,去除杂草后保存于-80 ℃冰箱,用于土壤基因组的提取及高通量测序。
1.4 试验方法
有关番茄养分的4个指标委托农业农村部农产品及加工品质量安全监督检验测试中心(杭州)依照相关国家标准进行测定。
土壤细菌DNA基因组提取采用试剂盒E.Z.N.A.®soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)法提取。以50 ng DNA为模版,采用通用引物338F(5′-ACTCCTACGGGAGGCAGC AG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)对16Sr DNA高变区V3~V4区进行扩增。扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR仪为ABI GeneAmp® 9700型)。PCR反应体系为:5×TransStartFastPfu缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,上游引物(5 μmol·L-1)0.8 μL,下游引物(5 μmol·L-1)0.8 μL,TransStartFastPfuDNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。
将同一样本的PCR产物混合,使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer (Promega,USA) 对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
使用Trimmomatic软件对原始测序序列进行质控,使用FLASH (V1.2.11,https://ccb.jhu.edu/software/FLASH/index.shtml)进行每个样品的reads拼接,然后通过Qiime(V1.9.1,http://qiime.org/install/index.html)对序列进行去重过滤,将上述得到的有效序列利用Uparse (V7.0.1090,http://www.drive5.com/uparse/) 在97%的相似度水平中进行OTU(Operational Taxonomic Units)聚类并剔除嵌合体,以出现频数最高的序列作为OTUs的代表序列。采用RDP classifier (V2.11,https://sourceforge.net/projects/rdp-classifier/)对每条序列进行物种分类注释,比对Silva数据库(SSU128),设置比对阈值为70%。
1.5 统计学分析
采用Excel 2016及美吉生物云平台进行相关图表的绘制。
2 结果与分析
2.1 不同处理对番茄产量的影响
在收获期将各处理的产量进行统计发现,空白、施用农家肥、施用商品肥这3个处理的产量远低于施用腐植酸调理剂的4个处理。腐植酸调理剂可能更加适合连作番茄的种植,有助于改善连作土壤的肥力,提高番茄产量。
2.2 不同处理对番茄品质指标的影响
表1显示,各处理中,T6处理的可溶性固形物、VC及总糖含量最高,可滴定酸含量最低,表明此处理的番茄品质最好。T3处理的可溶性固形物、VC及总糖含量较低而可滴定酸含量较高。可见,施加600 g·m-2的腐植酸调理剂会最大程度的提高番茄的养分含量。腐植酸调理剂用量偏少的情况下对番茄品质的改善效果不明显。
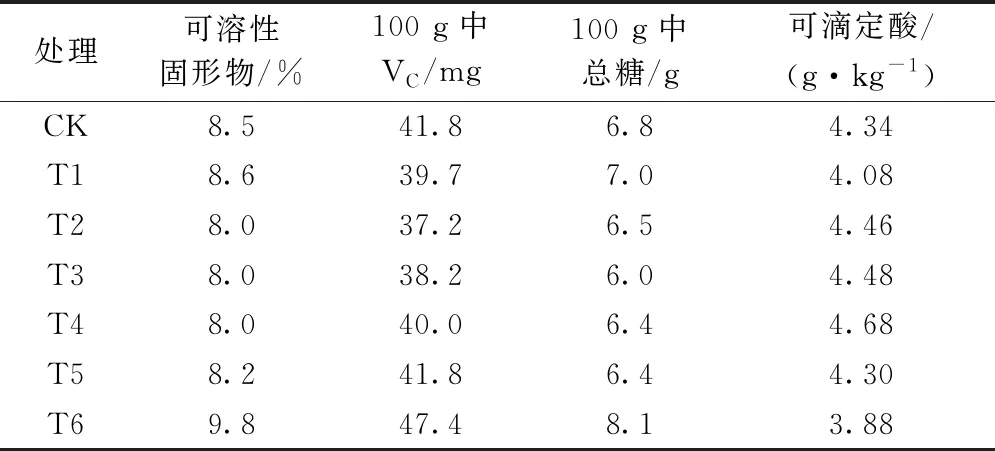
表1 不同处理对番茄品质指标的影响
2.3 不同处理对番茄连作土壤的α多样性指数的影响
表2显示,各处理中,Ace、Chao指数在T1处理最低,T5处理最高。Shannon指数在T5和T6处理有最大值和最小值,Simpson指数在T6和T1处理中有最大值和最小值。相比CK,施肥会使土壤微生物的菌落结构更加集中。但施用农家肥和商品肥会降低土壤的Chao、Ace、Shannon和Simpson指数,会降低番茄连作土壤细菌的丰富度,而施加450 g·m-2的腐植酸调理剂会使土壤中细菌的丰富度达到最优。
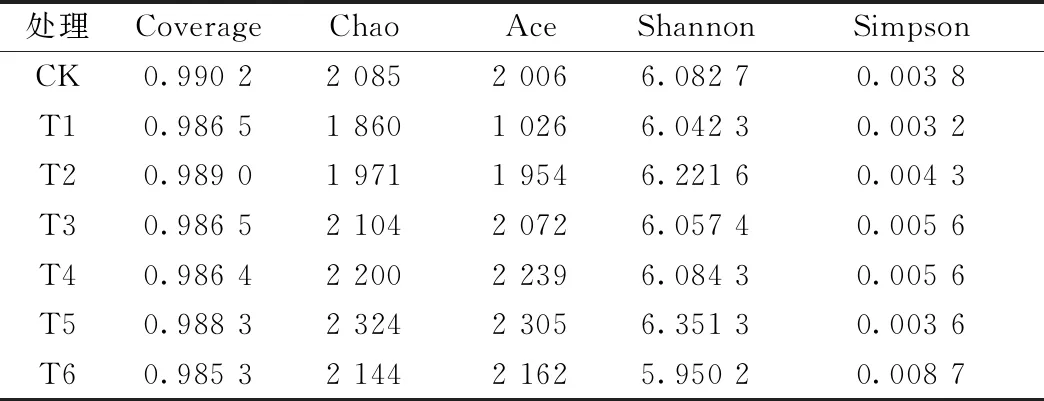
表2 不同处理下番茄连作土壤的α多样性指数
2.4 不同处理对番茄连作土壤细菌群落结构的影响
将经过高通量测序的下机序列通过优化过滤低质量序列后得到有效序列354 629条,有效序列平均长度为415.5 bp,供试土壤样品序列经拆分、去冗余后,在97%相似度下进行OTU聚类,共得到2 854个OTUs。利用测序获得的序列进行随机抽样,将抽到的序列数所代表的OTU数目构建稀释性曲线(图1),不同处理的土壤样品稀释性曲线均趋向平缓,趋于饱和,这说明供试样品取样合理,测试数据量合理,实际土壤环境细菌群落结构置信度较高,能真实反映土壤样本的细菌群落,增加测序数量对发现新的OTU贡献率较小。
图1 不同处理下番茄连作土壤的稀释曲线
将聚类产生的OTUs进行分类,可划分为34门89纲218目363科682属1 260种。表3显示,CK的各分类水平的数量要大于6个肥料处理,表明施加不同肥料均会降低番茄连作土壤中的物种数量。
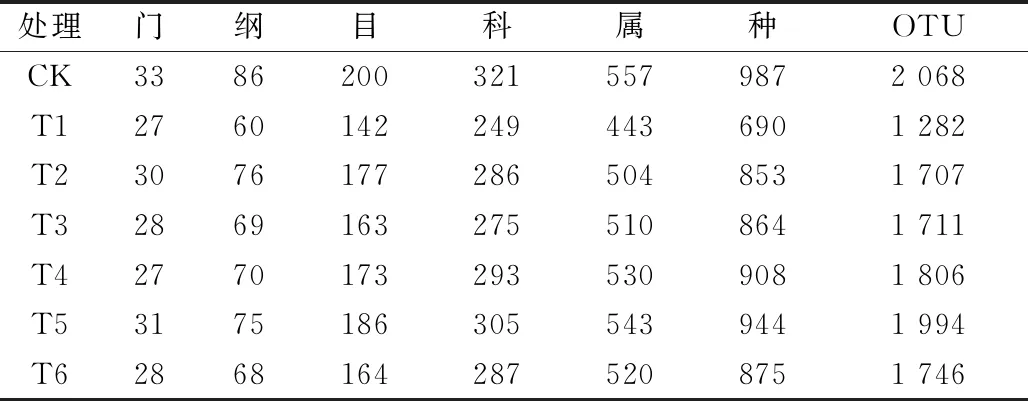
表3 不同处理下番茄连作土壤细菌群落组成中各分类单元的数量
在门水平中(图2),变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿湾菌门(Chloroflexi)、酸杆菌门(Acidobacteria)是优势细菌门,相对丰度均大于10%,其丰度总和占细菌总丰度的75.5%。相比CK,6个施肥处理均会增加土壤中变形菌门和放线菌门的相对丰度,降低酸杆菌门和芽单胞菌门 (Gemmatimonadetes)的相对丰度。
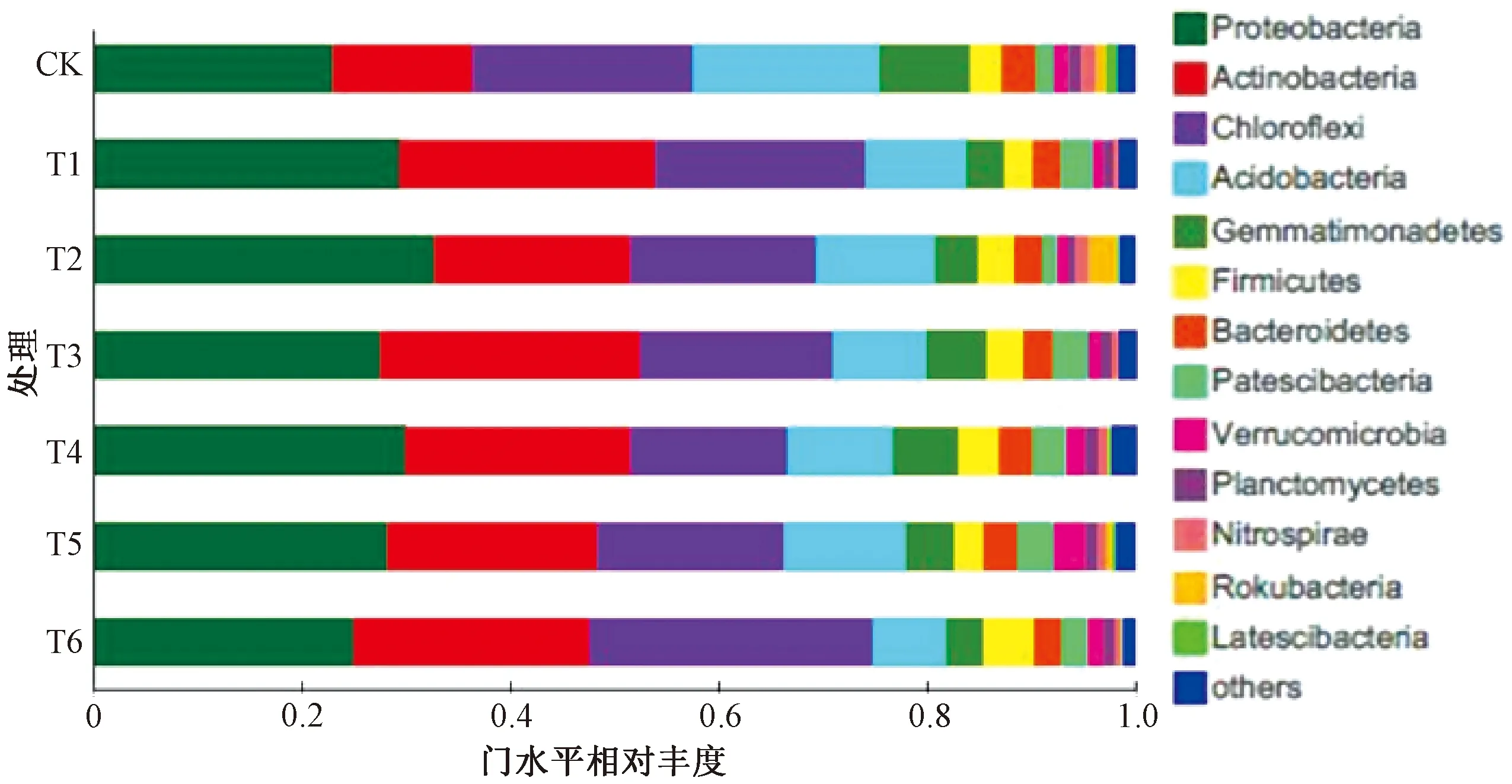
图2 不同处理下番茄连作土壤细菌在门水平的相对丰度
在属水平中(图3),7个处理共鉴定出682个属,其中CK中鉴定出557个属。
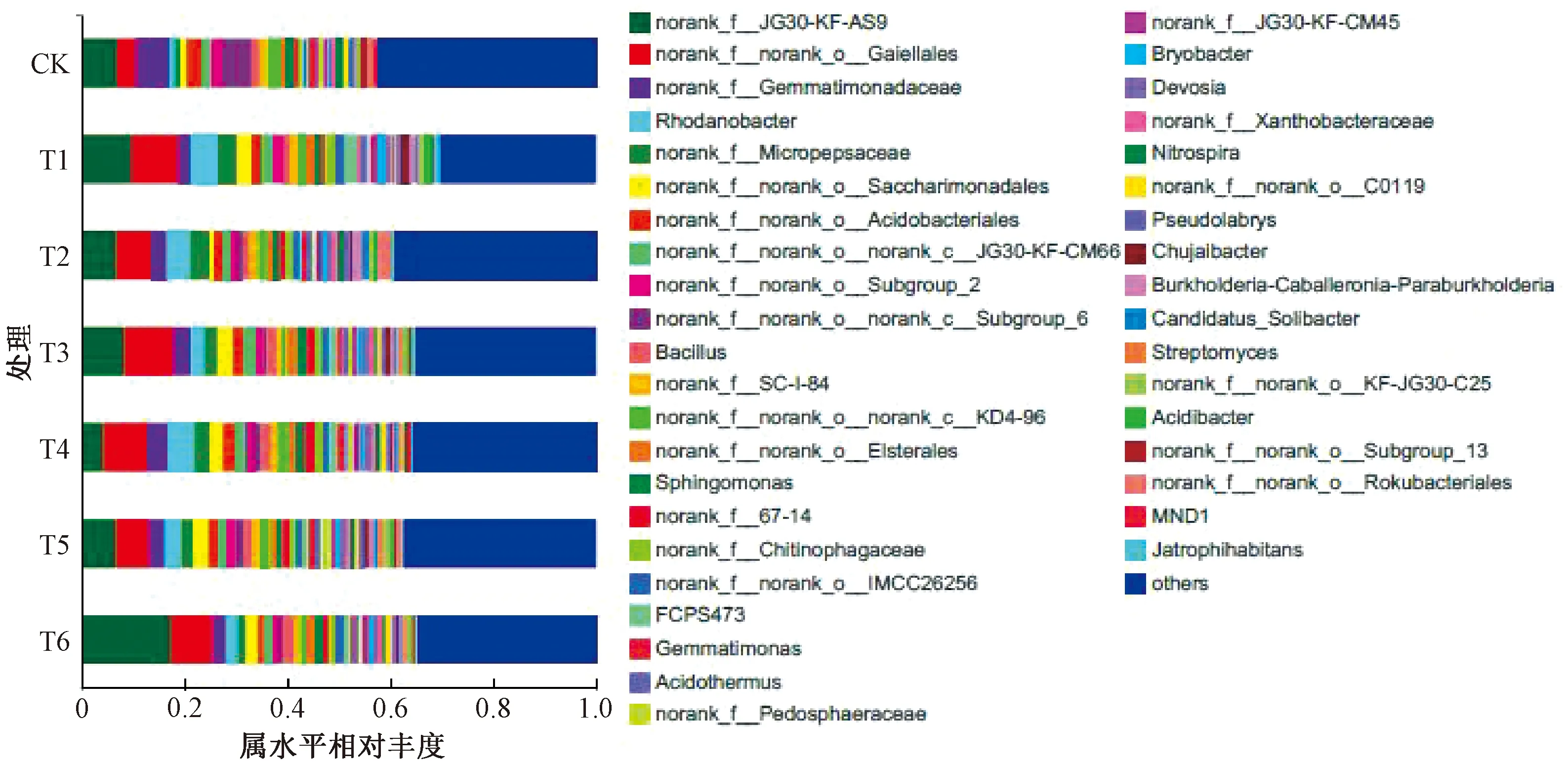
图3 不同处理下番茄连作土壤细菌在属水平的相对丰度
相比CK,6个肥料处理鉴定出的属分别减少20.47%、9.52%、8.44%、4.85%、2.51%、6.64%。
经过在Silva数据库比对发现,大部分的细菌无法鉴定到属,且无法纯培养,可鉴定到的主要有Rhodanobacter、芽孢杆菌属(Bacillus)、鞘脂单胞菌属(Sphingomonas)、FCPS473、芽单胞菌属(Gemmatimonas)、嗜酸栖热菌属(Acidothermus)、Bryobacter、Devosia、硝化螺菌属(Nitrospira)、Pseudolabrys、Chujaibacter、Burkholderia-Caballer-onia-Paraburkholderia、Candidatus_Solibacter、链霉菌属(Streptomyces)、Acidibacter、MND1、Jatrophi-habitans。
PCoA分析发现,7个处理解释了细菌群落总变异的67%,其中PC1轴解释了细菌群落总变异的45.41%,PC2轴解释了细菌群落总变异的21.59%(图4)。此外,PC1轴显著将CK处理与其他6个处理分开,表明施肥会显著改变番茄连作土壤的细菌群落结构;PC2轴显著将施用腐植酸调理剂的4个处理与其他3个处理分开,表明施用腐植酸调理剂会显著改变番茄连作土壤的细菌群落,造成细菌群落结构与其他3个处理的不同。
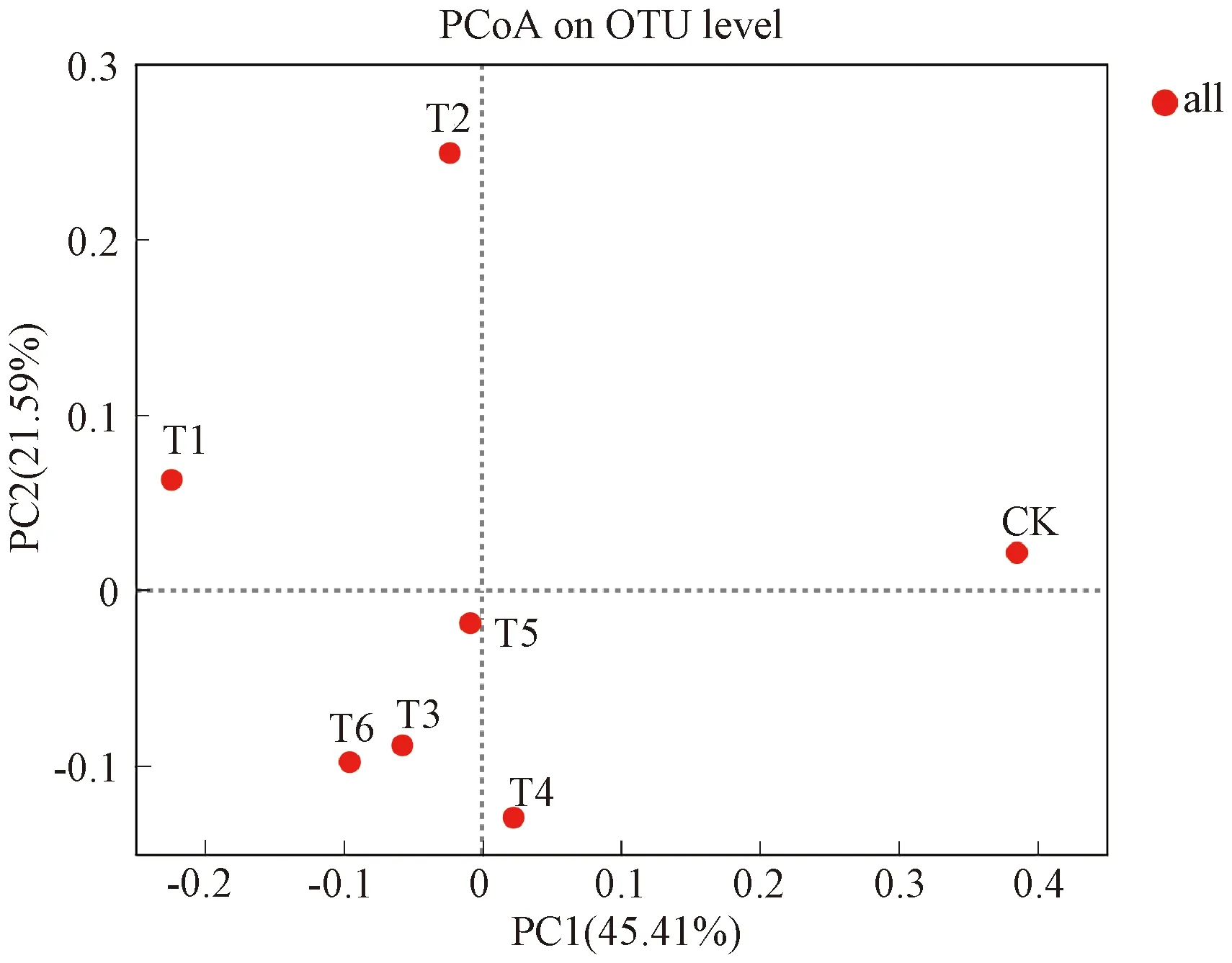
图4 不同处理下番茄连作土壤细菌群落的PCoA分析
2.5 不同处理下番茄连作土壤细菌群落的功能预测
通过PICRUSt对OTU丰度表进行标准化,然后OTU进行COG和KEGG功能注释,获得OTU在COG、KEGG各功能水平的注释信息及各功能在不同样本中的丰度信息。图5显示,7个处理的细菌群落共涉及24种功能,除了功能未知和仅通用功能预测外,氨基酸转运与代谢相关的OTU序列最多,与细胞外结构和细胞骨架相关的OTU序列最少。
3 小结与讨论
在本研究中,施加600 g·m-2的腐殖酸调理剂会提高连作番茄的品质,很可能是该剂量下的腐植酸调理剂改善了连作番茄土壤的根际微环境。相较于不施肥、施用农家肥及商品肥,腐植酸调理剂对于连作番茄土壤的改良更多的是通过影响土壤中的细菌群落结构进行的,未来对于腐植酸调理剂对土壤的改良机理的研究,更多的要集中于土壤的细菌和真菌生物量,以及根际土壤是向细菌型还是真菌型转化[14-15]。研究显示,当土壤由细菌型向真菌型转化时,土壤正在酸化,且养分含量降低,不利于作物生长。在实际生产中,为保证番茄品质并保护土壤,应当更多的施用腐植酸调理剂。

