长期使用华法林抗凝的非瓣膜性房颤患者围手术/操作期使用NOAC 桥接的抗凝方案研究
张杜枭,黄雪晴,郦明芳*
南京医科大学第一附属医院 1 药学部;2 心血管内科,南京 210029
卒中高风险的非瓣膜性房颤患者需要长期抗凝。该类患者可选择的抗凝药物,从经典的药物华法林,到近年来的非维生素K 拮抗剂的口服抗凝药物(non-vitamin K antagonist oral anticoagulants,NOACs)都能降低患者栓塞风险。基于长期抗凝的安全性和有效性,许多指南[1-3]对NOAC 的推荐级别高于华法林。近几年,NOAC 在我国的使用呈现逐渐增多的趋势;但因经济原因,仍有多数患者以华法林作为首选抗凝药物[4]。
华法林主要经由肝脏代谢,半衰期长达36~42h[5]。因此,华法林停用后到其抗凝效果完全消失需要一定时间。故在围手术/操作期,为减少出血风险,需提前5~7 天停用华法林。在停药期间,华法林抗凝效果会逐渐减弱,患者的栓塞风险随之增加。此外,在长期抗凝的患者中,突然停用抗凝药物可能引起反跳性的高凝状态[6]。基于以上考虑,临床实践一般在围手术/操作期使用肝素类药物进行桥接抗凝过渡。低分子肝素半衰期较短,量效关系明确,是常用于桥接抗凝过渡的肝素类药物。但针对某些行日间手术/操作的患者,若采用肝素类非口服药物进行桥接抗凝,存在操作繁琐等种种不便,注射用药也会增加患者的痛苦。基于上述情况,对使用华法林的非瓣膜性房颤患者,拟采取NOAC 代替肝素类药物进行桥接抗凝,并探究此方案的可行性。
1 资料与方法
本研究为单中心、前瞻、观察性研究,已通过了医院伦理审查委员会的评估(伦理审批文号:2014-SR-113),且所有患者签署了书面知情同意书。
1.1 研究对象
入选2018 年6 月到2021 年5 月在本院抗凝门诊就诊,拟行择期手术/操作的需长期抗凝的非瓣膜性房颤患者。
纳入标准:①年龄≥18 岁的非瓣膜性房颤患者,CHA2DS2-VASc 积分≥2 分的男性或≥3 分的女性,长期服用华法林抗凝(≥0.5 年)并接受抗凝联合门诊长期管理;②行创伤较小的侵入性手术/操作,但经手术/操作医生评估后仍要求停用抗凝药物;③自愿使用NOAC 进行桥接抗凝,并能签署知情同意书。
排除标准:①入选前30 天内发生过活动性出血;②有NOACs 过敏史;③近90 天内发生过卒中、TIA 等栓塞事件;④近90 天内发生过深静脉血栓、肺栓塞等栓塞事件。
1.2 研究方法
收集患者的基本信息;手术/操作3 月内的肌酐清除率(以Cockcroft-Gault 计算);6 个月内华法林抗凝的TTR(time in therapeutic range,TTR)。
确定围手术/操作的具体日期。患者在接受手术/操作前7 天复查血PT-INR 值,若患者PT-INR在2.0~3.0,停用华法林1~2 天后开始NOAC 抗凝;若患者INR<2.0,则当天即可开启NOAC 抗凝;手术/操作前1 天停药,手术/操作完成后,当天或第二天重启NOAC,并与华法林重叠治疗,华法林剂量与手术/操作前剂量一致,合用3 天后,停用NOAC,操作结束后7 天复查INR。NOAC 可以选择达比加群酯110 mg bid 或利伐沙班15 mg qd。为了方便患者理解并遵从医嘱,临床药师向患者发放抗凝药物调整指导卡片。因本研究中患者接受的均为低出血风险手术/操作,遵循指南[7],手术/操作当天或第二天即重启NOAC。NOAC 剂量的选择依据指南推荐[7]及实际临床出血风险。
1.3 观察指标
观察患者在围手术/操作期(使用NOAC 期间)的栓塞事件与出血事件。栓塞事件包括缺血性脑卒中、短暂性脑缺血发作(TIA)、体循环栓塞、肺栓塞、深静脉血栓栓塞。出血事件包括大出血、临床相关的非大出血事件及小出血事件。本研究采取血栓和止血国际协会(ISTH)对大出血的定义,符合以下任意1 条即为大出血:①血红蛋白下降>2 g·dL-1;②输注全血或浓缩红细胞成分血≥2 个单位;③关键部位出血;④死亡。临床相关的非大出血事件定义为不符合大出血定义,但导致患者住院接受药物或手术治疗或抗凝方案的改变。虽发生了出血,但不符合大出血或临床相关的非大出血事件的定义,则被定义为小出血事件。
次要终点:操作前1 周以及操作后1 周的PTINR 值。
1.4 统计学处理
采用SPSS 25.0 统计软件进行数据分析。连续变量符合正态分布者以平均数±标准差()表示,不符合正态分布者以中位数(四分位数间距)表示;分类变量以频数(百分数)来表示。
2 结果
2.1 基线资料
2018 年8 月至2021 年5 月,共纳入患者21例,平均年龄(70.8±8.5)岁,女性占9 例(42.9%),平均CHA2DS2-VASc 评分为(3.0±1.0)分,平均HASBLED 评分为(1.4±0.7)分,仅1 例评分为3 分;所有患者近半年服用华法林INR 控制的平均TTR 是72.6%±13.1%,见表1。
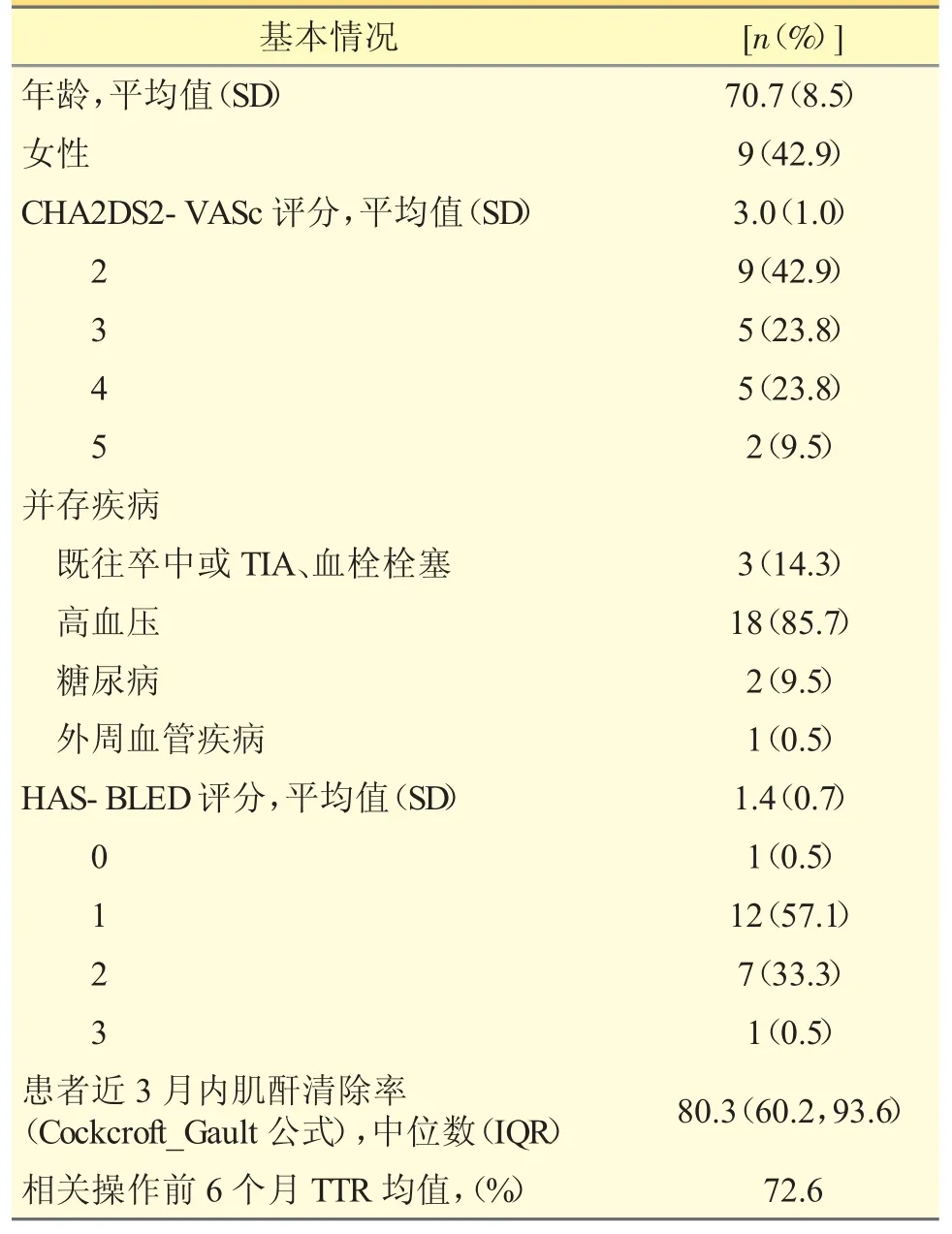
表1 患者基本情况表(n=21)
2.2 研究对象手术/操作期抗凝情况
手术/操作类型分别为肠镜4 例(其中合并息肉摘除3 例),胃镜3 例(其中合并取上皮组织1 例),拔牙8 例(拔1 颗牙5 例,拔3 颗牙3 例),眼科相关手术3 例,皮肤科相关手术3 例;使用达比加群酯110 mg bid 进行桥接13 例,使用利伐沙班15 mg qd 进行桥接8 例,见表2。

表2 患者手术/操作期及桥接抗凝情况
所有患者围手术/操作期均未发生栓塞与出血事件,在手术/操作结束30 天后也未见栓塞与出血事件。所有患者在手术/操作前7 天时的INR 为2.09±0.41,相关手术/操作结束后7 天时的INR 为1.98±0.51,经t 检验,前后INR 对比无显著性差异,P=0.51。其中有12 例在术后1 周时INR 未达标(INR 在2.0~3.0),占比57.1%;有7 例在术后1 周时INR 未达到1.8~3.0,占比33.3%。
3 讨论
长期抗凝的患者,在面临侵入性操作时,通常需要对围手术/操作期的抗凝方案进行调整,一般使用低分子肝素进行桥接抗凝。针对拔牙、胃肠镜等微创操作,众多指南明确推荐可不停用抗凝药物进行操作[1,2];但在实际医疗中,根据临床实际情况,仍有操作医师考虑出血风险,停用抗凝药物。在本研究中,探索使用NOAC 代替低分子肝素进行桥接的可行性,最终结果显示,在围手术/操作期以及随后的30 天内,均未发生血栓与出血事件,同时患者在围手术/操作期前后的INR 基本保持稳定;术前有3例患者INR 不达标,术后1 周有12 例患者INR 未达到2.0~3.0,有7 例患者INR 未达到1.8~3.0;术后INR 不达标的原因可能是术后华法林治疗时间相对较短,其疗效暂未稳定。
NOAC 是近年来应用逐渐广泛的一类抗凝药物。相较华法林,NOAC 主要经过肾脏排泄,药物半衰期短,起效和失效速度较快,药代动力学也更加稳定。在围手术/操作期,对于肾功能正常的患者,NOAC 的停药时间一般短于华法林,缩短抗凝空白期、降低栓塞风险的同时,也有利于降低出血风险。
在RE-LY、ROCKET-AF、ARISTOTLE 和ENGAGE AF-TIMI 48 的相关亚组研究[8~11]以及PAUSE研究中[12],对于NOAC 围手术/操作期的使用有如下认识:第一,相较华法林,NOAC 在围手术/操作期使用是安全有效的;第二,鉴于NOAC 的半衰期较短,围手术/操作期无需使用肝素进行桥接;第三,NOAC在围手术/操作期的使用需评估患者的肾功能以及出血风险。同时相关指南给出明确建议[3],使用NOAC 抗凝的患者,在围手术/操作期无需使用肝素类药物。因此,对于使用NOAC 的患者,在围手术/操作期无需桥接抗凝,对于一些低出血风险的手术/操作,甚至无需停药。
基于上述原因,故选择使用NOAC 作为桥接抗凝药物,实际上是在围手术/操作期进行了抗凝药物的转换,利用NOAC 半衰期短、起效与失效均迅速的特性,尽可能平衡患者的出血与栓塞风险。同时结合对出血风险的考虑,制定了相关抗凝方案。从试验结果看,无一例在围手术/操作期发生严重的栓塞事件与出血事件,术后一周患者INR 基本满意、且术后30 天内也无不良事件发生,抗凝整体安全有效。这相较传统的肝素桥接有着以下优势:①潜在治疗的经济性;②治疗的方便性,NOAC 口服更加方便,避免了低分子肝素需要皮下注射的痛苦,减轻了相关费用,同时减少了患者、往返医院次数。本研究也存在一定的不足,如纳入患者数量较小,同时也需要随机对照研究来进一步验证此方案。
综上,结合我国目前长期抗凝多选择华法林的情况,对于非瓣膜性房颤患者,采取NOAC 代替肝素类药物在围手术/操作期进行桥接抗凝,是具有一定可行性的,此方案在便捷性和经济性上具备一定的潜力,值得深入的探究。

