黄鳝瘦素和瘦素受体基因克隆及组织分布分析
翁晨虹,张亚洲,李佑杰,许燕燕,周秋白
(1.江西农业大学 生物科学与工程学院,江西 南昌 330045;2.江西农业大学 动物科学技术学院,江西 南昌 330045)
【研究意义】黄鳝(Monopterus albus),是我国特色淡水鱼养殖品种。根据中国渔业年鉴的数据统计,2007—2018 年的12 年间,黄鳝养殖产量由19.619 万t 增长至31.9 万(t最高产量为38.613 7 万t),在我国的经济水产养殖种类扮中演着越来越重要的角色。然而,黄鳝的高密度集约化养殖和高脂饲料的大量投喂导致其代谢紊乱和肝胆疾病频发,危害极大,给该养殖业造成重大的经济损失。瘦素(leptin,Lep)是一种蛋白质类激素,最初是在小鼠被鉴定到的[1],后来在哺乳动物中得到了广泛的研究。其在哺乳动物中主要由脂肪组织产生,在食欲、能量稳态、繁殖、免疫反应和骨形成等生理过程的调控中发挥重要作用[2]。大量报道显示Lep/LepR 系统在鱼类的摄食和能量稳态调节方面发挥重要功能。通过对黄鳝Lep/LepR系统基因的分子克隆及组织表达特性分析,为硬骨鱼瘦素系统进化提供新见解,给黄鳝生殖及营养代谢研究提供一定的基础。【前人研究进展】在硬骨鱼类中最先是在河豚(Takifugu rubripes)中鉴定到了Lep的存在,并且主要在肝脏中表达[3]。随后在其他很多硬骨鱼中对Lep进行的广泛的研究,发现其与哺乳动物Lep 的同源性很低,但是其预测的蛋白的三维结构却在哺乳动物和硬骨鱼中是保守的[4-7]。到目前为止,所有研究显示在的哺乳动物和两栖动物都只表达了一种Lep 的同源物,然而在硬骨鱼似乎主要有两种Lep基因即LepA和LepB基因。目前已经在多种鱼类同时鉴定到LepA和LepB基因,包括斑马鱼(Danio rerio)[8]、石斑鱼(Epinephelus coioides)[4]、鲤鱼(Cyprinus carpio var.Jian)[9]、大西洋鲑鱼(Salmo salar)[10]、虹鳟鱼(Oncorhynchus mykiss)[11]及半滑舌鳎(Cynoglossus semilaevis)[12]等,而在河豚[3]、银花鲈鱼(Morone saxatilis)[13]及海马(Hippocampus erectus)[5]却只发现了一种LepA基因。Lep 的生理作用是由膜相关的瘦素受体(leptin receptor,LepR)介导的,在哺乳动物已知至少有6 种LepR 亚型,而只有长亚型具有细胞内功能域。硬骨鱼的LepR基因已经在多种鱼中被鉴定出来,值得注意的是,在大西洋鲑鱼,欧洲鳗鱼(Anguilla anguilla)和日本鳗鱼(Anguilla japonica)同时鉴定到了两个不同的LepR 类型(LepRa1/Lepra2或LepRa/LepRb),它们之间的功能差异还需要进一步的研究。【本研究切入点】目前,虽然已经在哺乳动物及多种硬骨鱼类中克隆到了Lep和LepR基因,但在合鳃目鱼类中还未见其基因克隆于表达方面的研究报道。【拟解决的关键问题】通过克隆分别获得Lep和LepR基因ORF序列,并对其进行生物信息学分析和组织分布表达分析,为探明黄鳝Lep/LepR系统在生殖及营养代谢的分子调控机制提供参考。
1 材料与方法
1.1 试验材料
所有动物试验均经江西农业大学动物保护与利用专业委员会批准。实验用鱼为约1 冬龄的未成熟雌性黄鳝,取自江西农业大学水产养殖基地。在室外水塘中网箱中饲养,自然光照,每天18:00用商品化黄鳝饲料饱食投喂1次。
1.2 总RNA提取和cDNA的合成
采用Vazyme 公司的RNA-easy Isolation Reagent 试剂盒提取总RNA,操作过程所用耗材均为无RNA酶耗材,其它用品均用DEPC 水处理。总RNA提取的具体步骤参考试剂盒操作手册进行。第一条cDNA模板链的合成参考HiScript Ⅲ1stStrand cDNA Synthesis Ki(tVazyme)逆转录试剂盒说明书操作步骤进行。
1.3 基因克隆
从NCBI 数据库黄鳝基因组数据库搜索包含完整开放阅读框(ORF)的黄鳝Leptin和LeptinR基因cDNA序列(XM_020613040、XM_020602810),利用Primer Premier 5在ORF上下游分别设计2对基因特异性引物(表1),引物有生工生物工程(上海)股份有限公司合成。以黄鳝肝脏第一链cDNA 为模板,用高保真PCR 试剂盒2×Phanta Max Master Mix(Vazyme)进行PCR 扩增。扩增程序如下:95 ℃预变形5 min;95 ℃,15 s,56 ℃,20 s,72 ℃,1 min,进行35个循环;72 ℃,5 min;4 ℃保存。PCR 产物分别用1.0%琼脂糖凝胶进行电泳,利用胶回收/DNA 纯化试剂盒FastPure Gel DNA Extraction Mini Ki(tVazyme)将目标条带回收、纯化,再用TA 克隆连接试剂盒5min Universal Ligation Mix(Vazyme)将目标片段连接到pUCm-T 载体(上海生工),然后转化到感受态细胞DH5α中进行蓝白斑筛选。挑取白色菌落进行菌液PCR鉴定,选取阳性克隆送生工生物工程(上海)股份有限公司测序。
1.4 生物信息学分析
使用ORF Finder 服务器(https://www.ncbi.nlm.nih.gov/orffinder/)确定ORF 位置,并推导出氨基酸序列;利用SignalP5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜域。使用Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行序列比对,并手动修改。用ExPASy(http://web.expasy.org/compute_pi/)分析蛋白的分子质量和等电点。二级和三级蛋白质结构由自动化蛋白质建模服务器的ProModII(http://www.expasy.org/swissmod/SWISS-MODEL)进行估算。氨基酸序列通过ClustalW2(https://www.ebi.ac.uk/Tools/msa/clustalw2/)进行分析,并用MEGA6.0构建系统发育树。
1.5 实时荧光定量PCR
利用Applied Biosystems StepOneTM Real-Time PCR System 对黄鳝中Leptin和LeptinR在各个组织中的表达情况进行实时荧光定量分析。荧光染料为ChamQ Universal SYBR qPCR Master Mix(Vazyme)。目的基因和内参基因引物见表1。采用10µL 反应体系:5µL ChamQ Universal SYBR qPCR Master Mix、上下游引物各0.5µL、1µL cDNA 模板、3µL ddH2O。序为:95 ℃预变性1 min;95 ℃10 s,58 ℃15 s,72 ℃20 s,40个循环;熔解阶段95 ℃15 s,65 ℃1 min、95 ℃15 s、0.5 ℃/20 s,每个样品3个重复,待反应结束后进行荧光值变化曲线和溶解曲线分析。利用2-ΔΔCT方法分析数据最终结果。
2 结果与分析
2.1 黄鳝Lep和LepR基因ORF序列的克隆
以黄鳝肝脏组织总cDNA 为模板,通过特异性引物(表1)进行巢式PCR 的方法进行目的片段的克隆。用第一轮PCR 特异性引物扩增后得到多条弥散条带(图1A、C),将第一轮PCR 产物稀释100 倍后,用第二轮PCR 特异性引物扩增分别得到600 bp 左右(图1B)和3 000 bp 左右(图1D)的特异性条带。将目的条带回收后,连接到pUCm-T 载体上送生工生物工程(上海)股份有限公司进行测序,结果显示其序列和基因组预测的序列一致。
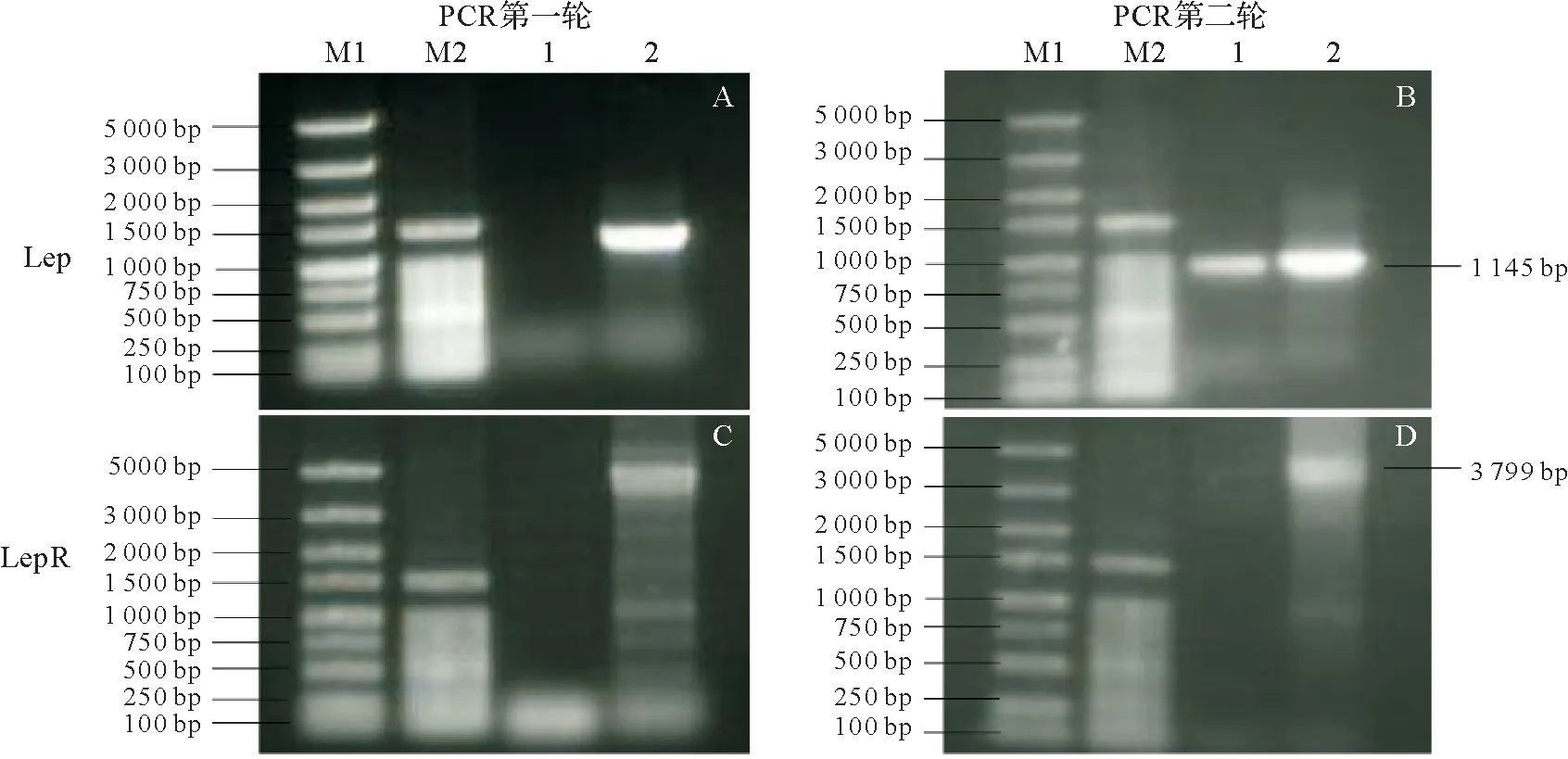
图1 黄鳝肝脏巢式PCR特异性扩增试验结果Fig.1 Results of nested PCR specific amplification test in the Monopterus albus liver

表1 研究所用引物序列Tab.1 Sequence of primers in this research
2.2 黄鳝Lep和LepR氨基酸序列特征分析
分析结果如图2A所示,Lep基因ORF长度为486 bp,编码161个氨基酸。利用SignalP 5.0 Server预测Lep 前体由20 氨基酸信号肽和140 氨基酸的成熟肽组成。成熟Lep 蛋白的预测分子量为15.62 ku,等电点为5.57,此外,还含有两个保守的特征半胱氨酸残基参与二硫键的形成。三维结构模型预测显示黄鳝Lep蛋白由4个α-螺旋组成(图3C),并且和人Lep蛋白有很高的三级结构一致性(图3A、B)。
结果如图2B 所示,LepR基因ORF 长度为3 537 bp,编码1 178 个氨基酸。深入分析发现,LepR蛋白预测含有1 个38 氨基酸的信号肽、1 个775 氨基酸胞外片段、1 个23 氨基酸单跨膜结构域和1 个342-氨基酸胞内片段。黄鳝LepR 的Lep 结合域估计为第401~609 个氨基酸残基。另外,黄鳝LepR 也包含脊椎动物LepR 中一些重要的功能域,包括3 个纤连蛋白III 型结构域、1 个免疫球蛋白结构域。

图2 黄鳝Lep(A)及LepR(B)的核苷酸序列及推断氨基酸序列Fig.2 The nucleotide sequence and deduced amino acid sequence of Monopterus albus Lep(A)and LepR(B)
2.3 序列同源性分析
不同物种的Lep 蛋白的多个氨基酸序列比对如图3C 所示。在蛋白质水平上,黄鳝Lep 蛋白与斜带石斑鱼(90.68%)、条纹鲈(80.75%)、尼罗罗非鱼(79.50%)、半滑舌鳎(65.00%)、青斑河豚(52.50%)、和红鳍东方鲀(52.35%)具有较高的同源性,然而与其他鱼类中报道的Lep 蛋白序列同源性下降到相对较低的水平(16.33%~29.33%)(表2)。

表2 黄鳝Lep氨基酸序列与其他物种百分比一致性比较Tab.2 Percent amino acid sequence identities among leptin of Monopterus albus and other species
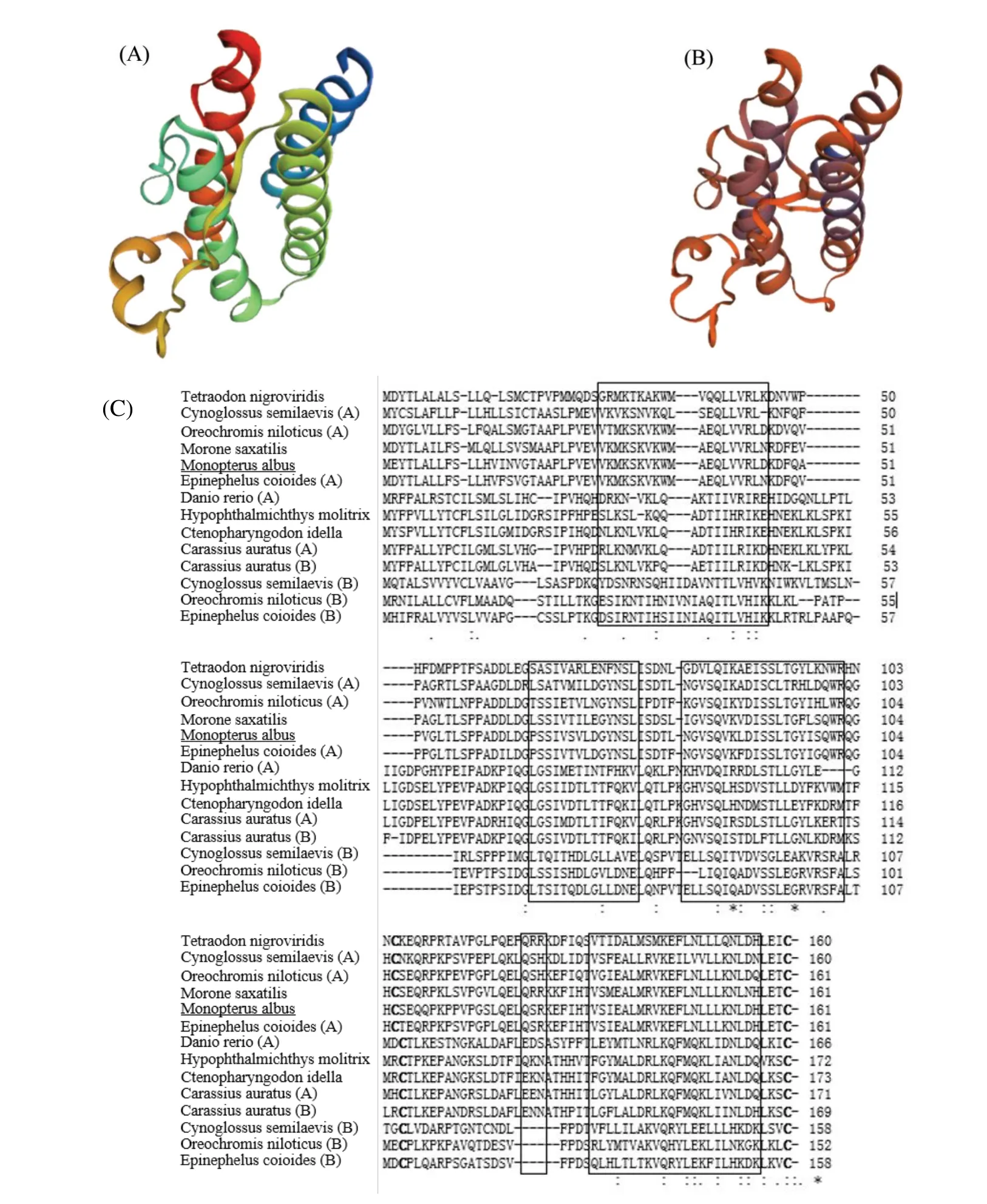
图3 黄鳝Lep的分子特征Fig.3 Molecular characterization of Monopterus albus leptin
此外,黄鳝LepR 与大黄鱼(78.55%)、斜带石斑鱼(78.08%)、大菱鲆(74.57%)、尼罗罗非鱼(70.11%)序列同源性较高,其次是半滑舌鳎(61.87%)、红鳍东方鲀(62.65%)、青鳉(55.52%)和大西洋鲑(50.23%),而与其他非鱼类物种的同源性很低,都通常低30%(表3)。

表3 黄鳝LepR氨基酸序列与其他物种百分比一致性比较Tab.3 Percent amino acid sequence identities among leptin receptor of Monopterus albus and other species
2.4 构建基因系统进化树
Lep 和LepR 蛋白的系统发育树被构建了出来,其中包含克隆到的黄鳝Lep 和LepR 序列。系统发育上,黄鳝Lep 与硬骨鱼棘鳍总目报道的Lep 亲缘关系较近,与鲑形目和鲤形目的亲缘关系较远(图4A)。同样,黄鳝LepR也属于硬骨鱼棘鳍总目LepR分支,与鲑形目和鲤形目分支较远(图4 B)。

图4 Lep(A)和LepR(B)在脊椎动物中的系统发育分析Fig.4 Phylogenetic analysis of Lep(A)and LepR(B)in vertebrates
2.5 黄鳝Lep和LepR基因表达的组织分布
通过荧光定量PCR 技术研究了黄鳝Lep和LepR基因在14种组织中的表达情况。结果显示,Lep基因主要在下丘脑、大脑、胃、后肠、皮肤以及卵巢中表达,并且在胃中表达量最高(图5A),在其他所检测的组织中表达量很低或不表达。Lep基因除肾脏和前肠以外的大部分组织均有明显表达,且在下丘脑、大脑、肝脏、胃以及卵巢中有着较高的表达量(图5B)。

图5 Lep(A)及LepR(B)mRNA在黄鳝各组织中的相对表达量Fig.5 Relative expression of Lep(A)and LepR(B)mRNAs in various tissues of Monopterus albus
3 讨论与结论
从黄鳝的肝脏中分离了编码Lep和LepR的ORF序列,这是第一次在合鳃目鱼类中鉴定到Lep/LepR系统的存在。生物信息学分析发现尽管与其他脊椎动物中Lep的氨基酸序列差异很大(表1),但从预测三维结构来看,黄鳝Lep 与包括人类在内的其他已确认的Lep 之间的三级结构具有很强的保守性(图3A),包含4个a-螺旋结构域,该序列和结构特征与其他所有报道的鱼类相一致[4-5,11,14-15]。说明这种保守的Lep晶体结构可能对Lep/LepR结合亲和性起到重要作用。有意思的是,目前已经在多种鱼类(如斑马鱼[8]、石斑鱼[4]、鲤鱼[9]、大西洋鲑鱼[10]、虹鳟鱼[11]及半滑舌鳎[12]等)同时鉴定到两种Lep基因,分别命名为LepA和LepB,这可能起源于鱼类进化早期的基因组复制。但在黄鳝中却只发现了一种Lep基因,这与河豚[3]、银花鲈鱼[13]及海马[5]等鱼类相似,并且分析发现黄鳝的Lep基因与鱼类的LepA同源性更高,且在进化上也属于同一分支,因此推测黄鳝Lep基因可能属于LepA亚型家族。
黄鳝与其他脊椎动物一样都只发现单一的LepR基因,预测蛋白结构分析显示LepR为一种单次跨膜受体,包含一些重要的功能域包括3个纤连蛋白III型结构域、1个免疫球蛋白结构域以及Lep结合域,在于在半滑舌鳎[12]、日本鲭[6]等鱼类中的研究一致。说明LepR 除介导Lep的生理功能外还可能发挥更加丰富的生理作用。有研究发现重组LepA 比LepB 对尼罗罗非鱼的LepR 有更高的亲和力[7],暗示LepR 在鱼体内主要介导LepA 的生理作用,而LepB基因的生理功能和意义仍然未知。另外,在大西洋鲑鱼[22]和尼罗罗非鱼[7]中报道了多个LepR剪接变异体的存在。然而,黄鳝中并没有检测到剪接变异体。
在脊椎动物中,LepmRNA的组织分布差异很大。哺乳动物的Lep主要在脂肪组织中合成[7]。与哺乳动物不同,LepA主要在河豚[3]、鲤鱼[16]、青鳉[14]、虹鳟鱼[17]、条纹鲈鱼[13]、白云山鲦鱼[18]、异齿裂腹鱼[19]、大黄鱼[20]及大口黑鲈[21]等鱼的肝脏中表达,这表明肝脏是Lep在这些物种中表达的主要部位,这也可能是肝脏富含脂质的原因。在其他硬骨鱼中,在石斑鱼[4]、大西洋鲑鱼[22]、海马[5]和半滑舌鳎[12]的大脑中可以检测到相当程度的LepAmRNA,而在外周组织中,LepAmRNA主要在卵巢中表达[4-5,12,22]。Lepb的表达广度要远低于LepA,仅在脑、眼睛及卵巢有较高量的表达[4-5,14]。同样,在黄鳝的脑和卵巢中也观察到高水平的LepmRNA 表达,这暗示Lep可能和其他鱼类一样在生殖过程中起重要生理作用。出乎意料的是LepmRNA的最高表达量出现在黄鳝的胃中,这可能和黄鳝独特的摄食习性有关。另外,在之前的报道中LepRmRNA 在大西洋鲑鱼[22]、欧洲鳗鱼[23]、欧洲鲈鱼[24]和海马[5]以及半滑舌鳎[12]的卵巢中表达最为丰富。在黄鳝中也观察到了相似的情况,卵巢中的LepR表达丰度很高仅次于下丘脑。
综上所述Lep和LepR在鱼卵巢中都有表达量较高,而在黄鳝中的表达模式与其他报道的鱼类高度相似,提示Lep/LepR系统可能在黄鳝的生殖及营养代谢方面发挥重要作用。到目前为止,对鱼类Lep 的研究多集中在能量代谢方面,而关于鱼类Lep 生殖功能的报道有限[25]。在黄鳝中对Lep/lepr系统的研究结果,将有助于鱼类瘦素系统在生殖及营养代谢功能方面作用的探索。
致谢:江西省教育厅科技计划项目(GJJ200449)同时对本研究给予了资助,谨致谢意!

