泊洛沙姆188、碳酸氢钠和HEPES 对CPV ID3 细胞株生长的影响
孙晓莹,李国军,王延涛,侯喜林
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.上海迈邦生物科技有限公司)
犬细小病毒病是由犬细小病毒(Canine parvovirus,CPV)感染幼犬引起的一种急性传染病,以剧烈的呕吐、出血性肠炎和白细胞显著减少以及心肌炎为主要特征,是危害我国养犬业最为严重的传染病之一,可造成严重的经济损失[1-2]。
随着生物技术的发展,单克隆抗体在疾病诊断,治疗和预防方面的应用日益广泛,使得大规模培养包括杂交瘤细胞在内的动物细胞生产单克隆抗体变得十分必要[3-5]。而动物细胞无细胞壁,在悬浮培养条件下,对环境变化和剪切力敏感[6]。在摇瓶或生物反应器等容器中体外悬浮培养细胞时,容器内的搅拌和摇晃会产生剪切力以及培养液出现气泡,这些均会对细胞造成损害。细胞培养最适的pH 值随培养的细胞种类不同而不同,大多数细胞的适宜pH 值为7.0~7.4,偏离此范围可能对细胞生长将产生有害的影响[7]。
细胞培养基提供细胞赖以生存的环境,培养基中营养物质的添加等,对于改善细胞代谢、细胞生长状态、提高抗体表达水平等均至关重要[8-10]。在细胞培养基中使用最广泛的剪切保护剂之一是泊洛沙姆188(Poloxamer 188,P188),以商业名称如 Pluronic F-68、Kolliphor® P188 和 SynperonicTM等[11]被人所知。细胞培养基pH 的维持依靠一种或多种缓冲体系,最常见的包括NaHCO3-CO2、磷酸盐和HEPES 等,血清也可以作为完全培养基的缓冲液。哺乳动物细胞多数利用NaHCO3-CO2作为培养基中的缓冲体系,气相中的CO2浓度应与培养液中NaHCO3浓度相对应,如气相或培养箱空气中CO2浓度设定在5%,培养液中NaHCO3的加入量应为1.97 g·L-1[12]。然而缓冲体系仅为NaHCO3-CO2的培养基,pH 值非常不稳定,培养基储存或暴露一定时间后容易偏碱。而HEPES 可以防止暴露于空气中的培养基的pH 迅速变动,能较长时间控制pH 在恒定范围内[13]。
通过在无血清培养基中添加抗剪切力的表面活性剂及缓冲物,来研究培养液中剪切保护(P188)、缓冲物(HEPES 和 NaHCO3)对 CPV ID3 细胞株生长的影响。
1 材料和方法
1.1 材料
1.1.1 细胞株
细胞株名称为CPV ID3,属于杂交瘤细胞株,能够稳定分泌抗犬细小病毒单克隆抗体,由哈尔滨元亨生物实验室提供。
1.1.2 主要试剂
无血清培养基干粉(不含P188、HEPES 和NaHCO3),源自上海迈邦生物;P188,购自 BASF;HEPES,购自 SIGMA;NaHCO3、NaOH,国产分析纯。
1.2 方法
1.2.1 配制无P188,含2 g·L-1NaHCO3的无血清培养基原液
称取配制液体培养基终体积70%的超纯水(18~25 ℃)于指定容器内,缓慢加入培养基干粉,搅拌30 min 直至干粉全部溶解成为混悬液;按照2 g·L-1的量加入NaHCO3粉末,搅拌10 min 直至完全溶解;使用5 mol·L-1NaOH 溶液调节液体培养基的pH 值至6.9~7.2;定容至液体培养基终体积的80%,继续搅拌 10 min;用 0.22 μm 滤器过滤除菌,2~8 ℃避光储存,备用。
1.2.2 配制含 1.0 g·L-1P188,无 HEPES 和 1.5 g·L-1NaHCO3的无血清培养基原液
称取配制液体培养基终体积70%的超纯水(18~25 ℃)于指定容器内,缓慢加入培养基干粉,搅拌30 min 直至干粉全部溶解成为混悬液;加入1.0 g·L-1的P188,1.5 g·L-1的碳酸氢钠粉末,继续搅拌10 min直至完全溶解;使用5 mol·L-1NaOH 溶液调节液体培养基的的pH 值至6.9~7.2。定容至液体培养基终体积的90%,继续搅拌10 min;用0.22 μm 滤器过滤除菌,2~8 ℃避光储存,备用。
1.2.3 配制添加剂的浓缩液
100 g·L-1P188,7.5% NaHCO3,5 mol·L-1NaOH,1 mol·L-1HEPES,超纯水,以上试剂均需用 0.22 μm滤膜,过滤除菌之后再使用。
1.2.4 研究P188 对细胞生长的影响
按 1.2.1 方法配制培养原液,设 1、3、6、9、12、15 g·L-16 个P188 添加浓度,确保培养基其它成分浓度一致,测定 pH 和渗透压,pH 值在 pH 7.2~7.4 之间。
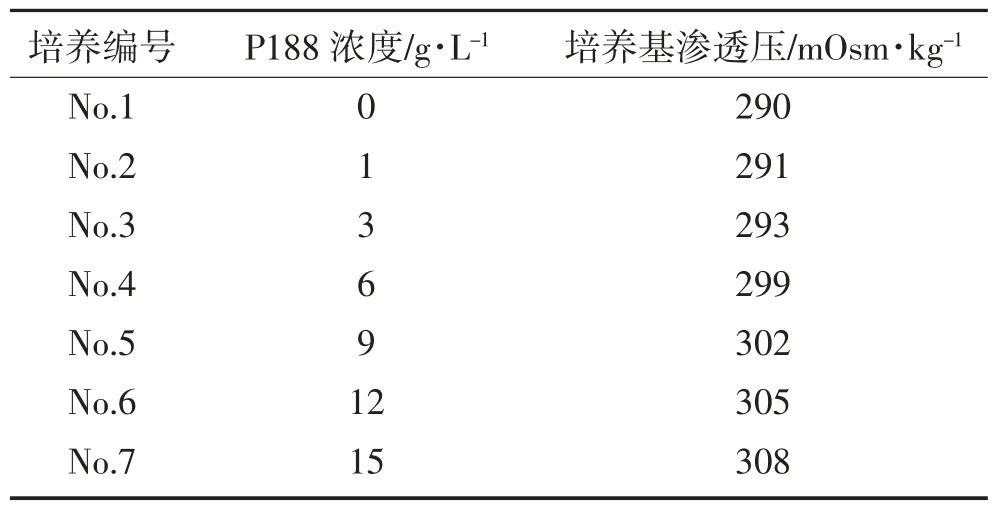
表1 含不同P188 浓度的培养基测试方案Table 1 Test protocol and osmotic pressure of culture media containing different concentrations of P188
1.2.5 研究NaHCO3、HEPES 对杂交瘤细胞影响
按 1.2.2 方法配制培养基原液,设 1.5、2.0、2.5 g·L-1三个NaHCO3添加浓度,在每个NaHCO3添加浓度下再设四个 HEPES 添加浓度,分别是 0、10、20、25 mmol·L-1的,确保培养基其它成分浓度一致,测定pH 和渗透压,pH 值在 7.2~7.4 之间。
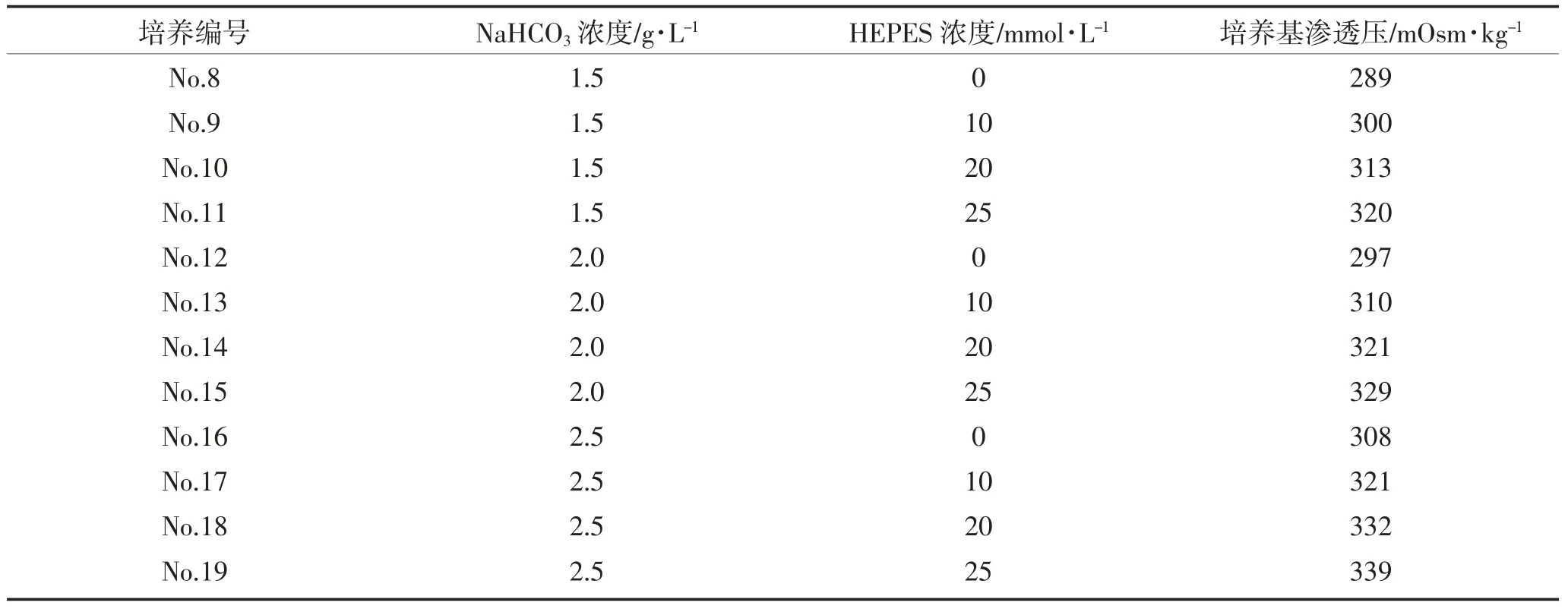
表2 含不同NaHCO3 和HEPES 浓度的培养基测试方案及其渗透压Table 2 Test protocol and osmotic pressure of culture media containing different concentrations of NaHCO3 and HEPES
1.2.6 细胞培养
采用批次培养方式,种子细胞液1 000 rpm,离心3 min,弃上清,使用新鲜培养基重悬细胞沉淀接种于125 mL 摇瓶内,工作体积30 mL,接种密度0.5×106cells·mL-1,于 5% CO2,36.5 ℃,120 rpm 的摇床内培养。
1.2.7 检测方法
培养过程中,每隔24 h 从摇瓶中取200 μL 样品,检测细胞密度、细胞活率、乳酸浓度。使用Counstar 细胞计数仪来检测细胞密度和细胞活率;使用SBA-40E 型葡萄糖-乳酸分析仪检测乳酸的浓度。
1.2.8 蛋白表达量的测定
细胞培养结束后,将样品于12 000 rpm,离心10 min 后,取上清于-20 ℃冻存。根据 IgG 的 Fc 片段与Protein A 特异性结合原理,使用HPLC 于280 nm下对其进行检测,采用外标法对样品的抗体表达量进行定量。
1.2.9 计算方法

μ 为细胞生长速率 (d-1),XV为活细胞密度(106cells·mL-1),t 为培养时间(d)。
1.2.10 培养基质量的评价
根据细胞培养过程中活细胞密度、细胞活率,绘制杂交瘤细胞生长曲线;计算各实验组的细胞生长速率;测定培养结束后收获样品中的抗体总表达量。根据以上的数据来评价各实验组培养基的质量。
2 结果与分析
2.1 CPV ID3 细胞株在含不同浓度P188 的培养基中的细胞生长表现
图1 结果显示No.2 实验组细胞在接种后第3 天达到最大活细胞密度,然后直接开始下降,平台期不明显;No.1、No.3、No.4、No.5、No.6 实验组细胞均在第3 天达到最大活细胞密度,之后存在一个明显的平台期(第3~4 天),第4 天活细胞密度开始明显下降;No.7实验组的平台期为第3~4 天,在第4 天达到最大活细胞密度,说明随着培养基中的P188 含量的增加,细胞达到最高活细胞密度所需的时间越长。
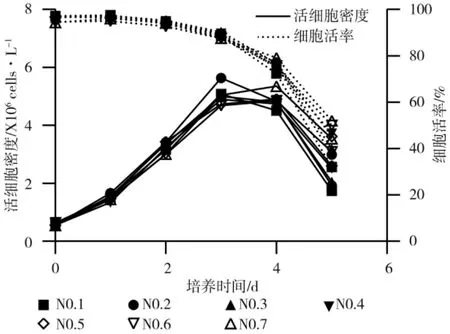
图1 不同P188 浓度的培养基中细胞的生长曲线Fig.1 Growth curve of cells in medium with different P188 concentrations
表3 结果显示,随着培养基中P188 浓度的增加,细胞生长速率越小,第5 天收获时的细胞活率越高,说明培养基中P188 浓度越高,细胞高密度维持时间越长。与不含P188 的培养基No.1 对照组相比,5天内No.2~No.7 实验组抗体表达量分别提高了3.15%、9.53%、16.54%、19.54%、24.65%、25.08%,说明随着培养基中P188 浓度的增加,抗体表达量越高,其中No.6 和No.7 实验组的抗体表达量最高。与No.1 对照组相比,No.2~No.7 实验组,细胞生长速率明显提高,均在0.84~0.9 d-1之间,与No.2 实验组相比,No.3 与No.7 组,细胞生长速率随着培养基中P188 浓度的增加,逐渐降低。此外,培养基中P188 浓度为1g·L-1时,最高活细胞密度最大,细胞生长速率值最大。

表3 不同P188 浓度的培养基中细胞批式培养过程的主要参数比较Table 3 Comparison of the main parameters in batch culture of cells in medium containing different P188 concentrations
2.2 CPV ID3 细胞株在不同浓度的NaHCO3 和HEPES 环境中的生长表现
图2(a)所示为细胞的生长曲线,结果显示细胞在接种后的24 h 内有一个细胞生长延迟期,然后进入细胞对数生长期,第3~4 天为平台期,最大活细胞密度均在接种第4 天达到最大值,第5 天细胞活率开始下降。图2(b)所示为细胞在不同浓度的NaHCO3和HEPES 培养基中的乳酸积累量变化曲线,结果显示在培养过程中,随着细胞生长,乳酸不断积累,乳酸累积量在第2 天基本达到最大值,第3、第4 天略有增长,第 5 天开始下降,其中第 2 天 No.8~No.11 实验组的乳酸含量平均值为17.8 mM,No.12~No.15 实验组的乳酸含量平均值为22.5 mM,No.16~No.19 实验组的乳酸含量平均值为27 mM,说明实验组培养基中NaHCO3浓度越高,细胞对数生长期乳酸的增长速率越快,乳酸累积值越高。

图2 不同浓度NaHCO3 和HEPES 培养基中细胞的生长曲线和乳酸积累曲线(a)生长曲线(b)乳酸积累曲线Fig.2 The growth curve and lactic acid accumulation curve of cells in different NaHCO3 and HEPES concentration medium(a)growth curve(b)lactic acid accumulation curve
表4 结果显示对于培养基中NaHCO3浓度的研究,从细胞生长表现方面来看,随着培养基中NaHCO3浓度越高,细胞的最高活细胞密度和细胞生长速率越高、收获时的细胞活率越低;从抗体表达量方面来看,培养基中NaHCO3含量越高,细胞生长速率越大,细胞密度维持时间越短,抗体表达量越低。对于培养基中HEPES 浓度的研究,从细胞生长表现方面来看,培养基中NaHCO3浓度一定时,HEPES 浓度越高,蛋白表达量越高。
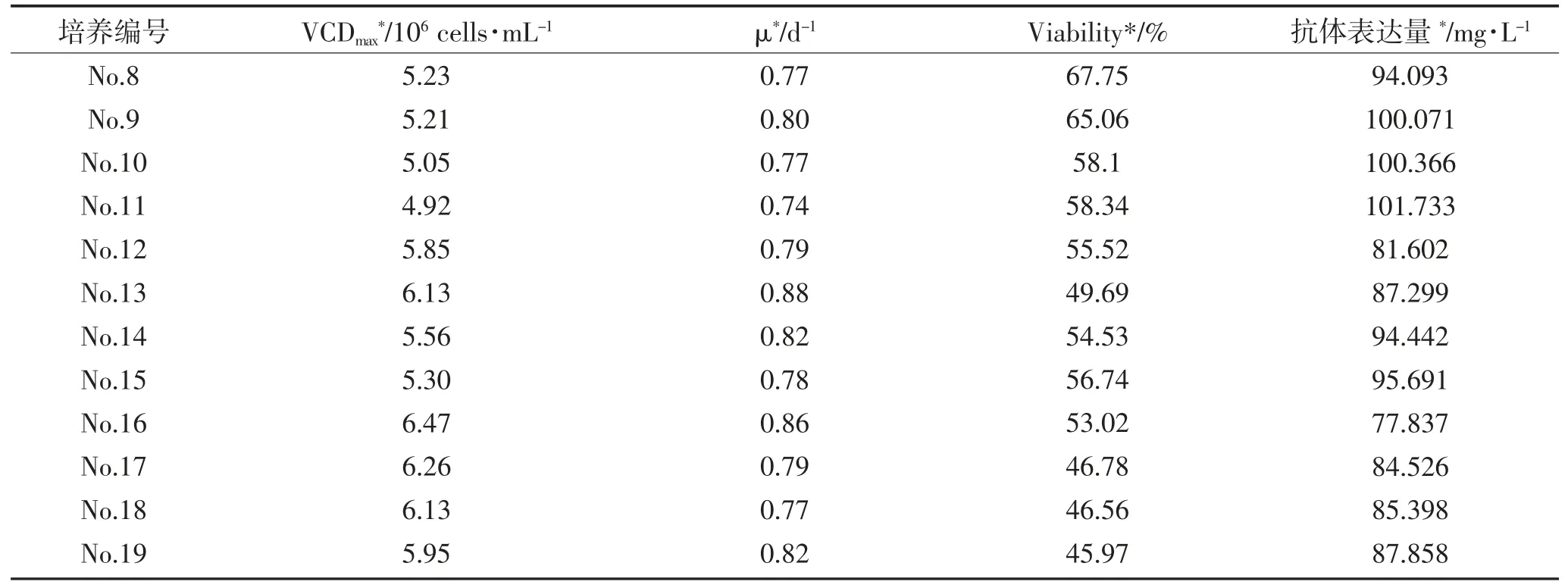
表4 不同浓度NaHCO3 和HEPES 培养基中细胞批式培养过程的主要参数比较Table 4 Comparison of the main parameters in batch culture of cells in medium containing different NaHCO3 and HEPES concentration
3 讨论
3.1 P188 对CPV ID3 细胞株的影响
与细胞培养基中的其他营养补充剂相比,剪切保护剂是独特的添加剂,被广泛用于保护细胞免受培养过程中的气泡和搅动所带来的损害。在细胞培养基中使用最广泛的剪切保护剂之一是P188,P188是一种非离子表面活性剂,平均分子量为8.4 kDa,亲水-亲脂平衡(HLB)为 29.16[14]。Peng H 等研究认为P188 是通过降低液体表面张力,增加气泡的诱导时间等方面,减小气泡破裂期间的剪切力,增加细胞与气泡的附着时间,降低细胞的流动性,从而增加细胞对剪切力的抵抗力[15]。
在培养基其他营养成分含量和培养条件一定时,培养基中 P188 浓度在 0~15 g·L-1范围内,添加一定量的P188 对细胞密度和活率的维持及抗体表达量有积极的影响,且随着P188 浓度越高,培养液的粘度越大,培养后期细胞高密度维持时间越长,也反应出P188 对细胞有保护作用;P188 通过提高细胞对剪切力的抵抗力,延长细胞培养时间,从而增加细胞的抗体表达量。此外,试验采用的是批次培养方式,如果进行流加培养,鉴于P188 对细胞密度和活率维持有积极作用,随着培养时间的延长,抗体表达量应该可以提高得更多[16-17]。
3.2 NaHCO3 和 HEPES 对 CPV ID3 细胞株的影响
CPV ID3 杂交瘤细胞细胞株属于哺乳动物细胞,因此,培养基使用了NaHCO3和HEPES 两种缓冲物质,采用开放式培养,使细胞代谢产生的CO2及时逸出培养瓶,再通过培养箱中5%CO2浓度,与培养基中的NaHCO3构成缓冲体系,从而调节培养基的pH 值。但在细胞培养操作过程中,取样观察细胞时,培养基脱离了5% CO2的环境,CO2气体逸出,pH 会迅速升高,会对细胞的生长产生不利的影响;若加了HEPES,此时可以维持pH 在7.2 左右。HEPES 是一种非离子两性缓冲液,在pH 7.2~7.4 范围内具有较好的缓冲能力[13]。培养基在空气中暴露时,培养基中HEPES 浓度越高,培养基pH 值越稳定。因此无血清培养基中缓冲物质最好既含有NaHCO3又含有HEPES。
试验过程中发现,培养基中每增加1 g·L-1的P188,培养基的渗透压增加约 1 mOsm·kg-1,P188 对渗透压的影响不大;在培养基中NaHCO3浓度为1.5 g·L-1的基础上,每增加 0.5 g·L-1的 NaHCO3,培养基的渗透压约增加10 mOsm·kg-1,可见用NaHCO3调节培养基的pH 值时,会对渗透压有较大的影响;HEPES 浓度在0~25 mM 含量范围内,每增加5 mM 的HEPES,培养基的渗透压增加 5~7 mOsm·kg-1,HEPES 也在一定程度上提高了培养基的渗透压。溶液的渗透压,依赖于溶液中溶质粒子的数量,通常以渗透压摩尔浓度(Osmolality)来表示,它反映的是溶液中各种溶质对溶液渗透压贡献的总和[18]。细胞需在适当的渗透压环境中生长,因此渗透压是培养基必要的质量控制项目之一,哺乳动物细胞培养基的摩尔渗透压浓度设计范围应为260~320 mOsm·kg-1,基本上模拟了培养基加血清的渗透压浓度(290 mOsm·kg-1)[13]。
从渗透压角度来看试验的抗体表达量结果,发现培养基HEPES 浓度在0~25 mM 范围内,HEPES浓度与培养基渗透压和抗体表达量成正比;而培养基中 NaHCO3浓度在 1.5~2.5 g·L-1范围内,NaHCO3浓度与培养基渗透压,乳酸生成量成正比,与抗体表达量成反比。这一结果也与Ozturk S S、张立等[19-20]的研究结果相类似。Ozturk S S 等[19]研究认为在高渗透压条件下,细胞生长速率下降和单细胞抗体生成速率提高;张立等[20]认为随着乳酸浓度的升高,培养基渗透压提高,单细胞抗体生成速率提高,但高乳酸浓度会抑制细胞生长,使细胞密度降低,最终单抗总表达量下降[20-21]。所以NaHCO3浓度与抗体表达量成反比的因素之一可能是培养基中NaHCO3浓度对细胞乳酸生成的影响造成的:培养基中NaHCO3浓度越高,乳酸的生成速率越快,乳酸浓度越高,进而抗体表达量越低。此外,由于检测手段的局限,NaHCO3和HEPES 对CPV ID3 细胞株的影响,可能有很多其他的因素没有观察到。
由于 NaHCO3浓度在 1.5 ~2.5 g·L-1范围内,NaHCO3浓度与细胞生长速率,最高活细胞密度和乳酸积累量成正比,与抗体表达量成反比。平衡这几种作用,2 g·L-1NaHCO3为较优选择。在 NaHCO3浓度一定时,HEPES 浓度与抗体表达量成正比,与最高活细胞密度成反比;当HEPES 浓度为10 mM 时,细胞生长速率最大;当 HEPES 浓度大于 10 mM 时,HEPES 浓度与细胞生长速率成反比,而且HEPES 价格很高,平衡这些因素,10 mM 的HEPES 浓度为较优选择。因此,针对于CPV ID3 细胞株,培养基中的NaHCO3和HEPES 的最适浓度分别为2 g·L-1和10 mM。
4 结论
针对CPV ID3 细胞株,在无血清培养基中添加P188 可以延长细胞密度维持时间,提高抗体表达量;培养基中的NaHCO3和HEPES 的最适浓度分别为2 g·L-1和 10 mM。

