乙醇和乙酸常见考点例析
■马亚楼
乙醇和乙酸是高中化学中常见的两种重要的有机化合物,为了更好地帮助同学们学习,现将其常见的考点进行分类例析。
一、乙醇、乙酸的性质
例1 下列说法错误的是( )。
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点都比C2H6、C2H4的沸点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
由于酒精调制的酒可以饮用,食醋的主要成分为乙酸,即乙醇和乙酸都是生活中的调味品,故A 项正确。C2H6、C2H4常温下是气态,而乙醇和乙酸常温下是液态,故B 项正确。乙醇可以发生催化氧化,也可以燃烧,乙酸燃烧发生氧化反应,故C 项正确。乙醇和乙酸在浓硫酸催化作用下发生酯化反应生成乙酸乙酯,酯化反应与酯的水解互为逆反应,故D 项错误。
答案:D
例2 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是( )。
A.硝酸 B.无水乙醇
C.石灰水 D.盐酸
铜片灼烧后生成CuO,插入硝酸或盐酸中,CuO 都溶解,铜片质量减小,排除A、D 两项。插入无水乙醇中,CuO 又被还原为Cu,铜片质量不变,排除B项。插入石灰水中,CuO 不发生变化,铜片质量增加,C项符合题意。
答案:C
二、乙醇发生反应时断键的位置
例3 乙醇分子中各化学键如下所示。
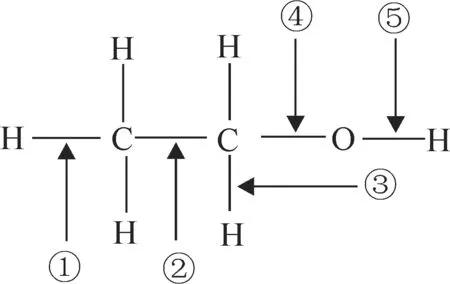
(1)乙醇和金属钠作用时,应断裂键。
(2)乙醇和浓硫酸共热至170℃时,应断裂____键。
(3)乙醇和乙酸、浓硫酸共热时,应断裂____键。
(4)乙醇在铜催化下和氧气反应时,应断裂____键。
(5)乙醇和浓硫酸共热至140℃时,应断裂____键。
(1)乙醇与钠反应时,生成乙醇钠和氢气,即断键的位置是⑤。
(2)乙醇和浓硫酸共热至170℃时,生成乙烯和水,即断键的位置为①④。
(3)乙醇和乙酸、浓硫酸共热时,发生酯化反应,即断键的位置是⑤。
(4)在铜催化和氧气反应时,发生氧化反应,生成乙醛,故应断裂③⑤。
(5)乙醇和浓硫酸共热至140℃时,生成乙醚,故其断键的位置是④⑤。
答案:(1)⑤ (2)①④ (3)⑤ (4)③⑤ (5)④⑤
三、乙醇和乙酸的鉴别
例4 下列物质中可一次性鉴别乙酸、乙醇、苯和氢氧化钡溶液的是( )。
①金属钠 ②溴水 ③碳酸钠溶液④紫色石蕊溶液
A.①② B.①③ C.②③ D.③④
金属钠与乙酸、乙醇和氢氧化钡溶液反应都能生成氢气,都有气泡产生,现象相近,无法鉴别。溴水与乙酸、乙醇不反应且混溶,无法鉴别。碳酸钠溶液与乙酸溶液反应产生气泡,与乙醇不反应但混溶,与苯不反应但溶液分层,与氢氧化钡溶液反应产生白色沉淀,现象各不相同,可鉴别。加入紫色石蕊溶液,乙酸呈红色,乙醇无现象,苯分层,氢氧化钡呈蓝色,可鉴别。
答案:D
四、官能团的考查

A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能发生消去反应
D.1mol苹果酸与Na2CO3溶液反应一定消耗2molNa2CO3
由苹果酸的结构简式可知,其含有羧基,故在一定条件下能发生酯化反应;其含有羟基,故在一定条件下能发生氧化反应;其既含有羧基,又含有羟基,故在一定条件下可发生消去反应。由于1 mol 苹果酸中含有2 mol 羧基,故与Na2CO3溶液反应消耗1molNa2CO3。
答案:D
五、乙醇催化氧化的探究
例6 为探索乙醇氧化的反应机理,某研究性学习小组设计了下列实验方案。
(1)将一根粗铜丝绕成螺旋状,称量得到数值m1g。
(2)取一支试管,加入3mL乙醇。



六、乙醇的综合考查
例7 下列关于乙醇的说法错误的是( )。
A.可用纤维素的水解产物制取
B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体
D.通过取代反应可制取乙酸乙酯
乙醇可以用纤维素的水解产物葡萄糖来制取,故A 项正确。乙烯加成得乙醇,故B 项正确。乙醇分子式为C2H6O,乙醛分子式为C2H4O,即两者不互为同系物,故C 项错误。乙醇和乙酸发生取代反应可制取乙酸乙酯,故D 项正确。
答案:C

