双交联高强度丝蛋白水凝胶的制备与生物学性能研究
杜林 陆雯丽 张晓旭 顾芬
丝素蛋白制成的材料具有高度可调节的物理化学性质,在生物医学应用中得到了广泛探索[1-3]。丝素蛋白已被生物工程化为一系列组织,用于再生医学应用,并已被生物工程化为3D 组织模型,用于在体外测试药物组合和研究疾病进展[4]。使用最广泛的丝素蛋白是从家蚕中分离出来的,具有较低的免疫原性和细胞毒性[1]。
水凝胶是一种高度水化的聚合物网络,可以使用多种方法使丝素蛋白水溶液凝胶化,其中一种制备丝素蛋白水凝胶的方法是通过化学交联。虽然丝素聚合物链主要由非反应性氨基酸和甘氨酸组成,但其确实含有酚性酪氨酸残基(5.3%)[5],可通过辣根过氧化物酶(HRP)和过氧化氢(H2O2)催化,形成双酪氨酸交联[6]。这种酶(HRP/H2O2)交联系统曾用于制备具有高弹性和可调刚度的丝素蛋白水凝胶,可通过蛋白质浓度、分子量和溶剂组成进行调节[7]。有研究发现,当在模拟体内环境(37 ℃,PBS)中培养时,HRP/H2O2制备的RSF 水凝胶会随着时间的推移转变为溶胶,比原始水凝胶弱得多[8];而在低温条件下,酶交联的丝蛋白水凝胶会经历自发的无规α-螺旋到β-折叠的转变,导致水凝胶刚度随时间逐渐增加[9],这使得酶交联水凝胶在再生医学应用中具有不可预测的结构。这表明HRP 交联RSF 水凝胶不够稳定,可能是由于部分RSF 链段在凝胶网络内仍保持可移动[10]。此外,还可以通过超声波处理、pH调节、离心、电刺激以及通过添加极性化合物,如多元醇或表面活性剂诱导丝蛋白水凝胶形成[11-14]。所有这些方法都依赖于丝素蛋白链从无规卷曲到β-折叠的结构转换。丝素蛋白链的疏水区域之间形成氢键,导致聚合物链重新排列和蛋白质凝胶化[3]。因此,可引入乙醇来对酶促预交联丝蛋白水凝胶进行后处理。
首先,利用HRP 酶促预交联丝蛋白水凝胶形成双酪氨酸键位点限制,进一步通过乙醇促进丝蛋白水凝胶内部形成β-折叠结构域,起到了第二个均匀分布交联剂的作用,制备形成双交联丝素蛋白(TSF)水凝胶(图1)。我们的方法的一个独特优势是能够在不改变丝素蛋白结构和组成的情况下进行交联,所制备的具有“双网络”的丝蛋白水凝胶具有良好的力学性能,并且在模拟体内环境中表现出优秀的稳定性。为了证明这种新型生物材料的实用性,我们将其在体外对成纤维细胞进行培养,检测其生物相容性。

图1 TSF 双网络水凝胶示意图Fig.1 Schematic diagram of TSF double network hydrogel
1 材料与方法
1.1 主要材料
高糖DMEM(Hyclone,USA),胎牛血清(FBS)、1%的青链霉素和胰蛋白酶-EDTA(Thermo Fisher Scientific,USA),溴化锂、磷酸盐缓冲盐水(PBS)、辣根过氧化物酶Ⅵ型(HRP)、过氧化氢(H2O2)、纤维素透析膜(默克有限公司,中国),活死染色试剂盒(翌圣生物科技股份有限公司,中国),家蚕茧购自中国江苏。共聚焦显微镜(徕卡,德国)。
1.2 方法
1.2.1 制备丝蛋白
丝素蛋白是从家蚕茧中分离出来的[8]。具体步骤为:将蚕茧切成小块,并在0.02 mol/L 碳酸钠溶液中煮沸30 min,采去除丝素纤维中的丝胶;脱胶丝素蛋白纤维在70 ℃下溶解在溴化锂(9.3 mol/L)中4 h;使用纤维素膜(截止值为14 kDa)将丝素蛋白溶液与去离子水透析5 d,每天更换离子水;获得的丝素蛋白水溶液冷冻干燥。
1.2.2 制备双交联丝蛋白水凝胶
为了制备双交联处理的丝蛋白水凝胶(TSF 水凝胶),首先配制4 wt%的丝蛋白水溶液,将20 μL HRP(900 U/mL)和20 μL H2O2(0.5% v/v)添加到1 mL SF 溶液中。将混合物在37 ℃下培养形成酶促水凝胶,将其浸入90% v/v 的乙醇溶液中6 h,转移到去离子水中,以去除乙醇和其他残留物。
1.2.3 物理性能检测
1.2.3.1 水凝胶形貌观察
将TSF 水凝胶制成圆柱形样品(高1 cm,直径1 cm),冷冻干燥后喷金处理,使用扫描电镜(PHENOM)观察样品的表面形貌。
1.2.3.2 力学性能检测
将TSF 水凝胶制成圆柱形样品(高1 cm,直径1 cm),使用Electronic Universal Testing Machine(Zwick T1-FR020.A50)检测样品的压缩性能,压缩速率为1 mm/min,无预应力设置。每个样本测试3次。
1.2.4 细胞培养
人皮肤成纤维细胞(hSFs)来源于中国科学院生物化学与细胞生物学研究所,标准细胞培养环境下(37 ℃、5%CO2以及饱和湿度),使用含10% FBS 和1%青链霉素的DMEM 培养,细胞达到80%的细胞融合度后传代。
1.2.5 生物学性能检测
1.2.5.1 生物相容性检测
用CCK-8 法检测材料的细胞毒性以及水凝胶对细胞的增殖能力的影响。将1×104个hSFs 接种在凝胶表面。根据产品说明书,在培养1、3 和7 d 后,将原有培基换成含有CCK-8 试剂的新鲜培养基,并37 ℃下培养1.5 h。吸出检测溶液使用酶标仪测量450 nm 处的光密度。细胞未接种在凝胶表面,直接接种于6 孔板的作为对照组(Control)。
为了分析细胞在凝胶培养条件下的存活能力,利用活死染色试剂盒,在培养7 d 后对细胞进行检测,结果用共聚焦显微镜观察并拍照。
1.2.5.2 细胞形态检测
用荧光染色观察材料表面的细胞黏附形态。将1×104个hSFs 接种在凝胶表面,培养6 h 后,4%多聚甲醛固定。FITC-Actin 染色细胞骨架,DAPI 染色细胞核,用共聚焦显微镜(徕卡,德国)观察结果。
1.2.6 统计分析
采用分析软件GraphPad Prism 8(GraphPad software,USA)进行统计分析,组间比较采用单因素方差分析和Tukey 后分析法。P<0.05 表示具有显著性差异。
2 结果
2.1 TSF 水凝胶物理性能研究
TSF 凝胶中可见由纤维结构构成的有序三维网络,这与酶促交联形成的双酪氨酸网络相关,还可观察到一些由于冰晶压缩产生的一些带状结构,这与β-折叠结构域的大规模聚集有关(图2)。我们认为,这种具有三维网络的纤维-带状结构可以是TSF 水凝胶特有的结构,与其力学性能相关。

图2 TSF 水凝胶断面SEM 观察Fig.2 SEM observation of TSF hydrogel section
如图3 所示,TSF 水凝胶在重复压缩试验中能够承受较大的应变,TSF 水凝胶在10%应变下的抗压强度为(0.907±0.024)MPa,其相关压缩模量为(0.589±0.032)MPa。由于酶交联程度受到丝蛋白中酪氨酸含量以及丝蛋白水溶液中酚羟基暴露水平的限制,而在乙醇中处理凝胶后,通过形成广泛的β-折叠结构,可以进一步固定这个“不完整网络”中的丝蛋白分子链,进而可以推测双交联网络能够极大地提高TSF 水凝胶的强度。

图3 TSF 水凝胶的压缩强度检测Fig.3 TSF hydrogel compressive strength test
2.2 TSF 水凝胶的生物相容性
细胞接种6 h 后可很好地黏附在TSF 凝胶表面,并在凝胶表面铺展,具有良好的方向性(图4)。
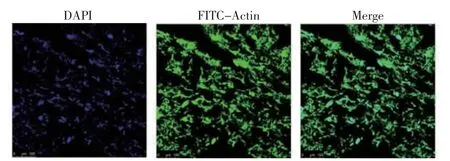
图4 TSF 水凝胶表面HSFs 细胞(6 h)的荧光染色结果Fig.4 Fluorescence staining results of HSFs cells on TSF hydrogel surface (6 h)
CCK-8 检测结果显示,随着时间的推移,细胞逐渐增多,与对照组相比未见明显的细胞毒性(图5),显示材料具有良好的生物相容性。
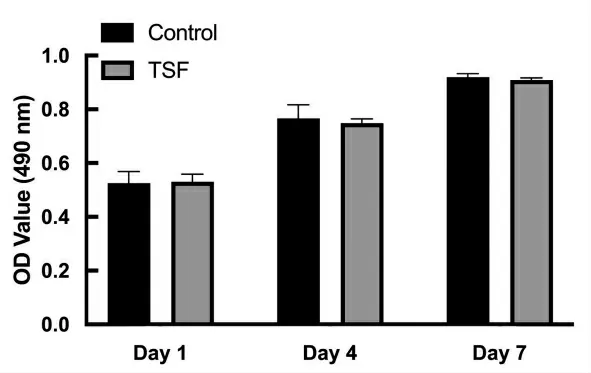
图5 TSF 水凝胶接种hSFs 细胞的增殖情况(CCK-8 检测结果)Fig.5 Proliferation of hSFs cells inoculated with TSF hydrogel(CCK-8 test results)
在凝胶表面接种1 周后进行活/死细胞染色,以评估在水凝胶中的细胞的活力。结果显示,细胞逐渐长入凝胶内部,且显示出良好的细胞活力,未见明显死细胞(图6)。

图6 TSF 水凝胶接种HSFs 细胞的活死细胞染色结果(7 d)Fig.6 Live/dead cell staining of HSFs cells inoculated with TSF hydrogel (7 d)
3 讨论
TSF 水凝胶显示出较高的强度,是因为在乙醇溶液中进一步处理酶处理后的丝蛋白水凝胶。同样,将酶促凝胶浸入乙醇溶液后,可以制备具有双交联网络结构的酶-乙醇TSF 水凝胶。SEM 结果显示,由于利用乙醇作为额外的物理交联剂,在水凝胶内部形成了广泛的β-折叠结构,同时在水凝胶内保留完全的酶致化学交联的网络。
近几十年来,各种结构设计被用于提高基于合成聚合物和天然聚合物的水凝胶的机械性能,包括基于聚合物的纳米复合凝胶、双网络(DN)凝胶和半互穿网络[15-17]。酶预处理的双-Tyr 交联位点不仅部分实现水凝胶的3D 网络,还促进丝素蛋白中相邻GAGAGS 序列的空间呈现,从而在乙醇的帮助下促进其从无规卷曲到β-折叠的构象转变[18]。更重要的是,HRP 预连接网络显著限制了RSF 链的组织,从而限制了不断增长的β-折叠结构域的大小。因此,在水凝胶网络中形成并均匀分布小范围的β-折叠,这被认为是对TSF 水凝胶强度的主要贡献。
因此,用乙醇对交联不足的酶促丝蛋白水凝胶进行后处理,对于提高水凝胶的强度非常关键,因为这提供了一种有效且简单的方法来产生小且均匀分布的β-折叠结构域,形成双交联TSF 凝胶中的第二交联网络。
4 结论
本研究通过在乙醇溶液中对酶交联弹性丝蛋白水凝胶进行后处理,开发了一种双网络TSF 水凝胶,这种水凝胶显示出良好的机械性能。由于TSF水凝胶具有优异的力学性能和良好的生物相容性,可作为一种植入生物材料,在组织工程领域具有巨大的应用潜力。

