自体造血干细胞移植治疗老年非霍奇金淋巴瘤48例临床研究
连嘉颖,叶佩佩,裴仁治,刘旭辉,陈冬,张丕胜,杜小红,曹俊杰,陈列光,陆滢
非霍奇金淋巴瘤(NHL)是一组异质性很强的淋巴组织恶性疾病,发病率约占所有淋巴瘤的90%[1]。2018年造血干细胞移植治疗淋巴瘤中国专家共识将自体造血干细胞移植(auto-HSCT)推荐作为年轻初治高危或复发难治淋巴瘤患者的一线巩固治疗或挽救治疗方案[2]。auto-HSCT也可以改善老年NHL患者的预后及生活质量[3-4],但老年患者常常存在各种合并症、干细胞动员效果不理想及安全性等问题,限制了其常规开展。本研究回顾性分析48例接受auto-HSCT治疗的老年NHL患者的临床资料,报道如下。
1 资料与方法
1.1 一般资料 收集2014年1月至2019年12月于宁波大学附属人民医院接受auto-HSCT治疗的48例NHL患者,均参照2008年WHO造血与淋巴组织肿瘤分类标准,经病理组织学确诊。其中男22例,女26例;年龄60~75岁,中位年龄65岁。初治39例,复发9例[均为弥漫大B细胞淋巴瘤(DLBCL)]。B细胞淋巴瘤26例,其中DLBCL 24例,套细胞淋巴瘤(MCL)1例,转化型淋巴瘤(滤泡细胞淋巴瘤转化为DLBCL)1例;T细胞淋巴瘤22例,其中外周T细胞淋巴瘤(PTCL)非特指型12例,血管免疫母T细胞淋巴瘤(AITL)4例,NK/T细胞淋巴瘤6例。Ann Arbor分期:Ⅰ/Ⅱ期4例,Ⅲ/Ⅳ期44例。有B症状者(无其他原因体温大于38℃持续3 d以上,6个月内体质量减轻10%以上,盗汗)16例,无B症状者32例。33例(68.8%)合并至少1种基础疾病,其中高血压病12例,糖尿病9例,慢性乙型病毒性肝炎6例,冠状动脉粥样硬化性心脏病4例,抑郁症或焦虑症4例,甲状腺癌3例,脑动脉供血不足1例,肝硬化1例。
1.2 诱导方案 初治MCL采用Hyper-CVAD方案(环磷酰胺+长春新碱+多柔比星+地塞米松)+美罗华诱导,NK/T细胞淋巴瘤采用P-Gemox方案(吉西他滨+奥沙利铂+培门冬酶)诱导;其他初治患者(包括DLBCL、PTCL、AITL、转化型淋巴瘤)均采用CHOP/CHOPE(CHOP:环磷酰胺+表阿霉素或脂质体阿霉素+长春地辛+泼尼松;CHOPE:CHOP+足叶乙甙)±利妥昔单抗诱导。复发DLBCL患者选择与CHOP无交叉耐药的二线方案如R-ICE(利妥昔单抗+异环磷酰胺+卡铂+依托泊苷)、R-GDP(利妥昔单抗+吉西他滨+顺铂+地塞米松)等。
1.3 自体造血干细胞动员和预处理方案 动员前根据患者病情行利妥昔单抗+CHOP、CHOP、CHOPE、大剂量环磷酰胺为基础的方案+重组人粒细胞集落刺激因子(G-CSF)动员。48例患者均采用SEAM方案(司莫司汀250 mg/m2,7 d+足叶乙甙100 mg/m2,1次/12 h,-6 d~-3 d+阿糖胞苷200 mg/m2,1次/12 h,-6~-3 d+马法兰140 mg/m2,-2 d)作为预处理。在使用预处理方案过程中再依据年龄>65岁、CD34+细胞采集总量<2.0×106/kg、造血干细胞移植合并症指数(HCT-CI)评分>2分、美国东部肿瘤协作组(ECOG)评分≥2分等因素调整SEAM方案中药物剂量,根据不同病情调整为标准剂量的2/3~3/4。
1.4 植入标准 中性粒细胞植入的定义为中性粒细胞绝对计数>0.5×109/L持续3 d;血小板植入定义为血小板>20×109/L连续7 d且脱离血小板输注。
1.5 疗效评价 采用门诊及电话随访,截止2020年4月。采用国际淋巴瘤疗效标准[5]评价近期疗效。总生存(OS)时间:造血干细胞回输至各种原因死亡或末次随访的时间;无进展生存(PFS)时间:造血干细胞回输至疾病进展、死亡或末次随访时间。
1.6 统计方法 应用SPSS 16.0统计软件进行分析。采用Kaplan-Meier生存曲线、多变量COX比例风险模型进行生存分析。<0.05为差异有统计学意义。
2 结果
2.1 外周血干细胞采集情况 48例患者动员后均采集到足够的干细胞,回输的单个核细胞(MNC)、CD34+细胞量中位数分别为9.2(5.0~20.9)×108/kg、3.5(0.8~8.6)×106/kg。
2.2 造血重建 所有患者均获得中性粒细胞与血小板成功植入。中位粒细胞植入中位时间为10(9~12)d,血小板植入中位时间为12(7~44)d。
2.3 造血干细胞移植的并发症 预处理方案中发生口腔和食管炎10例;败血症8例,其中2例因败血症出现感染性休克,1例在回输后8 d死亡;肺部感染9例,其中1例为重症肺炎;间质性肺炎1例;心房颤动2例;室上性心动过速1例;植入综合征2例,经对症抗炎等治疗后均治愈。100 d内移植相关死亡(TRM)率2.1%。
2.4 疗效及生存状况分析 截止随访终点,存活37例。中位随访时间22.3(4.1~77.1)个月,2年预计OS为(77.6±6.9)%,2年预计PFS为(67.0±7.4)%(封四彩图4),中位OS、PFS时间均未达到。单因素分析提示乳酸脱氢酶(LDH)、ECOG评分、移植前完全缓解(CR)状态对移植后OS影响显著,ECOG评分、移植前CR状态对移植后PFS影响显著(表1)。多因素分析提示移植前CR状态是影响老年淋巴瘤患者OS及PFS的独立因素(表2)。
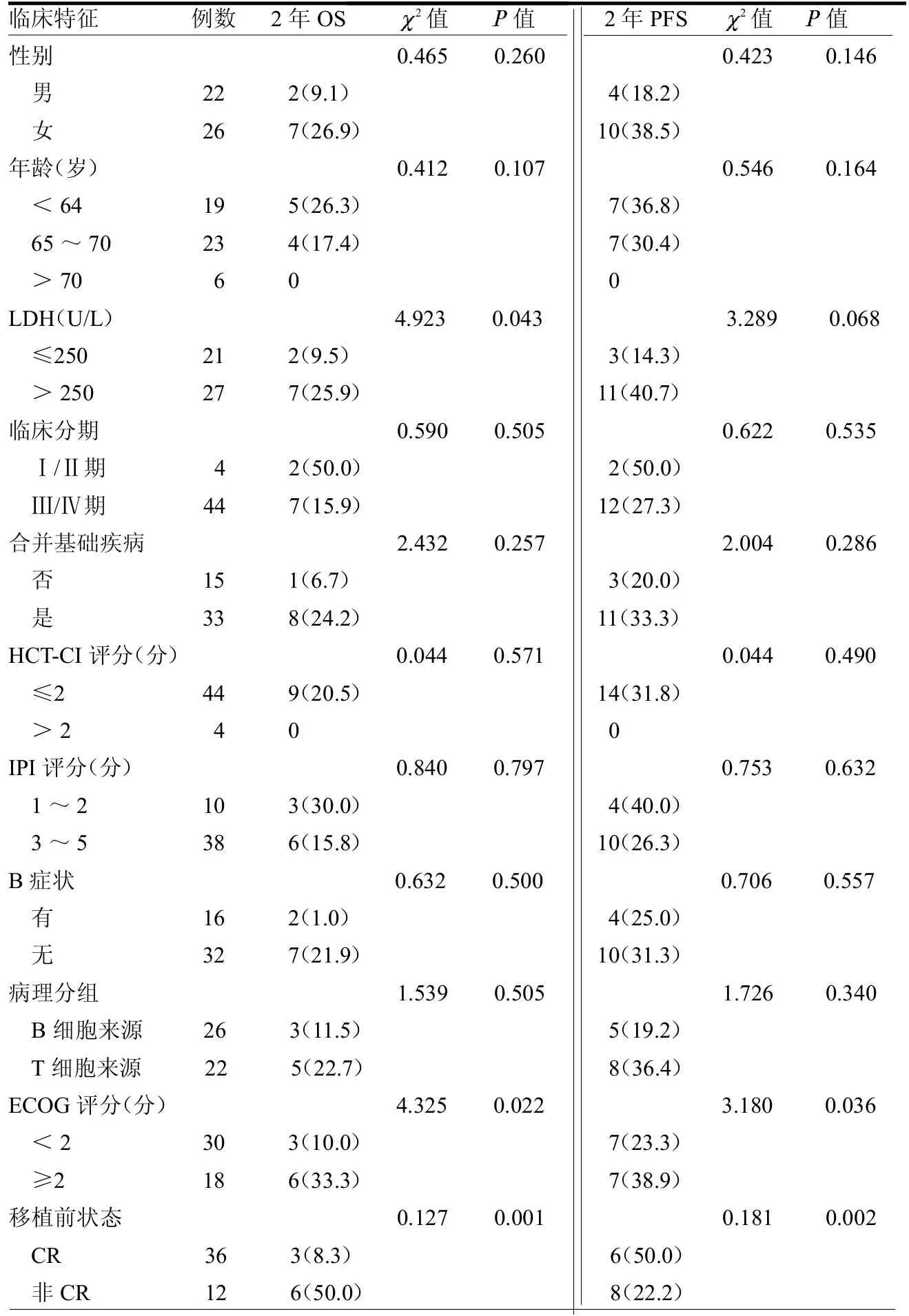
表1 老年NHL患者不同临床特征对OS、PFS影响的单因素分析
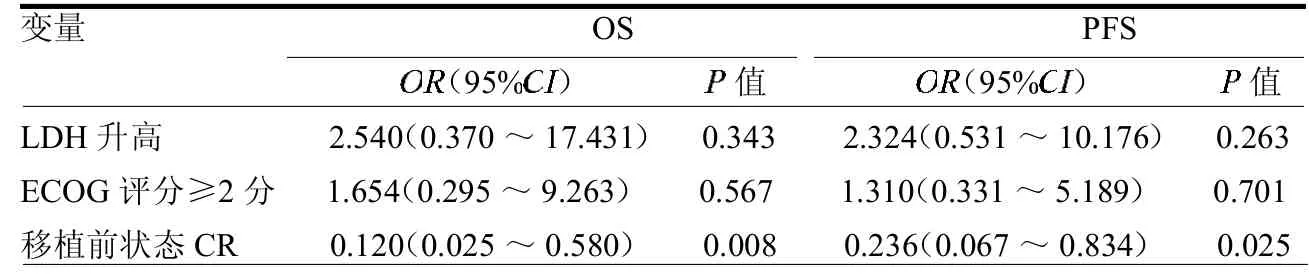
表2 老年NHL患者自体造血干细胞移植预后影响因素的多因素分析结果

3 讨论
随着老龄化的增加,老年淋巴瘤患者的数量也呈上升趋势。国内auto-HSCT并不常用于老年患者,可能与可行性偏低和有效性数据少有关。刘卫平等[6]报告了19例NHL(初治11例,复发难治8例)接受auto-HSCT患者情况,中位年龄61(60~68)岁,100 d内TRM 10.5%,预计2年PFS、OS分别为64%、82%。尽管样本量较小,且中位年龄仅61岁,但仍提示老年淋巴瘤患者进行auto-HSCT能临床获益。国外多项临床研究证实,年龄不是影响auto-HSCT的决定因素,老年患者的比例随着年代的推移将逐渐增多[3,7]。法国一项研究结果显示,81例年龄>70岁的NHL患者接受auto-HSCT,中位随访20.5个月,中位PFS时间为21个月,中位OS时间为43个月,100 d内TRM为5.4%,这提示auto-HSCT在年龄>70岁的NHL中是可行的[4]。本研究纳入48例年龄>60岁接受auto-HSCT的NHL患者,移植后100 d内TRM为2.1%,低于文献报道,这可能与本研究在采用SEAM方案时根据患者不同情况对用药量进行了调整有关,同时也与精心挑选患者及加强支持治疗有关。本研究随访22.3个月,2年预计PFS、OS分别为67.0%、77.6%,这提示在临床上auto-HSCT作为巩固治疗应用于一般情况良好的老年患者是有效的,有可能改善老年患者总体生存状况。
此外,笔者观察了年龄、LDH、肿瘤分期等对老年NHL患者移植后的生存影响。传统意义上这些都是高危因素[8-9],但在移植患者中有无这些因素对预后无明显影响,提示auto-HSCT可以克服这些高危因素[10-11]。目前,HCT-CI评分在auto-HSCT中的预测作用尚存争议。有研究分析了1 730例接受auto-HSCT的患者,高危HCT-CI组相比于中低危组100d内TRM明显升高(P=0.002)[12]。但有研究提示在年龄>70岁接受auto-HSCT的患者中,HCT-CI评分不能预测TRM(P=0.065)[13]。本研究发现HCT-CI评分高危并不能预测auto-HSCT预后,这可能与高危患者的例数(4例)较少有关,需进一步扩大样本量证实这一结论。
auto-HSCT的成功率与移植前的肿瘤状态相关。研究证实,化疗获得CR后行auto-HSCT可提高老年NHL患者的OS[11]。本研究中36例患者在获得CR后接受auto-HSCT,2年OS为90.5%,2年PFS为79.4%;而未CR的患者2年OS为41.7%,2年PFS为33.3%。多因素分析显示,移植前未获得CR为影响老年NHL患者OS、PFS的独立影响预后因素。这提示auto-HSCT前化疗敏感是影响预后的重要指标。故对于原发难治,化疗不敏感的患者可以考虑其他临床试验或异基因造血干细胞移植。
综上所述,老年NHL患者行auto-HSCT的可行性和有效性。年龄不能预测老年NHL患者接受auto-HSCT的预后,移植前是否获得CR是影响auto-HSCT疗效的重要因素。但是,这种方法的应用仍需慎重选择合适群体。

