菌核病不同发病率的菜田土壤中真菌多样性分析
陶 禹,李东波,李兴杰,陈士亮,严振宁,奥岩松*
(1上海交通大学农业与生物学院,上海200240;2宜春学院生命科学与资源环境学院,宜春336600;3上海春昌蔬果专业合作社,上海201706)
菌核病是一种分布广、寄主多的常见土传真菌病害,易对多种作物如油菜、向日葵等造成危害,导致其严重减产、品质下降等[1-2],其病原菌由核盘菌属(Sclerotinia)的多种真菌构成[3]。菌核病传播途径多、速度快,菌核形态下的核盘菌对多种逆境有较强的抵抗能力,生产上防治该病难度极大[4]。目前,菌核病的防治主要依赖于化学农药,而长期用药会使病原菌产生抗药性,且对环境造成污染[5]。农艺防治等措施作用时间长,防治效率低,不适用于现代农业生产。“以菌治菌”的生物防治方法因其绿色、环保且不会造成有害残留等优点,受到广泛提倡[6]。
应用拮抗微生物防治菌核病已有大量研究,其中芽胞杆菌[7]、木霉[8]和盾壳菌[9]等对核盘菌具有显著抑制作用。发病土壤是拮抗微生物的重要来源之一[10-11]。农田生态系统复杂,生产上利用拮抗微生物防治菌核病效果不稳定、效率低[12-14]。李晓辉等[15]研究发现,核盘菌菌核围与非菌核围土壤的微生物多样性具有显著差异,表明土壤微生物群落的结构组成和多样性变化可能对菌核病的发生、发展具有重要的作用。
二代高通量测序技术(Illumina MiSeq测序)具有准确性高、灵敏度强等优势,已广泛用于土壤微生物多样性的研究。本研究以菌核病不同发病率的菜田土壤为试验材料,利用高通量测序技术分析土壤真菌群落结构及多样性变化,旨在阐明核盘菌与土壤真菌多样性之间的关系,以期提高菌核病生物防治效果。
1 材料与方法
1.1 样品采集与处理
于2019年11月自上海市青浦区春昌蔬果专业合作社发病菜田取土样。参照刘彬等[16]的方法鉴定土壤中的病原菌,确定其为小菌核菌(Sclerotinia minor)。根据病害程度与病原菌序列丰度将发病菜田土壤划分为无病害组(CK)、轻度病害组(LIT)和重度病害组(SEV)(表1)。

表1 土壤样本病害程度划分Table 1 Classification standard of disease degree of soil samples
用“S”形采样法,在病害程度不同的土壤样地选定6个采样点,用五分法取样。以采样点为中心,取半径为10 cm,深度为5—15 cm的土壤,除去植株残体,过2 mm筛后装入无菌PE密封袋。共采集18份土壤样品,将每份土壤样品分为两部分,一部分保存于-80℃冰箱中用于高通量测序分析,另一部分室温风干后用于土壤理化性质测定。
1.2 土壤理化性质测定
土壤pH用pH计(型号为FE28,METTLER TOLEDO上海有限公司)测定;有机质含量采用重铬酸钾-容量法测定;土壤全氮和全磷含量用AA3连续流动分析仪测定;土壤全钾含量采用氢氧化钠熔融法测定;速效磷含量采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾含量用乙酸铵浸提-火焰原子吸收法测定;速效氮含量用碱解扩散法测定。
1.3 土壤真菌的高通量测序
1.3.1 土壤总DNA的提取
准确称量200 mg土样,放入2 mL无菌离心管中,加入1 mL 75%乙醇,振荡混匀,10 000×g,4℃离心3 min,弃上清液。加入1×PBS溶液,振荡混匀,10 000×g,4℃离心3 min,弃上清液,参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit(Omega Bio-Tek,Norcross,GA,USA)使用说明书提取土壤样品基因组DNA。
1.3.2 样品土壤Illumina MiSeq测序
真菌基因组扩增的特异引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR反应程序:94℃5 min;94℃40 s,54℃30 s,72℃40 s,37个循环;72℃10 min。2%琼脂糖凝胶电泳检测PCR产物。利用AxyoreoDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱,然后利用QuantiFlourTm-ST蓝色荧光定量系统(Promega公司)获得纯化PCR产物,由上海美吉生物医药科技有限公司完成测序。
1.4 数据处理
利用Excel 2010软件统计数据。利用R语言进行单因素方差分析(ANOVA),用最小显著性差异法进行分析。利用Mothur(version v.1.30.1)计算Alpha多样性指数。利用Qiime软件计算Beta多样性指数,利用R语言Vegan包进行NMDS分析(Bray curtis距离)并用R语言进行作图。
2 结果与分析
2.1 菌核病不同发病率的菜田土壤的理化性质
由表2可知,土壤样品均为弱酸性,SEV组pH显著低于LIT组与CK组(P<0.05)。LIT组与SEV组的土壤有机质、全磷、全钾、速效氮含量等均显著高于CK组(P<0.05),SEV组的速效磷含量显著高于CK组,而各组间速效钾含量无显著差异。土壤有机质、全磷、全钾含量的显著增多说明发生菌核病的菜田中施肥较多,而速效氮、速效磷含量的增多则可能与土壤中的腐生真菌相对丰度增多有关[17]。
2.2 菌核病不同发病率的菜田土壤中真菌多样性测序数据统计
测序数据优化后,CK组有64 699条高质量序列片段,15 539 138个碱基,序列平均长度为240 bp。LIT组有64 340条片段,15 340 609个碱基,序列长度为238 bp。SEV组有57 738条片段,13 899 158个碱基,序列长度为240 bp。由图1可知,随着序列增多,Shannon指数趋于稳定,表明测序数据量足够大,可以反映样本中绝大多数的真菌多样性信息。
图1 稀释曲线Fig.1 Rarefaction curve
2.3 菌核病不同发病率的菜田土壤中真菌Alpha多样性分析
由表3可知,各样品的覆盖度指数(Coverage)均达到0.999以上。随着菌核病发病率的升高,相较于LIT组,SEV组物种丰富度Sobs指数显著降低(P<0.05)。物种多样性Simpson和Shannon指数无显著差异(P>0.05)。
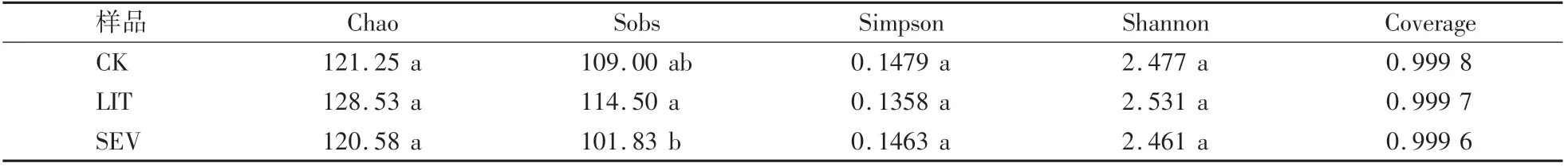
表3 不同土壤样品中真菌群落的Alpha多样性指数Table 3 Alpha diversity index of fungal community in different soil samples(Genus level)
2.4 菌核病不同发病率的菜田土壤中真菌Beta多样性分析
在属水平上进行NMDS(Non-metric multidimensional scaling analysis)分析,其胁强指数(stress)为0.111。由图2可知,土壤样品划分为3个类群,其中CK组为类群I,LIT组为类群II,SEV组为类群III,三个类群间具有极显著差异(P<0.01),表明不同发病率的病害土壤中的真菌多样性具有显著差异。
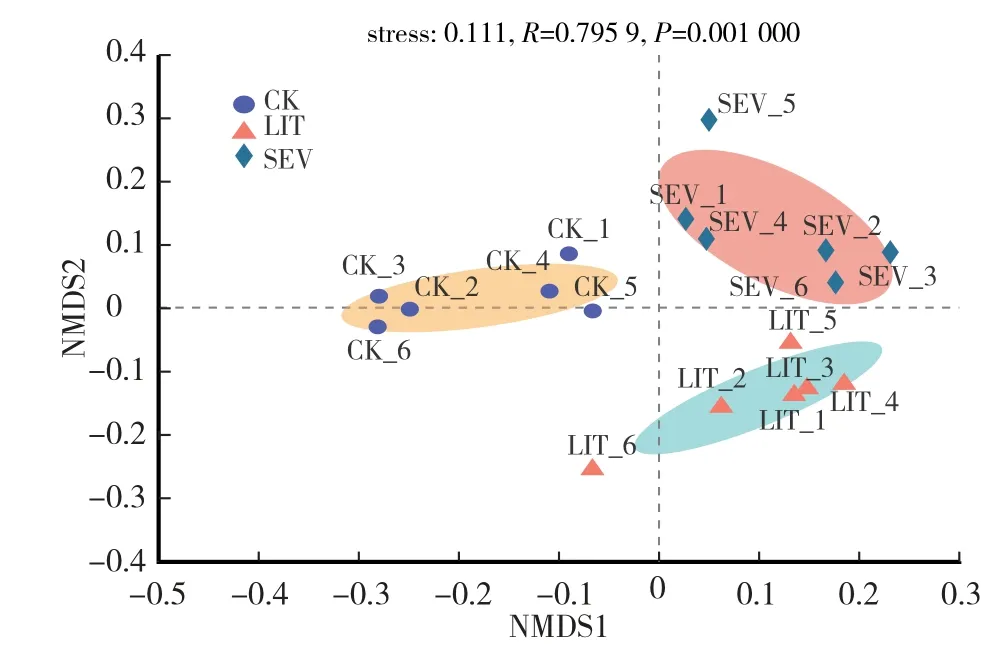
图2 不同土壤样品中真菌群落的NMDS分析Fig.2 NMDSanalysis of fungal communities in different soil samples
2.5 菌核病不同发病率的菜田土壤中真菌的群落结构组成
土壤样品中真菌共聚类于10个门,30个纲,63个目,122个科,208个属,324个种,825个分类操作单元(OTU)。
在门水平上(图3、图4),3组(CK、LIT和SEV)均含有子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、unclassified-k-Fungi、壶菌门(Chytridiomycota)、隐真菌门(Rozellomycota)和捕虫霉门(Zoopagomycota),其中子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)和担子菌门(Basidiomycota)相对丰度之和均在88%以上;只在LIT组与SEV组中具有的真菌门为蛙粪霉门(Basidiobolomycota)和芽枝霉门(Blastocladiomycota);只在 SEV组中具有的真菌门为Calcarisporiellomycota。
在属水平上(图3、图4),3组(CK、LIT和SEV)中有120属为共有真菌,特有真菌属数目分别为19、23、21。3组中共检出高丰度真菌(平均相对丰度1%—5%)11个属,其中优势真菌(平均相对丰度≥5%)有7个属。相对丰度从高到低依次为小被孢霉属(Mortierella)、丝葚霉属(Papulaspora)、unclassified-f-Pyronemataceae、unclassified-f-Cheatomiaceae、毛壳属(Cheatomium)、瓶毛壳属(Lophotrichus)、unclassified-f-Agaricomycetes。各组样品中,这7个属真菌的相对丰度之和均大于75%。
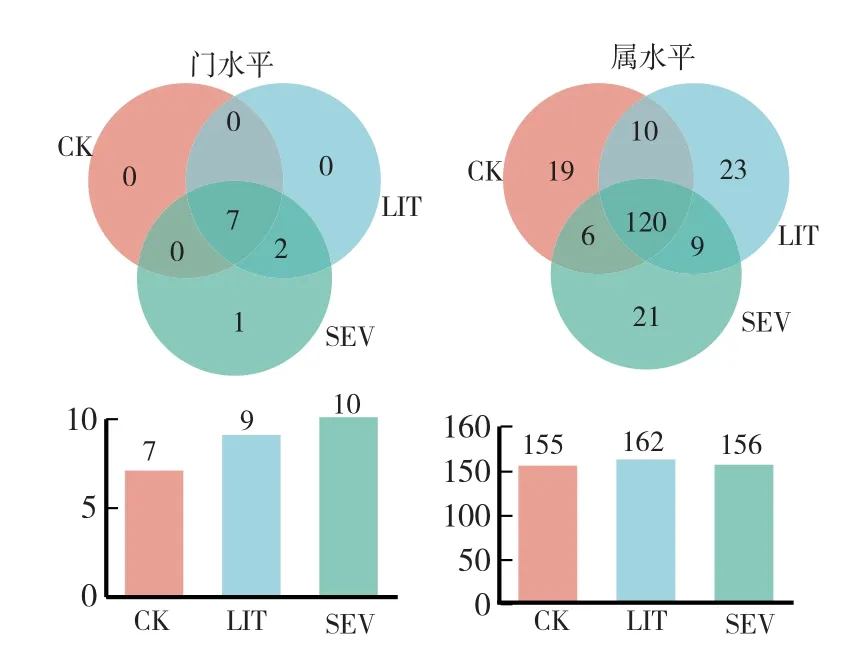
图3 不同土壤样品中真菌的Venn图分析Fig.3 Venn analysis of fungi in different soil samples
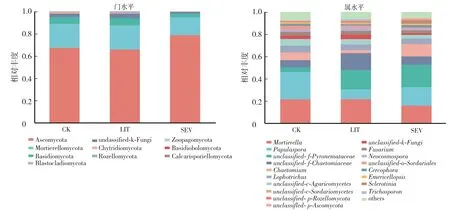
图4 不同土壤样品中真菌的物种群落组成Fig.4 Species composition of fungi in different soil samples
2.6 菌核病不同发病率的菜田土壤中高丰度真菌的变化
由图5可知,3组的优势真菌中(平均相对丰度≥5%),CK组小被孢霉属(Mortierella)相对丰度为21.49%,LIT组为21.70%,SEV组为15.87%,其中LIT组与SEV组间差异达到显著水平(P<0.05);CK组丝葚霉属(Papulaspora)相对丰度为24.56%,LIT组为8.66%,SEV组为16.52%,三组间的差异均达到显著水平(P<0.05);CK组unclassified-f-Pyronemataceae相对丰度为4.10%,LIT组为17.63%,SEV组为20.34%,LIT组和CK组间、SEV组和CK组间的差异均达到显著水平(P<0.05);CK组unclassified-f-Cheatomiaceae相对丰度为6.50%,LIT组为15.00%,SEV组为7.65%,LIT组和CK组间、LIT组和SEV组间的差异均达到显著水平(P<0.05)。CK组毛壳属(Cheatomium)相对丰度为6.90%,LIT组为2.69%,SEV组为11.15%,LIT组与SEV组间的差异达到极显著水平(P<0.01)。
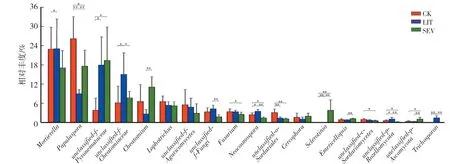
图5 不同土壤样品中高丰度真菌的相对丰度Fig.5 Relative abundance of high abundance fungi in different soil samples
3组的高丰度真菌中(平均相对丰度1%—5%),CK组、LIT组、SEV组镰刀菌属(Fusarium)的相对丰度分别为3.30%,3.28%和2.47%。新赤壳属(Neocosmospora)的相对丰度分别为2.38%、3.40%和1.45%,3组之间的相对丰度差异均达到显著水平(P<0.05)。unclassified-o-Sordariales的相对丰度分别为2.98%、1.42%和1.16%,CK组与LIT组,CK组与SEV组间差异均达到极显著水平(P<0.01)。unclassified-c-Sordariomycetes的相对丰度分别为1.01%、0.78%和0.63%。CK组核盘菌属(Sclerotinia)的相对丰度相对低于1%,3组之间的相对丰度差异均达到极显著水平(P<0.01)。LIT组丝孢酵母属(Trichosporon)相对丰度为1.47%,在其他两组中的相对丰度均低于1%,相对丰度差异达极显著水平(P<0.01)。
在属水平下,随着核盘菌的相对丰度增加,各属真菌相对丰度变化趋势可分为四种类型,分别为(1)相对丰度下降:瓶毛壳属(Lophotrichus)、unclassified-f-Agaricomycetes、unclassified-o-Sordariales、unclassified-c-Sordariomycetes和镰刀菌属(Fusarium)。(2)相对丰度先降低后增加:丝葚霉属(Papulaspora)、毛壳属(Cheatomium)、尾柄孢壳属(Cercophora)、翅孢壳属(Emericellopsis)、unclassified-p-Ascomycota和丝孢酵母属(Trichosporon)。(3)相对丰度先增加后降低:被孢霉属(Mortierella)、unclassified-f-Cheatomiaceae、新赤壳属(Neocosmospora)、unclassified-p-Rozellomycota和丝孢酵母属(Trichosporon);(4)相对丰度上升:unclassified-f-Pyronemataceae。
2.7 菌核病不同发病率的菜田土壤中真菌的功能分析
由图6可知,根据FUNGuild功能预测可将土壤中的真菌划分为10个功能菌群,其中与植物病理有关的功能类群有植物病理寄生类菌群(Plant Pathogen)和植物病理-腐生-共生类菌群(Animal Pathogen-Endophyte-Lichen Parastie-Plant Pathogen-Soil Saprotroph-Wood Saprotroph)。CK组植物病理寄生类菌群相对丰度为1.43%,LIT组为0.79%,SEV组为3.54%;CK组植物病理-腐生-共生菌群种相对丰度为3.28%,LIT组为3.30%,SEV组为2.47%。LIT组中植物病理寄生类菌群的相对丰度为4.09%,SEV组中植物病理寄生类菌群为6.01%。
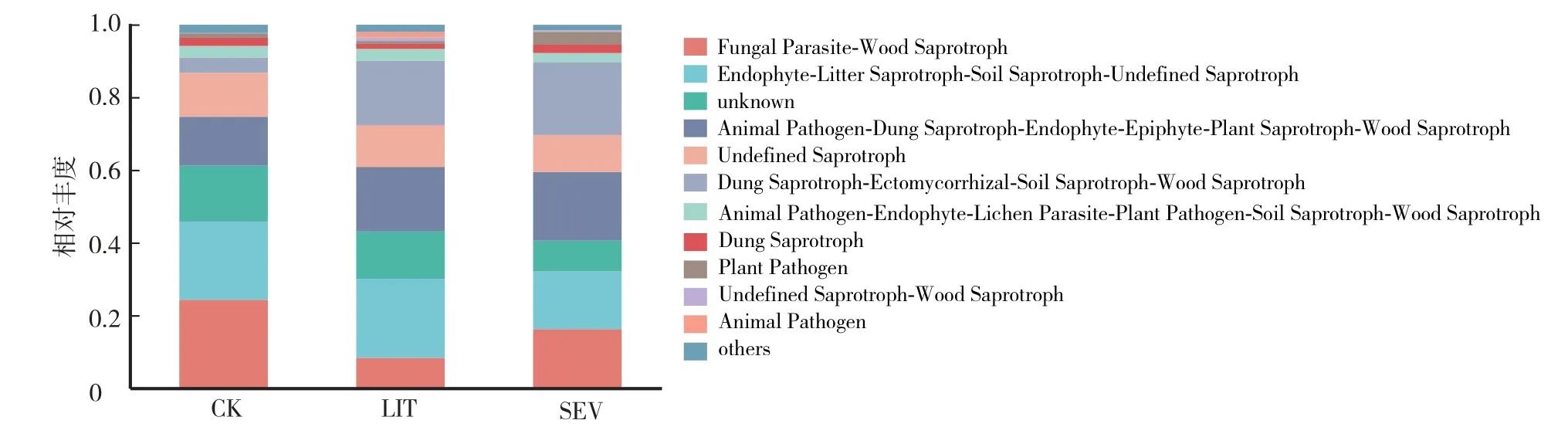
图6 不同土壤样品中高丰度真菌的功能分析Fig.6 Fungal functional of high abundance fungi in different soil samples
3 讨论与结论
本研究中,与对照组相比,SEV组土壤真菌群落丰富度Sobs指数显著下降(P<0.05),多样性Simpson、Shannon指数无显著差异,与前人的研究结果不同[15],可能与栽培植物种类不同有关;NMDS分析表明各土壤样本中真菌群落Beta多样性之间有极显著差异(P<0.01)。门水平上,相对于CK组,LIT组特有的2个门为蛙粪霉门和芽枝霉门,SEV组特有的门为Calcarisporiellomycota。属水平上,CK组155属真菌中有19属特有真菌,LIT组162属真菌中有23属特有真菌,SEV组156属真菌中有21属特有真菌,这表明菌核病不同发病率的土壤中真菌种类差异较大。综上,小核盘菌会对土壤中真菌群落组成和多样性变化产生显著影响。
由物种群落组成与功能分析可知,土壤中的高丰度真菌(11属)与优势真菌(7属)可分为三类:对核盘菌具有拮抗作用的腐生型真菌、有益腐生型真菌和病理营养型真菌。对核盘菌具有拮抗作用的腐生型真菌(4属):unclassified-f-Cheatomiaceae、毛壳属、小被孢霉属和丝孢酵母属。其中unclassified-f-Cheatomiaceae与毛壳属同属于毛壳菌科,但这两属相对丰度变化趋势相反。研究表明,毛壳菌对部分小麦赤霉病菌有高抑制作用,而对棉花枯萎病病原菌与南瓜枯萎病病原菌则没有明显的抑制作用[19]。贾艳梅等[20]认为,部分毛壳菌科对植物具有致病作用。球毛壳菌对小麦叶枯病病原菌、稻瘟病病原菌有抑制作用[21-22]。李治莹等[23]发现,毛壳菌科对于多种真菌都具拮抗作用。小被孢霉属相对丰度较低,与苗翠平等[24]研究结果相同。黄芳芳[25]认为,被孢霉菌可以控制三七根腐病病原菌,核盘菌与小被孢霉属之间可能存在相互拮抗关系。范青等[26]发现,丝孢酵母属真菌对病原菌具有营养竞争作用。本试验中,丝孢酵母属在LIT组中相对丰度较高,同时丝孢酵母属也可作为核盘菌侵染时的指示真菌。
有益腐生型真菌(6属):unclassified-f-Pyronemataceae、unclassified-f-Agaricomycetes、unclassified-o-Sordariales、unclassified-c-Sordariomycetes、尾柄孢壳属和翅孢壳属。尾柄孢壳属常见于草食性动物粪便上,翅孢壳属从功能分析与科级分类中为腐生菌[27]。unclassified-f-Pyronemataceae、unclassified-f-Agaricomycetes、unclassified-o-Sordariales、unclassified-c-Sordariomycetes是常见的有益土壤腐生营养菌。
病理营养型真菌(3属):瓶毛壳属、新赤壳属和镰刀菌属。瓶毛壳属的多数真菌为土壤病原菌[28];新赤壳属真菌是造成松树溃疡病的病原菌[29];镰刀菌属是引起多种植物病害的致病性真菌[30]。与CK相比,上述三种真菌相对丰度均下降,说明不同致病菌种之间存在竞争关系。
综上,小核盘菌会对土壤中门水平下与属水平下的真菌群落组成以及Beta多样性产生显著影响,其中SEV组中特有蛙粪霉门、芽枝霉门和Calcarisporiellomycota,LIT组中特有蛙粪霉门和芽枝霉门。土壤中的小被孢霉属和丝孢酵母属可能对病原菌有拮抗作用,具备分离出高抑制性的菌株的潜力,同时丝孢酵母属也可作为核盘菌侵染时的指示真菌。

