对称归一化配准的多图谱大脑扩散张量图像分割
蔡文琴, 王远军
(上海理工大学 健康科学与工程学院, 上海 200093)
随着我国人口老龄化程度加深,大脑精神类疾病的发病率呈现快速增长趋势,例如,原发性老年痴呆症[1]、脑缺血[2]、中风[3]及精神分裂[4]等。扩散张量成像(diffusion tensor imaging, DTI)[5]是唯一能够非侵入性地对生物组织中水分子的各向异性扩散特征进行成像的成像模态,它能够提供组织微细结构信息,特别是对于大脑白质组织在分子水平上的检测更为灵敏。基于DTI 的全脑解剖学分割能够获取脑组织中细微的结构信息,并对DTI 数据中脑白质或病变区域进行提取与处理,能够为临床疾病的辅助诊断提供更好的分析手段。一般来说,由临床医生手动进行勾画的脑解剖学图像被认为是最准确的分割方法,俗称“金标准”;然而,由于DTI 图像的图像分辨率低,且为四维图像,因而不易于被医生进行手动分割。因此,开发一种具有较高准确率和鲁棒性的DTI图像自动分割算法已经成为国内外医学图像处理与分析领域的研究热点。
传统的医学图像分割方法有很多,例如,阈值分割法[6]、区域生长法[7]及水平集分割法[8]等,这些方法是利用图像的灰度、梯度或者其他区域的特征进行分割,而DTI 图像每个体素是 3×3的张量,因其图像特点,它不适用于这些方法进行分割。为此,近年来国内外学者纷纷提出了各种不同的方法对张量图像进行分割。Rittner 等[9]通过梯度的计算,使用分水岭分割算法对DTI 数据中的胼胝体进行了分割。在此基础上,王毅等[10]提出了一种基于矢量活动轮廓模型的DTI 脑胼胝体分割方法,该类算法对于局部某个脑区的分割效果尚可,但是,对分割大脑多个脑区的效果欠佳,而且由于分水岭算法对于边缘信息的敏感度,容易导致其产生过分割的现象;Lenglet 等[11]提出了张量空间的高斯概率活动轮廓模型分割算法对DTI 大脑数据进行分割,并推导出了用于衡量张量间不相似性的测地距离,但该算法的分割精准度和鲁棒性会随着DTI数据中高斯模型的变化而产生影响;Dai 等[12]提出了DTI 大脑纵向分割方法,但是,由于该算法对数据集的要求高,需要多次重复采集大脑数据来改善分割效果,且它的方法以结构图像为主,仅利用DTI 成像的各向异性分数图像,因此,并不适用于对普通DTI 大脑图像的分割研究。综上所述,由于脑部结构的复杂性以及脑部区域边界的模糊性,上述方法在分割DTI 图像的不同脑组织的精确度上差异很大,存在着一定的局限性。
针对上述方法的不足,本文提出了一种基于对称图像归一化配准的DTI 脑区分割方法,它是以磁共振T1 图像的分区图为前提,利用ANTs 配准方法,结合对称图像归一化的配准模型,将磁共振T1 图像与DTI 的b0 图像进行配准,从而获取DTI 空间的位移场信息,再使用位移场将T1 图像的分区图映射至DTI 空间,最终得到DTI 图像的脑区分割结果。本文选取了阿尔茨海默症(Alzheimer's Disease, AD)患者作为实验对象进行研究,而其发病时通常局部脑区会发生异常,因此,需要选取合适的方法对局部脑区的分割结果进行定量和定性的评估。以往的方法大多采用两种方式:一种是针对DTI 图像的局部脑区,通常会选用手动分割该区域,再将自动分割结果与其作比较,来验证实验的准确性。此方法对磁共振T1 图像的适用性更高,但是,由于DTI 图像的分辨率低,在此基础上进行手动分割的效果不佳,容易因“金标准”划分的错误而直接影响其最终结果。因此,本文采用的是定量评估中常用的另一种方法,即统计学的研究方法,它可以从侧面反映局部脑区划分的准确性,且该方法可结合DTI 图像中的各向异性图来更好地验证AD 患者发病时相较于正常对照组(normal control, NC)其脑区异常部分。实验结果表明,该算法取得了良好的分割结果,有助于精确地理解人脑微观结构,进而更好地辅助临床进行疾病的诊断。
1 对称归一化配准的多图谱大脑扩散张量图像分割方法
基于DTI 成像的全脑区分割方法是基于磁共振T1 成像的更深层研究,由于DTI 图像的不易分割性,因此,实验考虑将已得到的基于T1 成像的脑分割图像通过某种配准和映射的方式转换为对应的DTI 分区图。基于磁共振T1 的大脑分割方法[13]是利用多图谱的分割方法,借助多项式展开的配准和全局加权融合,得到最终目标图像的分割结果。得到T1 分割图像后,提取同一病例DTI 图像的b0 图像,将目标图像与b0 图像运用ANTs(advancednormalization tools)中的对称归一化(symmetric normalization,SyN)变换模型对两者进行空间配准,将位移场参数映射至T1 对应的分割结果中,即可得到在DTI 空间上的全脑区分割结果,此方法将不易被手动分区的DTI 图像进行了巧妙的转换,利用磁共振T1 图像的特点,得到了最终的分割结果。该方法的流程如图1 所示。

图1 DTI 图像分割算法流程图Fig.1 Flow chart of DTI image segmentation algorithm
1.1 ANTS 配准方法
由于不同人群的大脑解剖结构各不相同,因此,需要通过配准操作将不同的个体配准到同一个空间上,从而确定大脑的形态。ANTs[14]是近年来对2 个图像进行配准中效果最好的软件之一,它是基于C 语言进行编写的,其运行速度较快,且不受图谱与目标图像的图像大小限制,此配准包通常在Linux 系统下使用较为广泛。
实验中,使用ANTs 中的SyN 变换模型[15]进行配准操作,它是仿射变换和可变形变换的结合,以互信息作为其优化的指标,用最大化微分同胚映射空间内的互相关,优化了欧拉-拉格朗日配准技术所不能保证的相似性度量的对称性。微分同胚是具有可逆性的映射[16],通常假设刚性和缩放变换已经进行了提取,且图像的边界也能进行映射。在此空间中元素之间的最短路径称之为测地线,SyN 方法能够保证在测地线连接2 个图像(即图像I 和图像J)的前提下,使得2 个图像都沿着形状进行流线型移动,且无论相似度或优化参数如何改变,从图像I 到图像J 和从图像J 到图像I 的路径一致。此外,在进行距离估算的同时,也要保证其对称一致性,其映射情况如图2所示。第1 行为初始化时的原始图像I 和原始图像J;第2 行为经过SyN 方法收敛后,这些图像经过微分同胚变形后的状态;第3 行为变形的位移场;第4 行为变换的函数。I(0.5)表示在0.5 时刻原始图像I(0)变换后的图像。

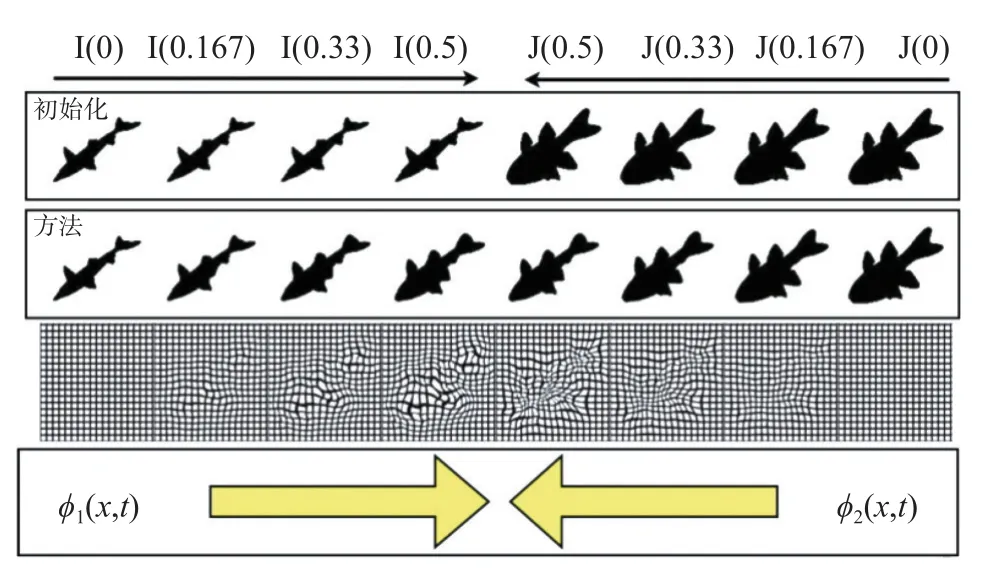
图2 图像I 和图像J 的SyN 测地线路径[17]Fig.2 SyN geodesic path of image I and image J[17]
1.2 b0 图像的位移场映射
DTI 技术是近年来研究脑成像的新方向,它是利用水分子布朗运动的特点去间接反映人体组织结构,根据水分子的运动方向及形式去判断其三维走向,从而达到研究脑功能的目的,对脑白质疾病及研究脑网络的连接性、完整性及其他特点的评估提供了新的依据,具有磁共振T1 加权像、磁共振T2 加权像等其他常规MRI 图像无法与之比较的优越性。b0图像是DTI图像在扫描时当b值为0 时生成的图像[18],b为扩散敏感系数,其表达式为
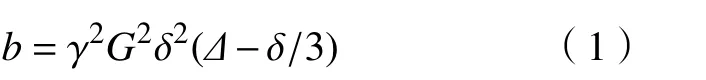
式中: γ为旋磁比;G为 磁场强度; δ为每个梯度脉冲施加的时间; Δ为脉冲施加的时间间隔。
从式(1)中可以得到,b值为常数,由施加磁场的梯度场强的参数来确定,且b的值越大,弥散运动发生时水分子越敏感,b0 图像如图3 所示。
图3 b0 大脑图像Fig. 3 b0 brain image
实验中,将目标的待分割T1 加权图像与DTI的b0 图像通过ANTs 进行配准,得到其空间的对应位置信息及映射的位移场参数,再将此位移场映射至目标图像的分区图,即可得到在DTI 空间上的全脑区分割图像。
1.3 FA 图像
各向异性分数(fractional anisotropy, FA)[19]是用来反映分子之间的差别和离散性的表示方法,它的定义为
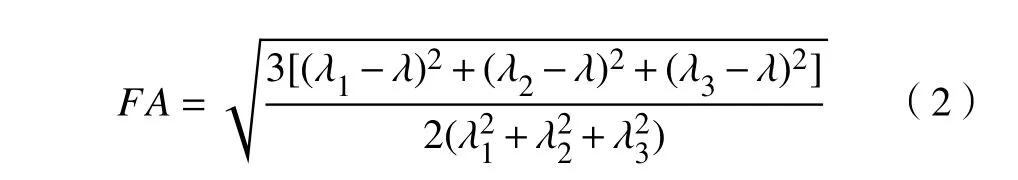
式中:FA为部分各向异性指数; λ1,λ2,λ3表示扩散张量的本征值, λ=(λ1+λ2+λ3)/3表示张量的平均扩散率。
FA常用于衡量扩散张量部分各向异性的程度,它的值在0~1 之间进行变化,当FA=0 时,则表示扩散各向同性;当FA=1 时,则表示扩散各向异性。目前,在临床研究中,FA值的应用较为广泛,其原因如下:
a.FA值不会随着坐标系的改变而轻易进行改变,也就是说它具有旋转不变性的特点。
b. FA 图像可以获取到脑灰质及脑白质之间的对比性,因此,它可以较为容易地对脑部的感兴趣区域进行提取,适用于作为全脑区分割的参考比较图像。
c. FA 图像具有较高的信噪比,与脑区分割图像进行点乘后可以较好地反映各个脑区的不同特征,便于后续的针对某个脑区或者某些区域进行分析,FA 图像如图4 所示。
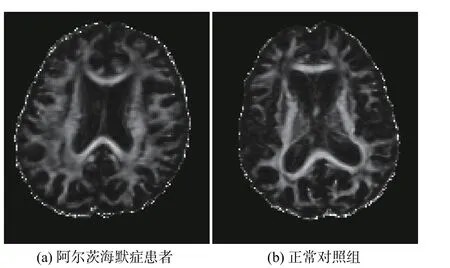
图4 FA 大脑图像Fig. 4 FA brain image
由于FA 图像是表示脑白质等组织各向异性及完整性的一个度量指标,而AD 患者发病时通常脑白质等区域容易发生异常。因此,本实验选择将DTI 的FA 图像与磁共振T1 分区图对应的各个脑区的标签进行逐一点乘,提取出各个感兴趣的脑区区域,再针对AD 患者发病时容易发生异常的脑区通过合适的统计学方法进行评估和验证。
1.4 统计分析方法
实验中,利用SPSS(statistical product and service solutions)17.0 软件[20]对所得到的脑区分割结果进行统计学评价,运用独立样本t检验对AD 和NC 进行比较。在进行独立样本t检验前,需要对实验数据进行正态分布的验证,保证其满足正态分布才能进行下一步的分析。因为只有满足了这个前提,才可以保证计算出的统计量能够满足T 分布[21]。当P>0.05 时,则接受原来的假设,认为对应脑区的差异不具有统计学意义;在P<0.05时,则否定原先假设,认为对应脑区的差异具有统计学意义。在统计参数的比较中,选择脑区图像的灰度平均值进行统计学检验,灰度均值反映了图像中所有像素灰度值的算数平均。均值越大,则说明图像的亮度越大;均值越小,则代表图像的亮度越小,其公式为
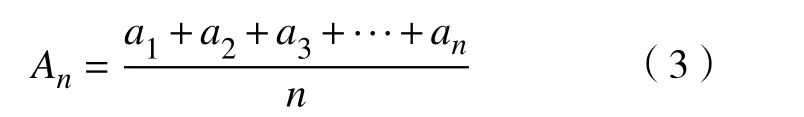
式中:An代 表计算得出的灰度均值;a1,a2,···,an代 表各个像素点的像素值;n代表像素点的总个数。
2 实验数据
2.1 实验环境与数据
本文所有的实验均在Window10 系统下进行操作,运行环境为:内存8.0 GB;芯片Intel Core(TM) i7-8700 CPU @3.20GHz;算法是基于Matlab语言开发的,其版本为R2018a。实验的第一个数据集来源于the Alzheimer’s Disease Neuroimaging Initiative(ADNI)[22]数据集的40 例磁共振T1 加权MRI 序列和其对应的DTI 序列图像(其中,20 例为AD 患者病例,20 例为NC 对照组);第二个数据集是15 例T1 加权像及它对应的标签图像,该数据集来自OASIS 数据库,被用于MICCAI 2012多地图集标记重大挑战赛和研讨会[23]。该数据集的标签均由临床的专家进行了手动标记,共标注了138 个结构,其中28 个标签为非皮质层结构[24],分别为:第三脑室、第四脑室、脑干、左/右半球伏隔核、脑白质、小脑白质、尾状核、杏仁核、海马、侧脑室、苍白球、壳核、丘脑、腹侧间脑以及小脑小叶IV、VI-VII 和VIII-X。ADNI 数据集中的每例图像数据的切片数量在201~254 之间,切片尺寸为1 96×197,其具体数据信息如表1 所示。MICCAI 数据集中的每幅图像的切片数量在261~334 之间,切片尺寸为 256×256。2 个数据集合的各向同性分辨率均为1 mm×1 mm×1 mm。
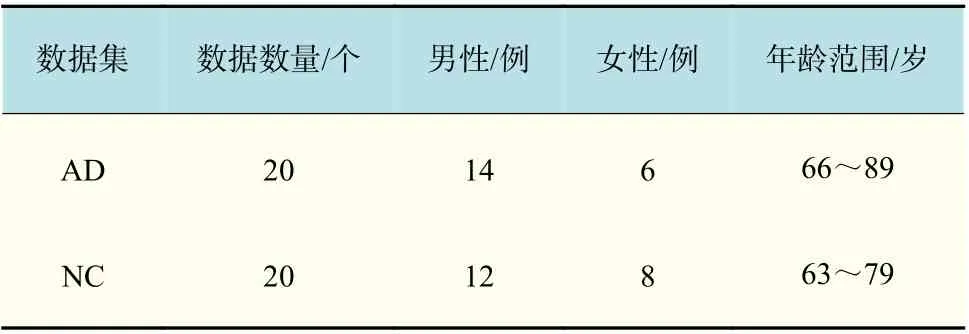
表1 ADNI 数据集信息Tab.1 ADNI dataset information
2.2 实验预处理
ADNI 数据集获取的40 例数据是DICOM 格式的图像,而后续的操作需要NIFTI 图像进行操作,因此,首先使用Mricron 软件中的dcm2nii.exe将所有图像都转变为NIFTI 格式的图像,在软件界面中通过File 中的DICOM to NIFTI 添加需要转换的图像或者文件夹即可进行转换,将转换后的DTI 图像运用FSL 软件进行了b0 图像和FA 图像的提取。
由于每例图像数据的切片数目各不相同,为了便于后续的实验操作及评价,将2 个数据集中所有的磁共振T1 图像的切片数都调整成256×334×256。然后使用FSL 软件中的BET-Brain Extraction Tool[25]对磁共振T1、b0 和FA 的颅骨进行了剥离操作,最后使用3D Slicer 下的N4ITK MRI Bias correction 对图像进行偏置场校正,以保证图像灰度的标准化[26],去除多余噪声等干扰信息。实验预处理后的T1、b0 和FA 图像如图5 和图6 所示。

图5 预处理前后对比图(AD 患者组)Fig.5 Comparison of before and after preprocessing (AD patient group)
图6 预处理前后对比图(NC 对照组)Fig.6 Comparison diagram before and after preprocessing (NC control group)
3 实验结果与分析
本文在基于多图谱的分割算法得到磁共振T1 图像的分割结果后,进一步获得了DTI 图像的分割结果。实验运用ANTs 的配准方法,结合DTI 的b0 和FA 图像的特点,获取了DTI 空间上的全脑区分割结果。图7 为ADNI 数据集中AD 患者和NC 对照组的DTI 图像的脑区分割结果。为了更加直观地显示其分割效果,用不同颜色区分了AD 与NC 最终分割结果中的各个脑区。
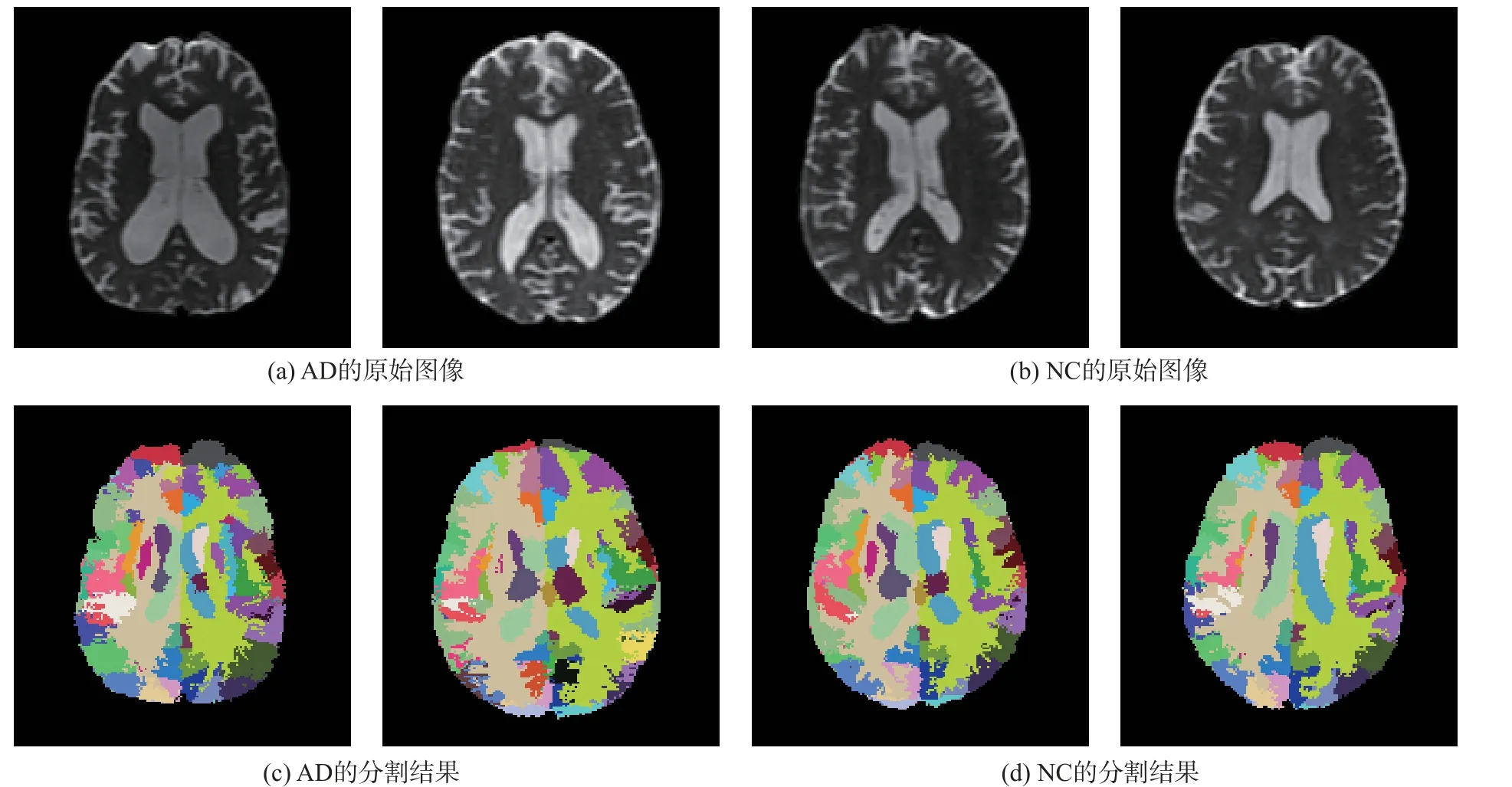
图7 AD 和NC 的DTI 脑区分割结果Fig.7 DTI brain segmentation results of AD and NC
由于脑白质被神经轴突和髓鞘包裹,其主要用于对外周器官进行信息传递及协调[27],白质的异常可以反映AD 患者大脑的功能性变化。因此,临床上可以通过脑白质纤维束来对AD 局部异常进行判断,其标签图像如图8 所示。另外,脑灰质、海马及颞叶也是早期AD 患者中可能发生异常的脑区。
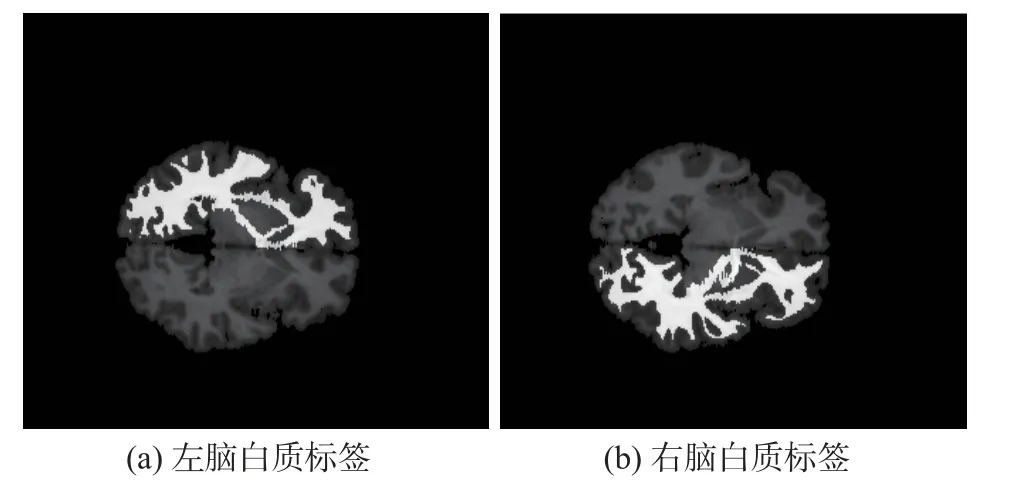
图8 脑白质的标签位置图像Fig.8 Image of the label position of the white matter of the brain
实验中,将AD 和NC 的脑区运用独立样本t检验,结果如表2 所示。从表2 中可以看出,AD 患者相对于NC 对照组而言,它在大脑白质区域、灰质区域及海马体等重要的中枢神经系统脑区发生了异常,经过SPSS 软件的独立样本t检验,得出P<0.05,证明AD 和NC 在这些脑区具有显著性差异。
从结果中可以看出,基于DTI 图像去研究AD 患者和NC 对照组的脑区结构可以反应老年时期大脑白质、灰质等容易产生异常的脑区的位置和功能性变化。同时,对于正常老年人个体的研究也可以加深对大脑神经性疾病(例如:AD, 轻度认知障碍(mild cognitive impairment, MCI)等)可能出现异常情况的理解与分析,从而为临床获取有价值的解剖及病理性信息提供了帮助和推进作用。
4 结 论
本文主要将原始的利用多图谱对磁共振T1 图像的大脑分割转变为对DTI 图像的分割。由于DTI 图像的分辨率低,且是四维图像,因此,很难手动地进行脑区的勾画及划分。因此,本文在基于T1 分区结果的基础上,利用ANTs 的配准方法,将待分割的目标图像与DTI 的b0 图像利用SyN 配准模型进行配准,得到其映射的位移场信息,再将位移场映射至T1 图像的分区图从而得到在DTI 空间上的各个脑区分割结果。然后将该分区图与DTI 的FA 图像进行点乘,计算其图像的灰度均值。利用统计学的独立样本t检验方法验证AD 患者和NC 对照组在脑白质、脑灰质、海马体和颞叶等脑区的异常情况,最终得到P<0.05,则表示这些脑区具有显著性差异,说明这些脑区是临床上阿尔兹海默症患者可能发生异常的脑区位置。另外,DTI 图像能够反映分子的扩散运动信息,对于脑白质的纤维束追踪有着重要的影响意义,本文得到的DTI 脑区分割结果有望于在将来纤维束追踪方面提供新的研究思路,更有望于在临床上对大脑疾病的研究和诊断提供帮助和分析依据。

