甲氧苄氨嘧啶在黏土矿物上的吸附解吸机理
李彦芸,魏雅楠,毕二平
(中国地质大学(北京)水资源与环境学院,水资源与环境工程北京市重点实验室,北京100083)
随着工农业发展,人工化学品被广泛使用。甲氧苄氨嘧啶(Trimethoprim,TMP)作为一种广谱抗菌剂,常用于治疗各种细菌感染。由于TMP 难以被人类和动物代谢吸收,其未被吸收部分会通过尿液和粪便释放到环境中,对人类健康和生态环境造成危害。TMP 在海水、地下水、饮用水等多种水体中均有检出,浓度水平主要为ng∙L,且已有学者在水产养殖泥样中检测到TMP 抗性细菌的存在。TMP 在水环境中的高检出率和生态危害已引起广泛关注。
地表水进入地下水前,会通过土壤包气带或河道底泥,期间发生的吸附-解吸过程是控制有机污染物环境归宿的关键。黏土矿物作为天然土壤的基本骨架和河流底泥中的重要成分,是土壤/底泥中的有效吸附剂。有研究表明,离子交换是蒙脱土(Montmorillonite,MMT)吸附 TMP 的主要机制,而黏土表面的氧原子或附着水与污染物的极性基团之间可以形成氢键。此外,环境因素(如pH、温度、离子强度、溶解性有机质等)可对TMP 的吸附-解吸过程产生较大影响。目前,关于TMP 的吸附研究主要集中在对不同吸附材料的探索(如中孔炭、活性污泥、微塑料等),以及多种抗生素共存时的相互作用及对其迁移特性的影响,而对于黏土矿物结构性质影响的对比研究则相对较少。此外,游离氨基酸作为土壤中含量最丰富的有机氮单体,对污染物迁移、矿物风化等均有较大影响,其作为共存有机组分对TMP 在黏土矿物上吸附的影响还有待探究。
因此,本研究选用高岭土(Kaolinite,KAO)和蒙脱土两种常见且结构性质差异较大的黏土矿物作为吸附剂,选用地下水一般组分Na和与层状硅酸盐具有较强亲和力的L-赖氨酸(L-Lysine,Lys)作为共存组分,通过批实验探究不同赋存形态TMP 在不同黏土矿物上的吸附/解吸特征,讨论不同机理在黏土矿物吸附TMP 中的贡献,以期为再生水回灌及使用过程中的环境风险评估提供理论基础。
1 材料与方法
1.1 材料与仪器
主要试剂与材料包括:TMP(日本TCI,>98.0%),Lys(日本TCI,>97.0%),KAO(天津福晨化学试剂厂,分析纯),MMT(国药集团化学试剂有限公司沃凯系列,分析纯),氯化钠、氯化氢和氢氧化钠(北京化工厂,分析纯),甲醇、乙腈和乙酸(美国Mreda Technolo⁃gy 公司,色谱纯),Milli-Q 超纯水。将 TMP 溶于甲醇制得高浓度TMP 储备液,于4 ℃低温避光保存。TMP和Lys的部分基本理化性质见表1。
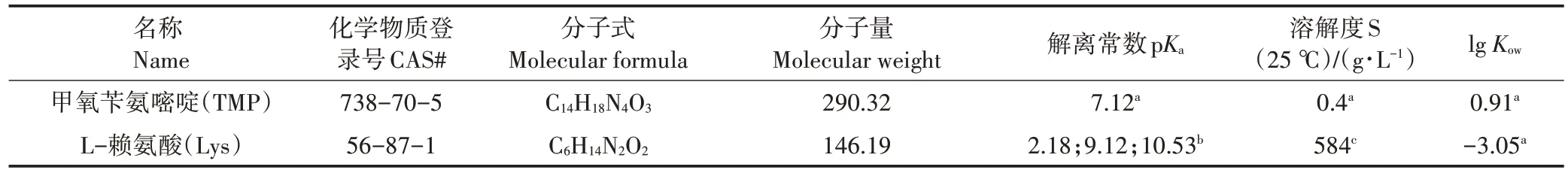
表1 TMP和Lys的部分基本理化性质Table 1 Some basic physicochemical properties of TMP and Lys
主要实验仪器包括:高效液相色谱仪(LC-20AT,日本岛津)、电子天平(BP221S,德国Sartorius)、pH 计(PB-10,德国Sartorius)、恒温振荡仪(QYC-2112,上海福玛)、低速离心机(L550,湖南湘仪)。
1.2 实验方法
1.2.1 黏土矿物吸附TMP的动力学实验
取一定体积TMP 储备液配制浓度为1 mg∙L的TMP 初始溶液(背景溶液为0.01 mol·LNaCl),初始pH 用 HCl 和 NaOH 分别调节至 3.0、6.5、11.0。称取 2 g KAO 或 1 g MMT 置于 20 mL 棕色玻璃瓶中,然后加入20 mL TMP 溶液,拧紧瓶盖(内含聚四氟乙烯垫)。所有样品准备好后,放入摇床恒温振荡(175 r∙min,25 ℃,避光),分别于设置的反应时间点(10、20、40、60、120、240、480、720、1 440、2 880 min 及4 320 min)取样,3 000 r∙min离心 10 min,取约 2 mL 上清液用高效液相色谱仪分析。动力学实验及不同因素影响实验中,每组实验均设置2 个平行样、1 个控制样(不加黏土矿物)。
1.2.2 pH影响实验
分别称取 2 g KAO 或 1 g MMT 置于 20 mL 棕色玻璃瓶中,加入20 mL 1 mg∙L的TMP 初始溶液(背景溶液为 0.01 mol·LNaCl),KAO 溶液初始 pH 为 2.5、3、5、6.5、7.5、10、11,MMT 溶液初始pH 为2、3、4、5、7、8.5、10、11。然后将所有样品水平放入摇床(175 r∙min,25 ℃,避光)中振荡至平衡(平衡时间依动力学实验而定),后续步骤与动力学实验相同。
1.2.3 无机和有机组分影响实验
分别称取1 g KAO 或MMT 于棕色玻璃瓶中,加入 20 mL 初始浓度为 0.4、0.6、0.8、1.0、3.0 mg∙L及5.0 mg∙L的 TMP 溶液,背景溶液分别为 0、0.005、0.01、0.05 mol·LNaCl 和 0.01 mol·LNaCl 与 0.01 mol·LLys 的混合溶液,初始 pH 调至 6.0。后续步骤与pH影响实验相同。
1.2.4 解吸实验
在无机和有机组分影响实验结束后进行解吸实验。在吸附平衡后,离心,取出约16 mL 上清液,分别加入等量的解吸液。无机组分同一样品的解吸液仅有一种,是与等温吸附实验相应的0~0.05 mol·LNaCl 溶液;有机组分同一样品的解吸液有两种,分别为 0.01 mol·LNaCl 溶液和 0.01 mol·LNaCl 与 0.01 mol·LLys 的混合溶液。拧紧瓶盖后用漩涡混合器混合均匀并放于摇床中振荡至解吸平衡,解吸平衡时间与吸附平衡时间相同。平衡后离心取样,操作步骤和条件与等温吸附实验相同。循环操作3 次,即进行3次解吸。
1.2.5 TMP分析检测方法
TMP 的液相浓度通过高效液相色谱仪测定。仪器参数为:流动相为乙腈和超纯水,体积比=17∶83(含体积百分比为0.4%的乙酸);流速0.6 mL∙min;色谱柱150 mm×4.6 mm;柱温35 ℃;UV 检测波长271 nm;进样量10µL;保留时间10 min。
1.3 数据处理
吸附平衡实验中,TMP在黏土矿物上的吸附量按照公式(1)计算:

式中:为吸附平衡后吸附质的固相吸附量,mg∙kg;为吸附质的初始液相浓度,mg∙L;为吸附平衡时吸附质的液相浓度,mg∙L;为溶液体积,L;为吸附剂质量,kg。
吸附等温数据均采用Freundlich 模型拟合,具体公式为:

式中:为吸附常数,反映吸附亲合力的强弱,L∙kg∙mg;为非线性参数,用于判断等温吸附的非线性程度。
2 结果与讨论
2.1 黏土矿物吸附TMP的动力学特征
TMP 在KAO 上的吸附过程可明显划分为快速吸附和慢速吸附两个阶段(图1a)。与KAO 不同,TMP在MMT上的吸附过程与pH有关(图1b),当溶液初始pH 为3.0 时,随反应进行,溶液中TMP 的浓度先迅速下降,而后缓慢上升直至达到平衡。产生这种现象的原因可能是:一方面,低pH 时溶液中的H将少部分已经吸附在MMT 上的TMP置换下来;另一方面,随反应进行,体系pH 从3.05迅速上升到7.47,使得部分TMP转变为TMP(TMP 赋存形态百分比见图1a),阳离子交换及静电引力减弱,部分TMP解吸。当溶液初始pH 较高时,TMP 在MMT 上的吸附过程与KAO类似。依据吸附动力学结果,将TMP 在两种黏土矿物上的吸附平衡时间定为24 h。

图1 不同pH下TMP在KAO和MMT上的吸附动力学结果Figure 1 Adsorption kinetics of TMP on KAO and MMT at different pH value
2.2 pH对黏土矿物吸附TMP的影响
为了进一步探究不同形态TMP 在KAO 和MMT上的吸附特征,设定TMP 初始浓度为1 mg∙L,进行了不同初始pH 下的等温吸附实验。总体来看,当TMP 初始浓度一定时,随溶液 pH 增大,TMP 在 KAO上的吸附量呈现先增大后减小的趋势,而在MMT 上的吸附量表现为先略微升高而后迅速下降的趋势(图2)。由于KAO 和MMT 的缓冲能力不同,在初始pH为2.5~11.0 的调节范围内,平衡pH 分别向5.0 和8.0偏移,从而影响着各体系内TMP 的存在形态和黏土矿物表面的带电性。

图2 不同形态TMP在KAO和MMT上的吸附特征Figure 2 Adsorption characteristics of different forms of TMP on KAO and MMT
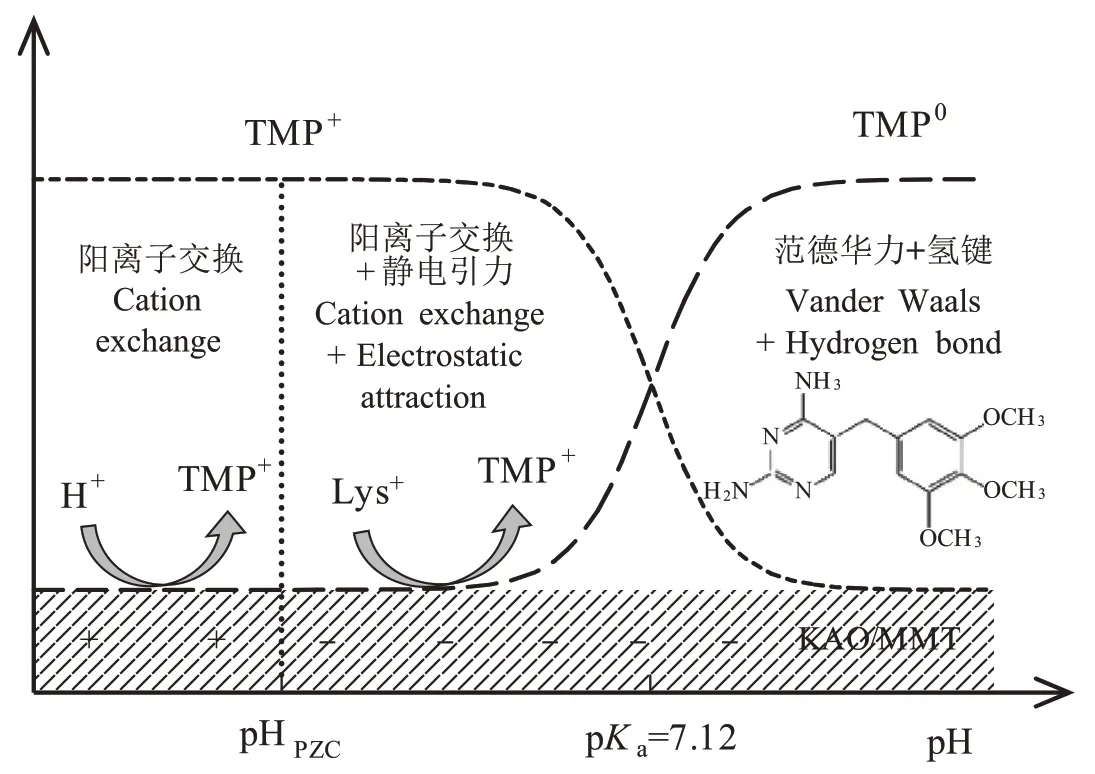
KAO的零电荷点(pH)为3.77。当溶液pH<3.77时,KAO表面带正电,TMP为主要存在形态。KAO与TMP之间会产生静电斥力,吸附机理主要为阳离子交换。此外,有研究表明,低pH下黏土矿物表面的水分子与质子结合形成的水合氢离子,能与有机阳离子竞争吸附位点,且H数量越多,竞争作用越强。因此低pH 时TMP 在KAO 上的吸附量较低。随溶液pH增大,吸附量大幅增加并在pH 5.5 左右达到最大值。当 3.77
MMT 的 pH为 2.19,在本实验平衡 pH 范围内(2.7~10.4),MMT 表面均带负电。当 2.6
通过近似估算,当 pH 为 5.0~6.0 时,MMT 的吸附能力约为 KAO 的 2 倍(该条件下 MMT 和 KAO 的液相平衡浓度分别为0.10 mg∙L和0.11 mg∙L),这与二者的结构性质不同有关。KAO 的结构单元层之间以氢键连接,晶格中几乎没有取代,仅可在晶格边缘引起少量阳离子交换(CEC 为 3~15 cmol∙kg)。而MMT 层间依靠分子间作用力连接,具有可膨胀性,较大的内外表面可以提供充足的吸附位点,且由于其表面带有大量的永久负电荷,因此具有较高的CEC 值(80~120 cmol∙kg)。此外前人通过 X 射线衍射测得MMT 的层间距(d)为 14.84~15.01 Å,而 TMP 的分子尺寸为 7.03×7.50×12.28 Å,表明 TMP 在 MMT 上的阳离子交换很可能在层间进行。
2.3 无机和有机组分对黏土矿物吸附TMP的影响
2.3.1 无机离子影响
不同 Na强度条件下,TMP 在 KAO 和 MMT 上的等温吸附数据可用Freundlich 模型较好地拟合(图3),拟合系数均大于0.99(表2)。溶液初始pH 为6.0,由于黏土矿物的缓冲能力不同,吸附平衡后,KAO 体系溶液 pH 下降为 4.51~5.39,MMT 体系溶液pH上升至7.41~7.69。
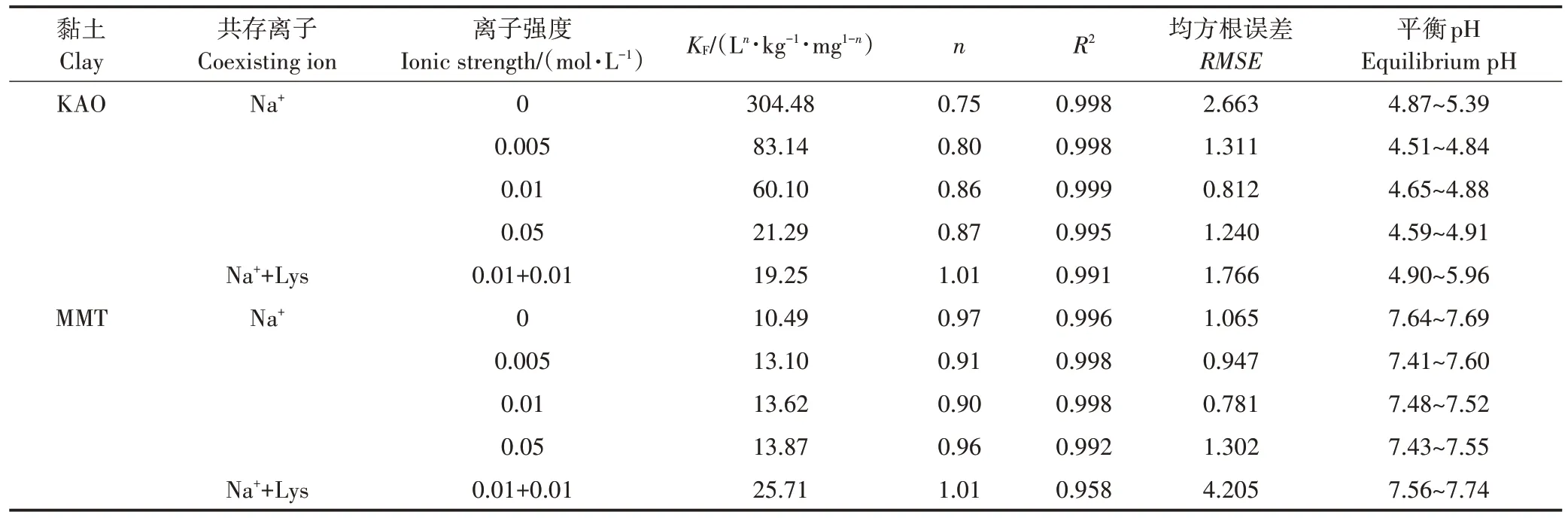
表2 无机和有机组分影响的Freundlich模型拟合参数Table 2 Fitting parameters of the Freundlich model affected by inorganic and organic components
实验条件下,KAO 表面带负电,TMP为主要存在形态(>98%)。图 3a 表明 Na会抑制TMP在 KAO 上的吸附,且随离子强度增大,抑制作用不断增强。当Na浓 度 从 0 增 大 到 0.05 mol·L时 ,从 304.4 L·kg·mg降 低 至 21.29 L·kg·mg。 该 体 系 内 ,TMP与KAO 之间的作用机制主要为阳离子交换和静电引力。当大量Na存在时,Na可与TMP竞争吸附位点,抑制TMP在KAO上的吸附。
在 MMT 体系内,MMT 表面带负电,TMP 以 TMP和TMP共存形态存在(TMP占66%~79%),主要作用机制为分子间力、阳离子交换和静电作用。图3b 表明Na的存在会略微促进TMP在MMT 上的吸附,且随离子强度增大,促进效果没有明显变化。其原因可能是:离子强度的增加降低了吸附平衡时溶液的pH,从而增加了溶液中TMP的比例,增强了阳离子交换和静电吸引在吸附中的作用。Na的水化半径为3.58 Å,TMP 的最大分子面积为92 Å,以最大的 Na强度(0.05 mol·L)和最高的 TMP 初始浓度(5 mg∙L)进行计算,该体系内二者的总平面面积约为433 m。而MMT 具有广阔的内表面,理论内表面积为600~800 m∙g,因此该体系内 TMP与 Na几乎不存在竞争。另外,溶液中近2/3 的TMP 都以分子形态存在,分子间作用力占主导,所以随离子强度增加吸附量没有较大变化。
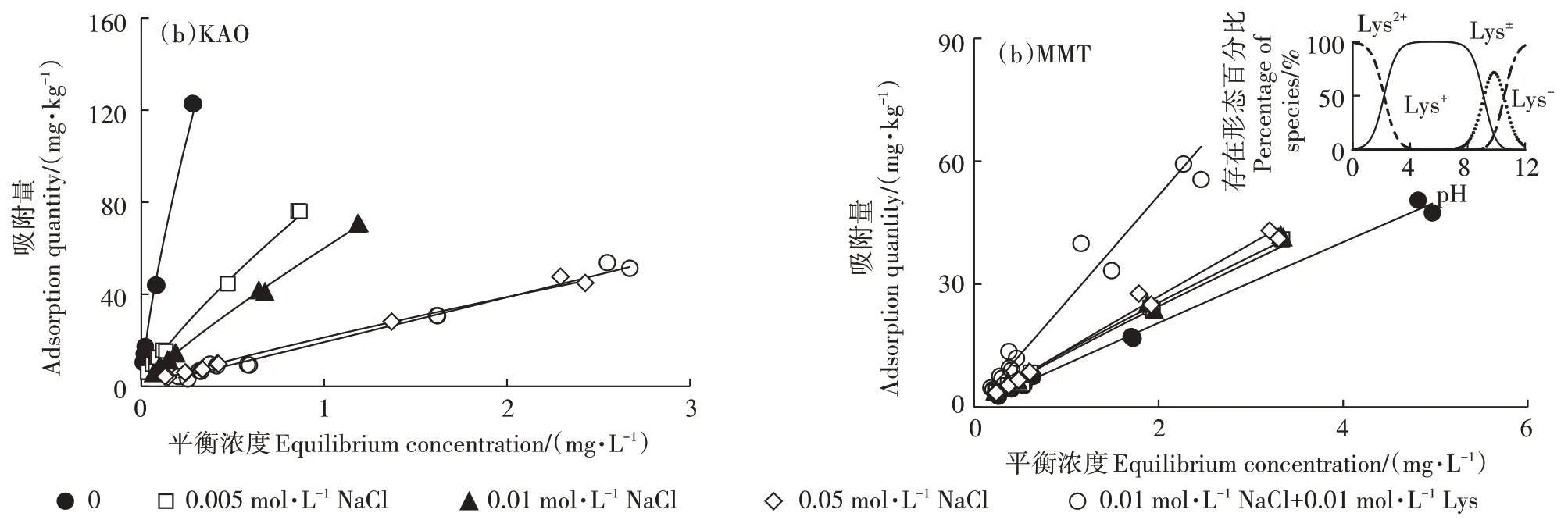
图3 无机和有机组分对KAO和MMT吸附TMP的影响Figure 3 Effects of inorganic and organic components on TMP adsorption on KAO and MMT
2.3.2 有机组分影响
有机组分影响实验中,TMP 在KAO 和 MMT 上的等温吸附数据可用Freundlich 模型良好拟合(图3),拟合系数均大于0.95(表2)。从图3 可以看出,Lys的存在抑制了TMP 在KAO 上的吸附,但促进了TMP在MMT 上的吸附。产生这种现象的原因主要与反应后溶液pH的变化及溶液中物质的存在形态有关。

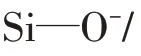
2.4 解吸实验特征
在解吸实验中,随 Na强度增加,TMP 在 KAO 上的解吸率均逐渐增大(图4a)。当Na浓度从0增大到0.05 mol·L时,一次解吸率从5%提高至36%,总解吸率从17%提高至68%。在0.01 mol·LNa的解吸液中加入 0.01 mol·LLys 后,进一步促进了 TMP 在KAO 上的解吸(总解吸率从39%提高至65%左右,图5)。这是因为大量Na和Lys占据了TMP的阳离子交换及静电作用位点,促进了吸附在KAO 上的TMP的解吸。吸附/解吸实验均证实了阳离子交换和静电作用是离子强度和种类影响TMP在KAO 上吸附的主要机理。
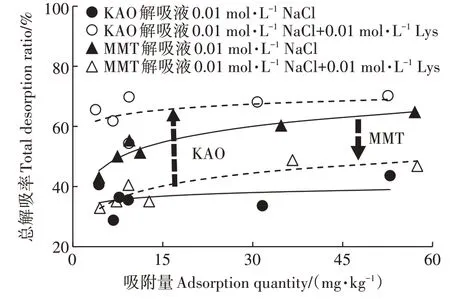
图5 有机组分共存时TMP在KAO和MMT上的总解吸率Figure 5 Total desorption ratio of TMP on KAO and MMT when organic components coexist
从图4b 中可以看出,随Na强度增加,TMP 在MMT 上的解吸率大致相同且整体较高(76%左右)。在 0.01 mol·LNa的解吸液中加入 0.01 mol·LLys后,阻碍了TMP 从MMT 上解吸(总解吸率从77%降低至40%左右)。解吸实验进一步验证了Lys-TMP络合物形成的可能性。

图4 不同离子强度下TMP在KAO和MMT上的多次解吸率Figure 4 Multiple desorption ratios of TMP on KAO and MMT under different ionic strengths
对比KAO 和MMT 的解吸数据可以发现(图4),当解吸液为超纯水时,TMP 在MMT 上的解吸率显著高于KAO(约为其4~5倍),解吸较容易发生。这是因为 TMP 在 KAO 和 MMT 溶液体系中,分别以 TMP和TMP形态存在,阳离子交换和静电吸引的结合强度要远强于分子间力。3 次解吸后,尚余23%左右的TMP 吸附在 MMT 上,这部分 TMP 可能进入了 MMT 的层间结构,故难以解吸。
2.5 各机理吸附贡献定性分析
通过pH 及有机/无机组分影响实验可以得知,阳离子交换、静电吸引和分子间力是TMP 在黏土矿物上的主要吸附机制,各自的贡献率与TMP 的存在形态和黏土矿物的结构性质有关。当KAO 和MMT 表面带正电时(pH (1)甲氧苄氨嘧啶(TMP)在蒙脱土上的吸附动力学过程受到溶液中H竞争吸附与TMP 赋存形态的影响,在溶液pH 较低时(如pH=3.0 时)尤为明显,表现出了吸附先强后弱的特征。pH 及有机/无机组分影响实验表明,TMP的主要吸附机理包括阳离子交换作用、静电吸引和分子间力,吸附分配系数受TMP/TMP比例和作用力强度两方面影响。 (2)当TMP 初始浓度为1 mg∙L且溶液初始pH为6.0时,由于黏土矿物的pH缓冲能力和表面带电性不同,Na和Lys的共存抑制了TMP 在高岭土上的吸附,但促进了其在蒙脱土上的吸附。 (3)初始溶液 pH 为 6.0 时,TMP 在蒙脱土上的解吸率和解吸量约为KAO 的4~5 倍。这是因为TMP 在高岭土和蒙脱土溶液体系中分别以TMP和TMP的形态存在,阳离子交换作用和静电吸引的结合强度远强于分子间力。3 结论

