铌元素改性V2O5-WO3/TiO2催化剂降低脱硝过程 SO2 的氧化率
王 博 ,边 瑶 ,封 硕 ,王少奇 ,沈伯雄,2,*
(1.河北工业大学 能源与环境工程学院, 天津市清洁能源利用与污染物控制重点实验室, 天津 300401;2.河北工业大学 化工学院, 天津 300401)
烟气中的SO3主要来源于SO2与氧气在高温下的直接氧化以及SCR脱硝催化剂的催化氧化[1]。V2O5作为金属氧化物脱硝催化剂中最常用的活性组分,在相同的质量分数下具有较高的催化效率和经济性。目前,钒钛系脱硝催化剂由于其较好的抗硫性能被广泛商业化应用。但含钒SCR催化剂中V2O5成分不仅对NOx的脱除有较强的催化作用,同时也促进了SO2的氧化。Kamata等[2]研究表明,随着钒基催化剂中V2O5含量的增加,SO2的氧化率基本呈线性增长。
烟气中的SO3含量虽然明显小于SO2的量,但是其危害是SO2的数倍。SO3排入大气后,与空气中的水蒸气结合生成硫酸,形成酸雨。硫酸也会与烟气中的飞灰或大气中的尘埃凝结,生成大量的硫酸细颗粒,形成蓝烟与黄烟。烟气中的SO3每增加3.57 mg/m3,烟气的不透明度会增加1%−3%,这些硫酸细颗粒使得能见度降低,容易形成雾霾[3]。不仅如此,SO3形成的硫酸还会腐蚀下游的设备;当SCR脱硝装置出现NH3逃逸时,SO3会与NH3反应生成(NH4)2SO4和NH4HSO4(ABS)。NH4HSO4附着在催化剂表面抑制NH3和NOx的吸附,导致催化剂表面中毒失活,从而缩短催化剂的使用寿命[4,5];当NH4HSO4附着在换热器表面会导致传热效率下降;附着在管道内部使得管道堵塞。另外,SO3极易与人体内部或者皮肤表层的水结合生成硫酸,从而带来疾病[6]。所以,减少SO2氧化,降低SO3生成量是目前降低电厂、钢铁等行业SCR脱硝系统需要考虑的重要内容。
添加催化助剂降低SCR脱硝过程中SO2的氧化率,目前已有一些报道。Chen等[7]研究发现,WO3的加入可以抑制SO2氧化,使SO2/SO3转化率降低。Kobayashi等[8]通过协同共沉降法将钒负载在TiO2-SiO2上,发现以TiO2-SiO2为载体的催化剂V5+含量较低,而V5+可以促进SO2氧化,所以使用TiO2-SiO2做为载体时有利于降低SO2的氧化率。Choo等[9]认为,BaO能抑制SO2在催化剂表面吸附从而降低了SO2的氧化, 但在催化剂中添加碱金属时,碱金属迁移到催化剂活性位附近而发生的中毒现象也是困扰问题之一。关于Nb改性催化剂的研究主要集中在其对脱硝性能以及抗硫性能的影响方面。例如,Hou等[10]研究表明,FeTi催化剂经过Nb改性后,催化剂在宽温区反应中表现出了突出的催化剂活性和抗硫性能。Nb的掺杂丰富了催化剂的酸性位点和提高了NO的化学吸附量。Cao等[11]研究表明,CeWTi催化剂中加入Nb2O5可显著降低SO2中毒程度。催化剂的抗硫性能与催化剂对SO2的氧化存在一定的联系, Sazonova等[12]发现,钒系催化剂掺杂铌氧化物,可以抑制SO2的氧化,但作用机理还需进一步的探究。本研究将铌氧化物添加到V2O5-WO3/TiO2催化剂中,制备不同铌负载量的催化剂,测试SO2的氧化率,探究最优Nb负载量,并通过TGA、BET、XRD、H2-TPR、CO2-TPD、XPS、in-situDRIFTS等表征方法,进一步的探究了SO2氧化率下降的机理。
1 实验部分
1.1 实验材料
商用二氧化钛(TiO2,99%,锐钛矿,重庆新华化工有限公司);偏钨酸铵((NH4)6H2W12O40·xH2O,≥99%,分析纯,都莱生物技术有限公司);偏钒酸铵(NH4VO3,99%,分析纯,北京百灵威科技有限公司);草酸(H2C2O4,99%,分析纯,天津市科密欧化学试剂有限公司);草酸铌(C10H5NbO20,98%,分析纯,上海易恩化学技术有限公司);异丙醇(C3H8O,99.5%,分析纯,罗恩试剂);钍试剂(阿拉丁);高氯酸钡·三水合物(BaCl2H6O11,99%,分析纯,罗恩试剂)。实验所用标准气体见表1。

表1 实验所用标准气体Table 1 The standard gas for the experiment
1.2 催化剂的制备
Ⅰ. 取偏钨酸铵(H8N2O4W)0.48g,草酸(C2H4O2)0.2 g,偏钒酸铵(NH4VO3)0.193 g,加入15 g超纯水中,将溶液搅拌至无絮状物存在。
Ⅱ. 将二氧化钛(TiO2)13.65 g加入到Ⅰ中的溶液,搅拌均匀。
Ⅲ. 将混合溶液室温下静置5 h,之后在100 ℃的干燥箱里干燥10 h。将干燥后的固体用研钵研磨成粉末状。
Ⅳ. 取适量草酸铌(C10H5NbO20)加入15 g超纯水中,用磁力搅拌器将溶液搅拌至无絮状物存在。
Ⅴ. 将Ⅲ中的粉末状的固体加入到Ⅳ的溶液中,搅拌均匀。
Ⅵ. 将混合溶液室温下静置5 h,之后在100 ℃的干燥箱里干燥10 h,将干燥后的固体置于马弗炉中煅烧3 h,煅烧温度为500 ℃,将煅烧后的固体研磨,采用40–60目的标准筛筛取颗粒,得到催化剂V2W5Nb1/TiO2(以TiO2为载体,V2O5、WO3、Nb2O5,质量分数分别为2%、5%、1%。)
根据上述方法分别制取实验所需Nb2O5负载量为0、1%、2%、3%的催化剂,分别记为V2W5/TiO2、V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2。
1.3 实验反应系统及活性测试
催化剂测试系统如图1所示。通过钢瓶气体来模拟烟气,其包含N2、O2、NO、NH3、SO2。由质量流量计控制烟气中各成分的含量以及烟气总流量,气体在气体混合器混合均匀后流入反应器进行反应。实验过程中进出口各气体的浓度由便携式烟气分析仪(KM900;英国凯恩公司)测量。实验过程中反应器使用程序升温,升温速率为10 ℃/min。NOx脱除效率和SO2氧化率通过以下公式计算。

图1 催化剂测试系统示意图Figure 1 Catalyst testing system
SO2氧化率的计算公式:

NOx转化率的计算公式:

1.4 SO3的收集与检测
控制冷凝法[13]是目前测量烟气中SO3含量最为常用和较为准确的方法,SO3的收集率可达98%,因此被广泛的应用。具体流程见图1,经催化剂反应的烟气由反应器流出后直接流入蛇形冷凝管,为了防止烟气中的SO3提前冷凝,反应器烟气出口与蛇形管之间的距离应尽可能的短,或者在这段管路添加保温加热装置,使其温度维持在260 ℃左右。冷凝水的温度应该维持在60–90 ℃。冷凝管借助离心力冷凝液会附着在蛇形冷凝管壁面上。最后用80%的异丙醇水溶液对冷凝管多次冲洗并定容。
SO3的冷凝量通过化学滴定法进行测定。本实验采用的指示剂为0.2%钍试剂水溶液,滴定溶液为0.005 mol/L高氯酸钡的80%异丙醇-水溶液。冷凝管中的SO3经过80%的异丙醇水溶液冲洗,获得含有离子的溶液。向溶液加入2–4滴钍试剂,溶液显示为黄色,再将配制的高氯酸钡溶液滴入其中,由于钡离子刚开始滴入时离子过量,溶液中离子形成带负电的胶团,溶液显示黄色,当第一滴钡离子过量时,胶体变成带正电的胶团,此时溶液由黄色变为橙红色,最后通过钡离子 的滴定量来测试离子的含量。
2 结果与讨论
2.1 催化剂性能实验
将制备的V2W5/TiO2、V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2催化剂置于自制反应器中进行SO2氧化率和脱硝活性测试。
首先,将气体组分为N2(平衡气)、O2(5%)、SO2(0.1%),流量为500 mL/min,空速设为20000 h−1的模拟烟气通入放有催化剂的自制石英管反应器内。由图2可知,Nb改性后催化剂的SO2氧化率都出现了下降的趋势。并且,当Nb2O5含量为2%时,SO2的氧化率最低,在350 ℃下仅为0.296%。相较于改性前V2W5/TiO2催化剂在350 ℃的0.526%下降了0.23%。

图2 不同Nb负载量催化剂对SO2氧化率的影响Figure 2 Effect of Nb loading on SO2 conversion upon oxidation over the Nb-modified catalysts
对上述四种催化剂进行了NOx脱除效率测试,气体组分为N2(平衡气)、O2(5%)、NO(0.05%)、NH3(0.05%),流量为500 mL/min,空速设为20000 h−1。图3为不同Nb负载量催化剂的NOx脱除效率随反应温度的变化。在200–400 ℃催化剂的脱硝效率随着温度的上升呈现增高趋势,四种催化剂在250–400 ℃都有较好的NOx脱除效率,温度在300 ℃以上脱硝效率达97%以上。而Nb改性后的催化剂脱硝效率在300 ℃以下有所下降,但在300–400 ℃,其脱硝效率与没有改性的催化剂基本保持一致,所以改性后的催化剂仍能满足实际NH3-SCR脱硝应用的需求。
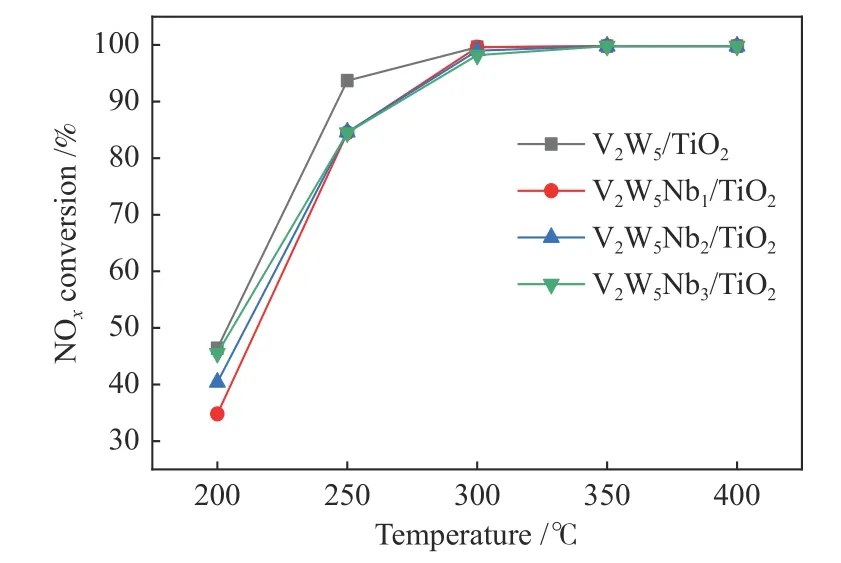
图3 不同Nb负载量催化剂对NH3-SCR活性的影响Figure 3 Effect of Nb loading on the NO conversion in NH3-SCR deNOx over the Nb-modified catalysts
图4为催化剂在NH3-SCR脱硝反应过程中SO2的氧化率,气体组分为N2(平衡气)、O2(5%)、NO(0.05%)、NH3(0.05%)、SO2(0.1%),流量为500 mL/min,空速设为20000 h−1,反应温度为350 ℃。对比图2和图4中四种催化剂在350 ℃下的SO2氧化率发现,烟气中加入NH3和NO(即脱硝过程)后,四种催化剂SO2的氧化率都有所上升,其中,V2W5/TiO2催化剂SO2转化率由0.526%上升到1.104%,SO2氧化率上升了一倍左右,V2W5Nb2/TiO2催化剂的SO2氧化率由0.296%上升到0.614%,这可能是由于氨气的加入促进了SO3的生成[14]。但是,在NH3-SCR脱硝反应过程中V2W5Nb2/TiO2在四种催化剂中仍表现出最低的SO2氧化率,SO2氧化率仅为0.6%。由脱硝效率可以看出,SO2的加入对于四种催化剂的脱硝效率几乎没有产生影响。
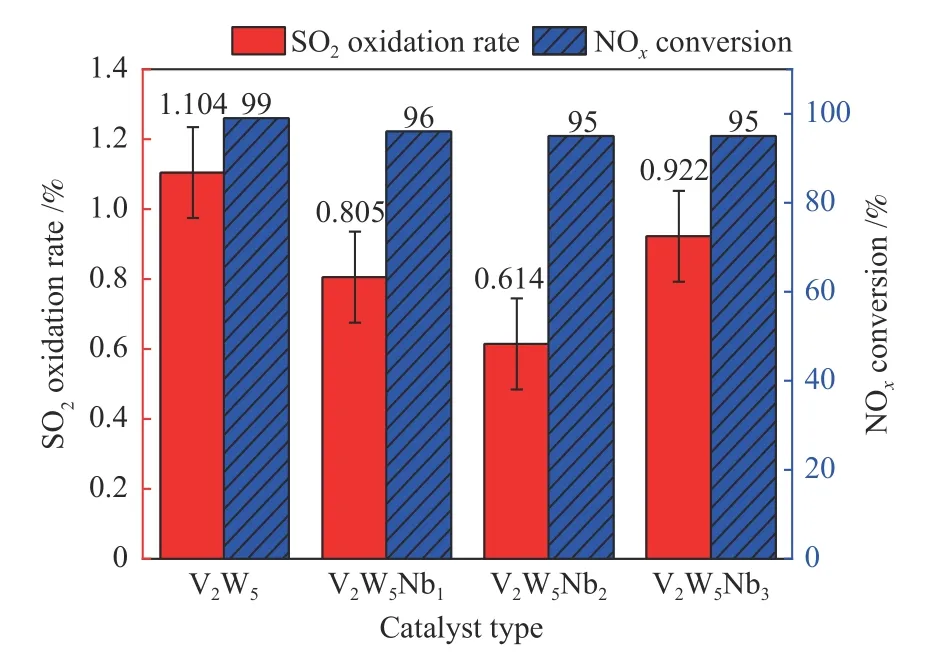
图4 催化剂脱硝和SO2氧化效率Figure 4 Catalytic performance of various catalysts in the simultaneous denitration and SO2 oxidation
由实验结果可知,改性后的V2W5Nb2/TiO2催化剂在脱硝活性上可以满足NH3-SCR脱硝系统的需求,并且SO2的氧化率有了较大幅度的降低。
2.2 比表面积分析
催化剂的比表面积是影响其催化性能的一项重要参数,制备的V2W5/TiO2、V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2催化剂的比表面积、孔容和孔径见表2。添加铌氧化物后催化剂比表面积减小,这是因为Nb的引入渗透到TiO2的微孔中,导致部分孔隙被堵塞[15],并且Nb2O5的团聚现象也对催化剂的比表面积产生影响。当Nb2O5的质量分数为1%时,Nb2O5可能分布不均匀出现团聚现象,导致催化剂的比表面积有了明显的下降,当Nb2O5的质量分数为2%和3%时,Nb2O5分布较为均匀,团聚现象影响减弱,导致对催化剂的比表面积影响减弱。从吸附-脱附等温曲线(图5)中可以观察到H3型回滞环,回滞环是由于材料在吸附和脱附时分别出现毛细管冷凝和毛细管蒸发现象,吸附量随平衡压力增加时测得的吸附分支和压力减小时所测的脱附分支,在一定的相对压力范围不重合而形成[16],常见于介孔材料。同时,也可以从孔径分布图(图6)看出四种催化剂孔径主要分布在3−100 nm,三种改性催化剂的孔径分布都出现了向左偏移的现象。比表面积和孔容的适度下降,降低了催化剂表面吸附位点的暴露量,可能会导致SO2在催化剂表面的吸附下降,从而使得SO2的氧化率下降。由于比表面积的降低在一定的小范围内,所以对于催化剂的脱硝性能影响较小。V2W5Nb1/TiO2的比表面积小于V2W5Nb2/TiO2的比表面积,但对SO2的氧化性能较大,可能原因有如下两方面:一是,V2W5Nb1/TiO2的比表面积较小的原因主要是5 nm以下的微孔占比较少,导致了比表面积的下降,而在中大孔径(8−50 nm)范围内,V2W5Nb2/TiO2催化剂的积分面积最小,由此推测,SO2易于吸附在较大的孔径内部[17],从而使得V2W5Nb2/TiO2催化剂的SO2氧化率最低。二是,比表面积不是导致SO2氧化率下降的唯一因素,催化剂的氧化还原性、催化剂在载体上的分布等因素可能都影响SO2的氧化率。
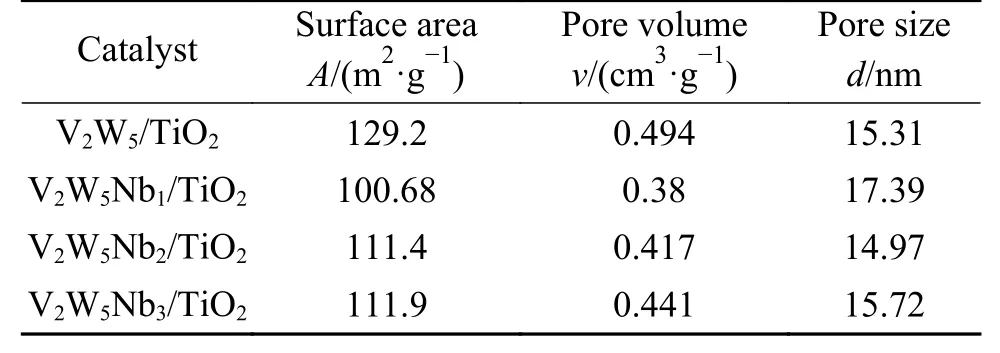
表2 样品的孔结构分析Table 2 Textural properties of various catalysts
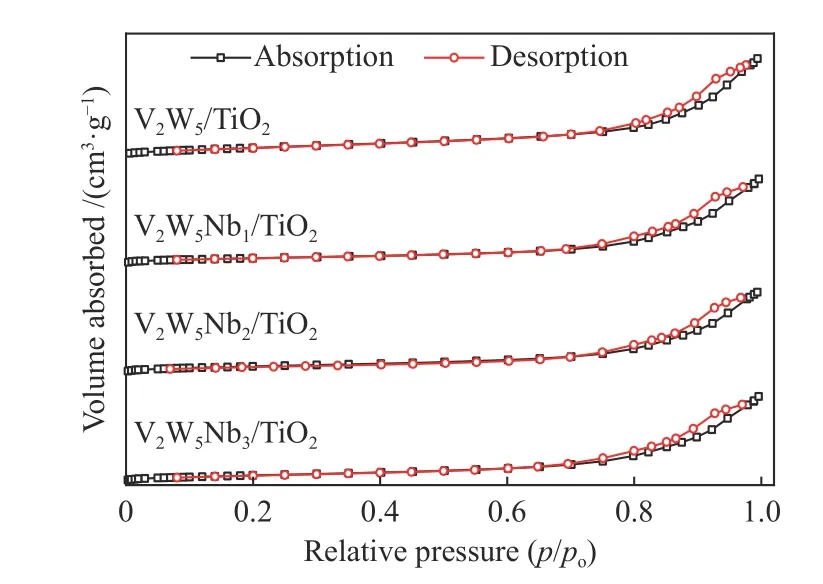
图5 催化剂的N2吸附-脱附等温曲线Figure 5 Nitrogen desorption and desorption isotherms of various catalysts
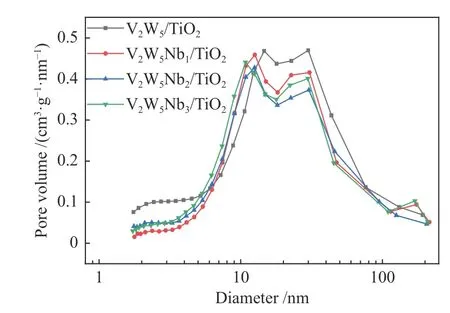
图6 催化剂的孔径分布Figure 6 Pore size distribution curves of various catalysts
2.3 X射线衍射和热重分析
图7为V2W5/TiO2、V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2样品的XRD谱图。从样品的XRD谱图中可以清楚地观察到锐钛矿-TiO2峰的存在,X射线衍射峰出现在25.3°、37.8°、48°、54°、55°、62.8°、69°、70.3°、75°处[18],峰形尖锐,强度较大,结晶性良好,同时没有检测到其他衍射峰,可能是形成高度非晶态或微晶太小,低于XRD检测限,也有可能是V2O5、WO3、Nb2O5在催化剂表面上分散性良好。铌掺杂后催化剂峰的位置、宽度、形状未发生明显变化,说明掺杂铌氧化物活性组分的过程中没有改变TiO2的晶相结构。Nb掺杂后衍射峰强度出现了轻微的下降,可能是由于TiO2表面被氧化铌覆盖所致[19]。
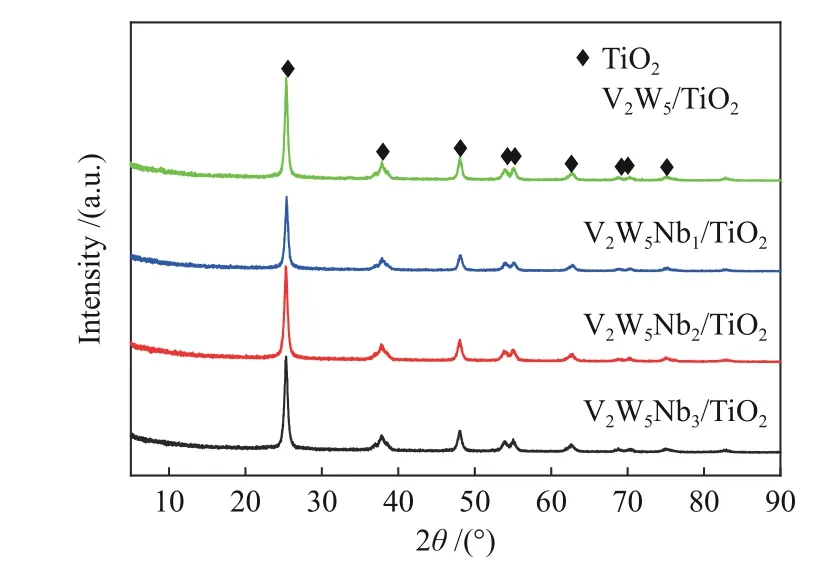
图7 催化剂的XRD谱图Figure 7 XRD patterns of various catalysts
图8为四种催化剂的热重曲线。由图8可以看出,四种催化剂在200–500 ℃的失重比例均在0.5%以内,可以认为在200–500 ℃ 无失重现象,表明催化剂的热稳定性良好。
图8 催化剂的热重分析Figure 8 Thermogravimetric curves of various catalysts
2.4 程序升温还原分析(H2-TPR)
图9为V2W5/TiO2、V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2四种催化剂的H2-TPR谱图。四种催化剂分别在520、536、559、559 ℃出现了一个特征峰,此时的特征峰为V和W物种还原形成的[19]。这里没有出现铌氧化物的还原峰,这可能是由于铌氧化物的还原发生在800 ℃以上[20,21]。由H2-TPR结果可知,随着铌物种的引入,催化剂V、W物种的氧化还原峰峰位向较高的温度移动,V2W5Nb2/TiO2和V2W5Nb3/TiO2催化剂的峰位向右偏移量最大,在559 ℃左右。金属氧化物的氧化态越高越容易被H2还原,所以还原温度向高温区移动的原因可能是铌的引入降低了催化剂表面高价钒的含量。同时V2W5Nb2/TiO2催化剂还原峰的峰值低于改性前的V2W5/TiO2催化剂的峰值。上述结果表明,铌氧化物的加入在一定程度上降低了催化剂的氧化还原特性。
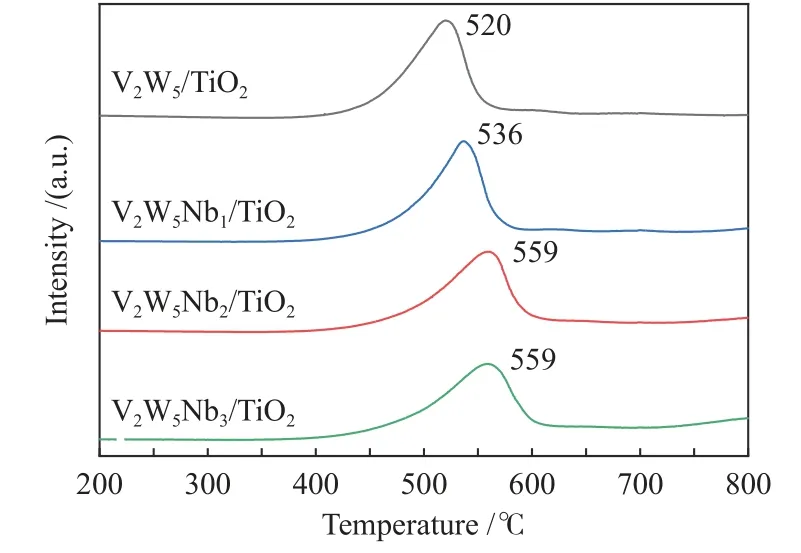
图9 催化剂的H2-TPR谱图Figure 9 H2-TPR profiles of various catalyst
2.5 CO2程序升温脱附分析(CO2-TPD)
SO2吸附是其在催化剂上氧化的重要步骤。SO2在催化剂上的吸附量和吸附强度取决于催化剂上碱性位点数量和类型。为了研究催化剂上碱性位点的数量和类型,对制备的四种催化剂进行了CO2程序升温脱附(CO2-TPD)实验。采用CO2-TPD表征催化剂表面碱性,定义温度低于300 ℃时的脱附峰为弱碱性位[22,23];温度为300−500 ℃时的脱附峰为中强碱性位;温度高于500 ℃时的脱附峰为强碱性位[24]。结果如图10所示。
改性前后的四种催化剂在150–350 ℃出现了一个宽峰,此处的峰对应着催化剂表面的弱碱性位点;在400、435、408、416 ℃对应的峰值为催化剂的中强碱性位点;706 ℃对应的峰值为催化剂的强碱性位点。四种催化剂进行脱硝反应的温度为350 ℃左右,此时在150–350 ℃的弱碱性位点对于SO2几乎不能构成吸附作用。改性后催化剂上中强碱性位点的峰值出现了先上升后下降再上升的趋势,其中,Nb负载量为2%的催化剂在中强碱性位点处的峰值低于原催化剂,并且中强碱性位点的CO2脱附温度最低为408 ℃。经Nb改性后的三种催化剂,在706 ℃左右的强碱性解吸峰消失,说明催化剂上强碱性位点消失。Nb改性后,催化剂中强碱位点减少,强碱位点消失,两者均能说明催化剂对于SO2的吸附能力的降低。

图10 催化剂的CO2-TPD谱图Figure 10 CO2-TPD profiles of various catalysts
2.6 X射线光电子能谱分析(XPS)
XPS用于分析不同样品表面信息和元素化合价的变化。下面将对V2W5/TiO2和V2W5Nb2/TiO2两种催化剂上的元素进行光谱分析,表3为不同催化剂上的原子浓度。
从图11(a)可以看出,V 2p光谱可以分为两个峰,其中,结合能在515.26–515.06 eV的峰为V4+,结合能在516.15–516.22 eV的峰为V5+[25,26],从表3可以看出,V2W5/TiO2催化剂中V主要以V5+的形式存在于催化剂上,但是经过铌改性后的V2W5Nb2/TiO2催化剂,V5+的占比为57.12%,与V2W5/TiO2催化剂对比V5+的含量明显下降。而烟气中的SO2主要被V5+氧化[27],所以V5+含量的降低有利于降低催化剂的SO2氧化性能。

表3 催化剂表面组成分析Table 3 Surface composition of various catalyst determined by XPS
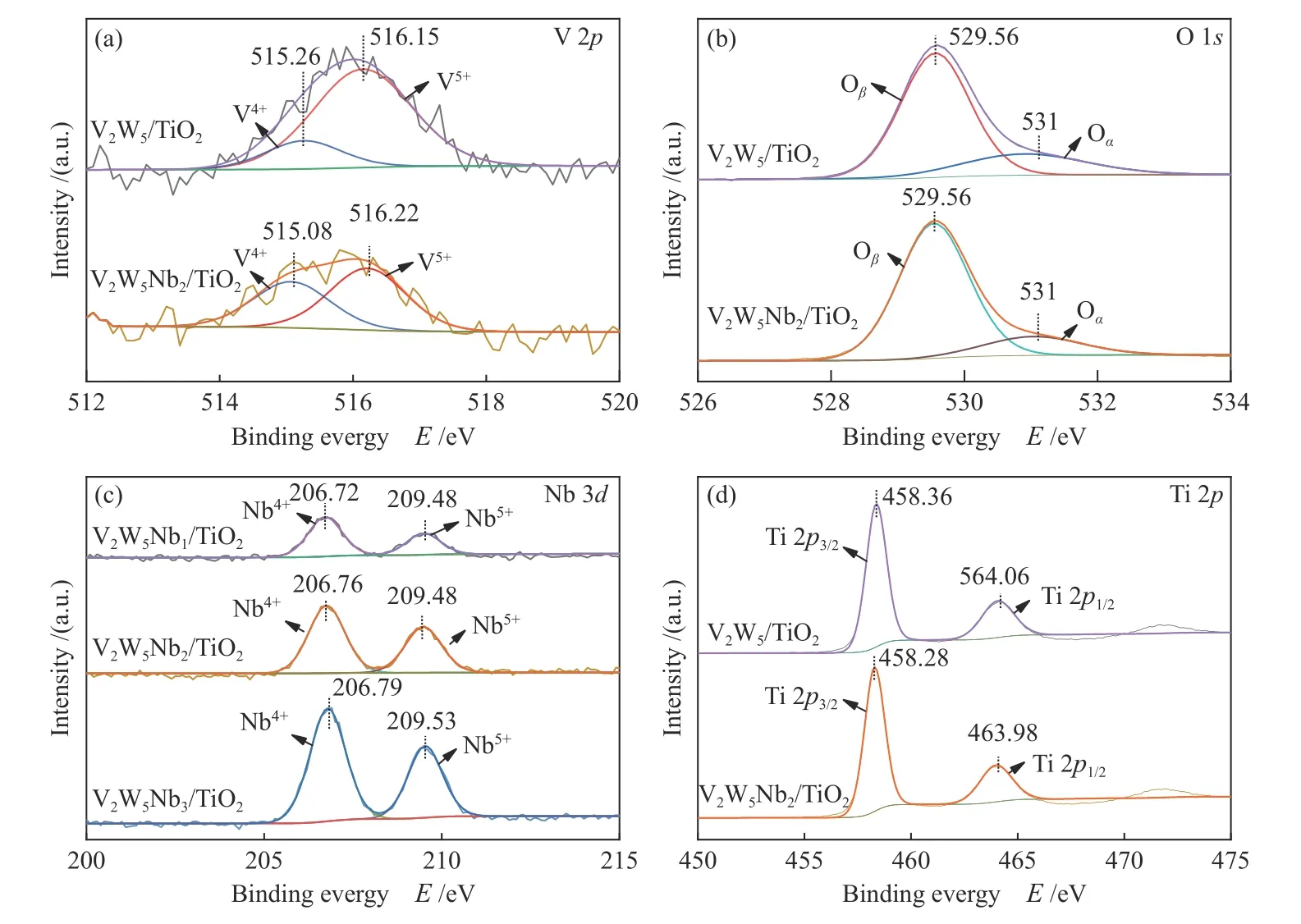
图11 催化剂的XPS光谱谱图Figure 11 XPS spectra of various catalysts
图11(b)为O 1s的光谱,可分为两个峰。第一个峰(529.56 eV)认为是晶格氧(表示为Oß),第二个峰(531 eV)认为是化学吸附氧(表示为Oα)[28],Oα是一类活泼氧,其含量和转移能力在氧化反应中起着至关重要的作用。由表3可知,两种催化剂的含氧量没有太大差别,但是改性催化剂V2W5Nb2/TiO2的Oα含量为16.32%,相比于改性前催化剂降低了7%。Nb4+不利于不饱和化学键和氧空位的生成,降低了化学吸附氧在催化剂表面的富集量,使得改性后的催化剂表面的化学吸附氧含量降低[29],从而降低了催化剂的氧化还原性能,这与低温区脱硝效率的下降和H2-TPR的结果一致。所以Oα的降低,也是SO2氧化率下降的原因之一。
图11(c)为Nb 3d的光谱谱图,在结合能为200–215 eV出现了两个峰,分别为206.76 eV左右的Nb4+3d5/2和209.5 eV左右的Nb5+3d3/2[30]。三种催化剂随着Nb含量的提高,Nb 3d光谱信号峰面积和强度也相应的得到了提高。V2W5Nb1/TiO2、V2W5Nb2/TiO2、V2W5Nb3/TiO2三种催化剂中Nb5+所占的含量分别为40.75%、35.39%、37.83%。V和Nb属于同族元素,有着相似的化学性质,Nb5+可以在催化剂表面形成化学吸附氧(Oα)和弱键氧物种,从而促进NH3-SCR脱硝反应和SO2的氧化[31], V2W5Nb2/TiO2催化剂的Nb5+/(Nb5++ Nb4+)的值最低,也在一定程度上降低了SCR过程中SO3的生成。
图11(d)为Ti 2p的光谱,Ti 2p谱图的结合能为458.36–458.28 eV和464.06–463.98 eV。该结果表明,催化剂上存在T4+离子[26,32]。由表3中Ti的原子浓度和Ti 2p光谱可知,铌的引入对TiO2载体的结晶度没有产生较大的影响,与XRD结果相吻合。
2.7 原位傅里叶红外分析
原位漫反射傅里叶变换红外(in-situDRIFTS)作为一种有效的检测样品表面物种变化的方法,经常被用于研究催化剂表面官能团变化的动态过程。在实验前,先在400 ℃氮气氛围下对催化剂预处理1 h,然后降温到350 ℃,取背景值,然后,通入反应气体进行反应(SO2为0.1%、O2为6%、氮气为平衡气,流量为200 mL/min),反应的同时扫描样品表面,记录谱图,得到的红外光谱谱图如图12所示。
从图12中可以观察到由于SO2与O2在催化剂表面的联合吸附以及反应而产生的在1611、1376、1275、1140–1000 cm−1处的特征正峰,以及在3678 cm−1,处的特征负峰。在1376 cm−1处的正峰条带可以归因于以VOSO4形式吸附到金属氧化物上的表面硫酸盐物种O=S=O的不对称拉伸引起的振动[33−35]。这个谱带的出现表明SO2可以以的形式吸附在催化剂上,吸附的SO2与V5+–OH键反应生成VOSO4形式的中间产物[36]。从谱图中可以看出,V2W5/TiO2催化剂在1376 cm−1处的峰值明显高于V2W5Nb2/TiO2催化剂,表明改性后的V2W5Nb2/TiO2催化剂对于SO2的吸附量降低,减少了中间产物VOSO4的生成量,从而使得SO2的氧化率下降。在1275 cm−1处的正峰被认为是硫酸盐积累的结果,在此波段出现的峰表示为块状硫酸盐的伸展运动[32]。V2W5/TiO2在此处的峰不明显,表明硫酸盐在V2W5/TiO2催化剂表面积累的较少,但是改性后的V2W5Nb2/TiO2催化剂在此处出现了明显的峰值,说明改性后的催化剂表面出现了一定量的硫酸盐积累,此处可能为Nb的硫酸盐物种。Nb的硫酸盐物种附着在催化剂表面阻止了SO2的吸附以及与V2O5的反应,从而减少了VOSO4中间体的生成,所以随着硫酸盐的积累,改性催化剂表面VOSO4的振动峰出现了降低的趋势,这有利于降低SO2的氧化率。但是此硫酸盐在催化剂表面的长期积累,是否会对催化剂的脱硝性能产生影响,还需进一步的催化剂SO2耐久实验进行测试。在1611 cm−1处的正峰是H2O(H–O–H)弯曲引起的[19]。此处的H2O来源于催化剂表面吸附的SO2与表面羟基的反应[37]。对比图12(a)和(b)可以发现,原催化在1611 cm−1处的峰较为明显,并且几乎不随反应时长的延长而变化;但经过Nb掺杂改性后催化剂在1611 cm−1处的峰值较小,并且随着时间延长峰值几乎降为0,出现这种情况的原因可能是由于Nb改性导致催化剂表面SO2的吸附量减少,并且随着反应的进行催化剂表面积累的部分硫酸盐进一步阻碍了SO2的吸附,导致SO2与催化剂表面羟基反应量降低,从而减少了H2O的生成。在1140–1000 cm−1处的峰为双齿硫酸根离子的对称和不对称伸缩振动的分裂峰[38],随着时间的延长峰值出现上升的趋势。在3678 cm−1处的负峰可以归为催化剂种V5+–OH基团的–OH振动[39,40]。
总之,由原位傅里叶变换红外光谱可以推测,V2W5Nb2/TiO2催化剂对于SO2的吸附量降低,并且在SCR脱硝过程中表面会积累一部分硫酸盐,硫酸盐的存在会进一步降低SO2在催化剂表面的吸附,导致VOSO4中间产物的减少,从而降低了SO2的氧化率和SO3的生成量。
3 结 论
通过实验发现,Nb掺杂改性后制得的V2O5-WO3-Nb2O5/TiO2催化剂降低了SCR过程中SO2的氧化率,减少了SO3的生成量。优化Nb的负载量,发现最佳负载量为2%。并且,在350 ℃,NH3-SCR脱硝过程中SO2的氧化率仅为0.6%。改性后的催化剂在270–400 ℃的NOx脱除效率仍然能达到90%以上。
通过XRD和TGA表征可以得出,催化剂经Nb改性后TiO2的晶型并未发现明显的变化,而且改性后的催化剂热稳定良好。由原位漫反射傅里叶变换红外光谱谱图可以明显地看到,改性后催化剂上SO2的吸附量和 VOSO4中间体含量下降。并且CO2-TPD得出了与红外光谱相似的结论。SO2吸附量的降低与比表面积的降低导致SO2吸附位点的减少有关。Nb的掺杂降低了催化剂表面V5+/(V5++V4+)比值和Oα含量,从而降低了催化剂的氧化还原性能。氧化还原性能的降低在H2-TPR测试结果中表现得更加明显。改性催化剂对SO2吸附量减少与改性催化剂氧化还原性得降低两者之间协同作用,使得SO2的氧化率出现了明显的降低。

