微小RNA-98与脓毒症患者可溶性自杀相关因子/配体系统、疾病严重程度及短期预后关系研究
李 英, 邓 超, 计 超海口市人民医院 重症医学科,海南 海口 570208
脓毒症是一种由于宿主对感染的反应失调而引起的危及生命的器官功能障碍[1]。脓毒症的发病机制复杂,涉及感染、炎症反应、免疫等多方面因素。目前,可用的生物标志物尚不能实现脓毒症(特别是脓毒性休克)的早期诊断和个体化治疗[2]。因此,急需能够反映脓毒症早期发生、进展及预测其预后的生物标志物。血清微小RNA(miRNAs)是一组非编码RNA,作为一种遗传物质,其在细胞间的通讯中起着至关重要的作用[3]。既往有研究探讨脓毒症患者miRNAs差异化表达谱,并对其潜在作用进行研究[4-5]。然而,miRNAs参与脓毒症发病机制的研究还有待进一步深入。本研究采用高通量测序技术对脓毒症患者的血清miRNAs进行分析,筛选得到差异性表达miRNAs,以期为脓毒症严重程度及预后的早期评估寻找新的生物标志物,为脓毒症的定制治疗提供帮助。现报道如下。
1 对象与方法
1.1 研究对象 选取自2018年9月至2021年1月海口市人民医院收治的63例脓毒症、30例脓毒性休克住院患者为研究对象。脓毒症或脓毒性休克的诊断依据为《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[6]。纳入标准:(1)序贯器官功能衰竭评估(sequential organ failure assessment,SOFA)评分(脓毒症相关)≥2分;(2)确诊脓毒症后进行充分的容量复苏和血管收缩药物持续升压,动脉血压≥65 mmHg(1 mmHg=0.133 kPa);(3)血清乳酸水平>2 mmol/L。排除标准:(1)年龄<18周岁;(2)因其他非感染性因素引致多器官功能障碍;(3)因激素类或免疫抑制剂治疗而出现自体免疫性疾病;(4)合并其他影响凝血功能的疾病或恶性肿瘤;(5)合并其他可能影响本研究结果的疾病。另外,从我院健康体检中心随机抽取30例健康志愿者作为健康组。健康组男性18例,女性12例;年龄(69.50±13.91)岁。脓毒症组男性62例,女性31例;年龄(70.80±15.71)岁。本研究经医院伦理委员会批准,受试者或家属均签署知情同意书。
1.2 研究方法
1.2.1 血液样本采集 使用EDTAK采血管采集3.0 ml外周静脉血样本。全血4℃下储存。样品在3 000 r/min、4 ℃下离心10 min,取上清液置于1.5 ml无酶离心管中,然后进一步在13 000 r/min离心2 min,取上清液置于1.5 ml底部锥形离心管中,去除沉淀物,样品保存在-80℃中进行后续实验。
1.2.2 应用高通量测序技术检测血清miRNAs差异表达 用Trizol试剂随机从3例脓毒症患者和3例健康人的血清上清样本中提取总RNA,用凝胶电泳分离DNA片段,将5′端和3′端的RNAadaptor连接到纯化小RNA的上,用于反转录和聚合酶链式反应(polymerase chain reaction,PCR)扩增,用琼脂糖凝胶电泳回收纯化片段(约140 bp),在Agilent 2100生物分析仪上进行核酸样品质量控制。采用高通量测序确定表达变化超过2倍的miRNAs作为预测miRNA靶基因和功能富集分析的候选基因。
1.2.3 检测miR-98表达水平 使用QIAamp RNA血液试剂盒(德国Qiagen公司)从血清样本中提取总RNA。用蛋白质/核酸定量器测定RNA原液浓度,保存在-80℃中进行后续实验。互补DNA(complementary DNA,cDNA)是由Taqman®MicroRNA反转录试剂盒(美国Applied Biosystems公司)合成的。采用ABI7500荧光定量PCR系统进行cDNA扩增的实时荧光定量PCR反应。所有的样本一式三份。以miRNA cel-miR-39(5′-UCACCGGGUGUAAAUCAGCUUG)作为合成的内参对照,将血清miR-98表达水平归一化为cel miR-39表达,并用2-ΔΔCt法测定。miR-98正向引物:5′-ATCCAGTGCGTGTCGTG-3′;miR-98反向引物:5′-TGCTTGAGGTAGTAAGTTG-3′。
1.2.4 酶联免疫吸附法检测血清可溶性自杀相关因子及其配体水平 采用商用酶联免疫吸附试剂盒(中国武汉Cusabio Biotech公司,CSB-E04542h,CSB-E04544h)测定人血清中可溶性自杀相关因子(soluble factor associated suicide,sFas)及其配体(soluble Fas ligand,sFasL)浓度。
2 结果
2.1 高通量测序技术检测血清中miRNAs的差异性表达谱 采用高通量测序技术检测脓毒症患者和健康人的血清miRNA表达,共有73个差异性表达miRNAs(图1)。与健康组相比,脓毒症组有35个miRNA显著上调,38个miRNA显著下调,差异有统计学意义(P<0.05)。其中,miR-98在脓毒症患者血清样本中的表达至少比健康组降低2.3倍。因此,miR-98被筛选为候选基因。
2.2 检测各组临床血清样本中miR-98相对表达量 选择高通量测序中筛选差异表达2倍以上的miR-98作为候选因子,经实时荧光定量PCR扩增,健康组、脓毒症组患者血清样本中miR-98相对表达量分别为1.009(0.843,1.130)和0.526(0.426,0.722),两组比较,差异有统计学意义(P<0.05)。此外,脓毒性休克者血清miR-98相对表达量为0.406(0.356,0.458),低于脓毒症患者的0.647(0.493,0.912),差异有统计学意义(P<0.05)。
2.3 血清样本中miR-98相对表达量与脓毒症患者临床特征的关系 以血清miR-98相对表达量中位值0.526为分界线,将脓毒症患者分为miR-98低表达亚组(n=47)和高表达亚组(n=46)。miR-98低表达亚组的血小板(blood platelet,PLT)计数、血清白蛋白(albumin,ALB)、胆碱酯酶(cholinesterase,CHE)水平显著低于miR-98高表达亚组;与miR-98高表达亚组比较,天冬氨酸氨基转移酶(aspartic transaminase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)、尿素氮(urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、心肌肌钙蛋白Ⅰ(Cardiac troponin,cTnⅠ)、氨基末端脑钠肽前体(Amino-terminal pro-brain natriuretic peptide,NT-proBNP)、D-二聚体、C反应蛋白(C-reactive protein,CRP)和降钙素原(procalcitonin,PCT)水平明显升高,且凝血酶原时间(prothrombin time,PT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长,差异均有统计学意义(P<0.05)。见表1。
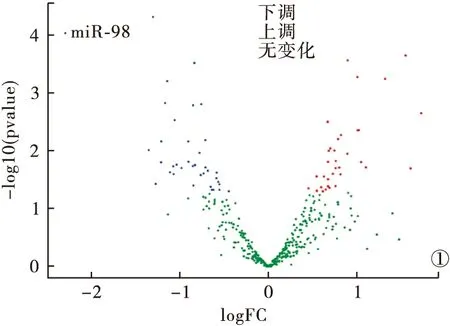
图1 高通量测序技术检测脓毒症患者和健康者血清miRNAs差异性表达火山图

表1 血清样本中miR-98相对表达量与脓毒症患者临床特征的关系
2.4 脓毒症患者血清样本中miR-98相对表达量与sFas、sFasL水平的关系 miR-98低表达亚组患者血清sFas 为(1 462.82±367.36)pg/ml,高于miR-98高表达亚组的(922.39±365.99)pg/ml;sFasL为(94.02±33.06)pg/ml,高于miR-98高表达亚组的(59.88±30.04)pg/ml,差异有统计学意义(P<0.05)。经Pearson相关系数分析,血清miR-98相对表达量与血清sFas、sFasL水平均呈负相关性(r=-0.722,r=-0.553,P<0.001)。见图2。
2.5 脓毒症患者血清样本中miR-98相对表达量与急性生理与慢性健康评分Ⅱ、SOFA评分的关系 miR-98低表达亚组患者SOFA评分为(10.23±3.59)分,高于miR-98高表达亚组的(6.28±2.43)分;急性生理与慢性健康评分Ⅱ(acute physicology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分为(24.17±5.56)分,高于miR-98高表达亚组的(15.63±3.52)分,差异有统计学意义(P<0.05)。经Spearman相关系数分析,血清miR-98相对表达量与SOFA评分、APACHE Ⅱ评分均呈负相关性(r=-0.631,r=-0.594,P<0.001)。见图3。

图2 脓毒症患者血清样本中miR-98相对表达量与血清sFas、sFasL水平的相关性

图3 脓毒症患者血清样本中miR-98相对表达量与SOFA评分、APACHE Ⅱ评分的相关性
2.6 30 d内病死组与存活组血清样本中miR-98相对表达量、sFas、sFasL水平 miR-98低表达亚组患者30 d病死率为31.9%(15/47),低于miR-98高表达亚组的10.9%(5/46),差异有统计学意义(P<0.05)。此外,病死组患者血清sFas、sFasL水平显著高于存活组,差异有统计学意义(P<0.05)。见表3。

表3 30 d内病死组与存活组患者血清miR-98相对表达量、sFas、sFasL水平
3 讨论
脓毒症患者的住院病死率约为10%,而脓毒性休克患者的住院病死率甚至可超过40%[7]。因此,准确评估脓毒症患者的严重程度和预后,对于个体化临床治疗十分重要。目前,血清学检查、SOFA评分和 APACHE Ⅱ评分是评估脓毒症发病原因和预后的常用临床指标,但由于脓毒症的发病机制错综复杂,上述指标尚不能准确、直观地反映脓毒症的临床特征[8-9]。miRNAs作为重要的基因表达调控分子,可以在多种组织和体液中检测到,在各种疾病的发病机制和病理生理过程中起着重要作用[4-5,10]。且循环miRNAs易获得且结构相对稳定,这为从miRNAs水平研究多种疾病发病机制以及寻找可靠的生物学分子提供新的线索。
有研究表明,miRNAs参与脓毒症炎症反应和细胞凋亡过程,并可针对性地调节炎症相关信号通路[11]。本研究采用高通量测序技术检测脓毒症患者和健康者血清miRNAs差异性表达谱,发现miR-98在脓毒症患者血清样本中的表达至少比健康组降低2.3倍。随后利用实时荧光定量PCR法进行验证,结果证实,脓毒症患者血清miR-98表达下调,且脓毒性休克患者血清miR-98表达下调更明显。miR-98参与30%~90%的人类基因调控以及相关的病理过程[12]。有研究表明,miR-98与某些情况下的炎症细胞因子有关。Zhang等[13]研究报道,miR-98在心肌炎患者外周血中表达下调,且心肌细胞miR-98表达的抑制/易化可调节心肌细胞凋亡,进而诱导心肌损伤。而在本研究中,脓毒症患者血清miR-98相对表达量与血清sFas、sFasL水平均呈负相关性,说明Fas是miR-98的潜在靶标,miR-98表达升高可以降低Fas诱导细胞凋亡的敏感性,这与Wang等[14]研究结论一致。
细胞凋亡是败血症和多器官功能障碍的主要病理学基础[15]。FasL是与其主要受体Fas结合时激活凋亡外源途径的主要配体之一,通过激活caspase-8可产生死亡信号,并进一步激活caspase-3凋亡途径,诱导细胞凋亡损伤[16]。此外,Fas/FasL途径也会启动坏死性细胞程序性死亡,这是一种不依赖于caspases途径,而是通过受体相互作用蛋白激酶调控的细胞死亡途径。巨噬细胞和/或淋巴细胞的活化过程本身就需要对外来病原体产生有效的炎症和/或适应性免疫反应。对于大多数细胞来说,这些过程参与细胞自身的死亡过程。而Fas-FasL介导的淋巴细胞自杀则是炎症或局部组织损伤过程的重要机制,Fas/FasL系统平衡也被认为是有助于维持肾、胰腺、肺等不同器官免疫功能正常的分子基础[17]。有研究表明,FasL-/-动物模型或通过服用Fas-受体融合蛋白FasFP竞争性抑制剂的动物模型,可明显降低脓毒症相关的死亡风险[18]。因此,笔者认为,Fas/FasL信号激活可诱导体内/体外细胞凋亡增加。本研究通过分析血清miR-98表达水平与患者临床特征的关系发现,miR-98低表达与肝、肾、心及凝血功能指标异常有关。APACHE Ⅱ评分和SOFA评分已广泛应用于评估脓毒症的严重程度和预后。然而,这两项指标都涵盖多个项目,在早期评估败血症的严重程度和预后方面价值有限。本研究血清miR-98表达与APACHE Ⅱ评分、SOFA评分都呈一定的负相关性,说明miR-98在一定程度上反映疾病进展,可作为败血症严重程度的预测指标。
综上所述,血清miR-98检测有助于准确地反映脓毒症患者的临床特征,并有望成为评估脓毒症严重程度和预后的潜在生物标志物,其作用机制之一与调控Fas/FasL细胞凋亡通路有关。

