晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素及HER2基因状态的影响
尚娜娜,刘志,董雪茹,王鹏远
(河南科技大学附属许昌市中心医院 肿瘤科,河南 许昌 461000)
世界卫生组织全球肿瘤报道显示肺癌在恶性肿瘤中发病率和死亡率均居于首位,每年新发病例超过180 万,且以非小细胞肺癌(non-small cell lung cancer,NSCLC)最为常见[1]。肺腺癌是NSCLC 主要病理学亚型之一,首次确诊时进入晚期比例较高,丧失手术根治切除机会,仅能通过化疗或靶向药物治疗控制病情进展[2]。作为HER蛋白家族成员之一,HER2 蛋白表达异常主要类型包括激酶结构突变、蛋白过表达及基因拷贝数增加,尤以激酶结构域突变最为多见[3];而对于HER2 基因状态与肺腺癌患者临床疗效及生存获益间关系仍存在争议[4]。本次研究回顾性分析河南科技大学附属许昌市中心医院2015 年1 月至2019年12 月收治接受者一线标准化疗晚期初治肺腺癌患者共212 例临床资料,旨在探讨晚期初治肺腺癌患者一线标准化疗预后影响因素及与HER2 基因状态关系,现报道如下。
1 资料与方法
1.1 研究对象
研究纳入河南科技大学附属许昌市中心医院2015 年1 月至2019 年12 月收治接受含铂联合化疗期初治肺腺癌患者共424 例。纳入标准:①经穿刺病理组织学检查确诊肺腺癌;②TNM 分期为IV 期;③分子病理学检测结果显示EGFR/ALK/肉瘤致癌因子1 受体酪氨酸激酶(ROS1)/KRAS/BRAF/转导重排基因(RET)/间质上皮转化因子(MET)均为阴性;④年龄≥18 岁;⑤存在可评估病灶;⑥首次治疗;⑦采用培美曲塞+铂类方案。排除标准:①同步/序贯放疗;②接受其他抗肿瘤治疗;③HER2 基因状态不明确;④无法耐受化疗或中断化疗;⑤合并其他类型恶性肿瘤。研究设计符合《赫尔辛基宣言》要求,且患者及家属签署知情同意书。
1.2 化疗方案
培美曲塞500 mg/m2静脉滴注,第1 天;顺铂(75 mg/m2)/卡铂[AUC5×(GFR+25)mg]/奈达铂175 mg/m2静脉滴注,第1 天;每3 周为1 个疗程;未出现疾病进展者可给予培美曲塞维持,500 mg/m2静脉滴注,第1 天,每4 周为1 个疗程直至疾病进展。
1.3 基因检测
基因检测均外送金域完成,采用Sanger 法或NGS,检测指标包括 EGFR、ALK、ROS-1、KRAS、BRAF、RET、MET 及HER2。
1.4 观察指标
查阅病例记录人口学资料、既往吸烟、寡转移、远处转移、基因检测及治疗方案;其中寡转移指治疗前转移灶数≤5 个。化疗2 个周期后完成疗效评估,参考RECIST 1.1 标准[5],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)4 级,客观缓解率(ORR)=[(CR例数+PR 例数)/总例数]×100.00%;疾病控制率(DCR)=[(CR 例数+PR 例数+SD 例数)/总例数]×100.00%。随访采用电话或门诊/住院病历查阅,随访截止时间为2020 年9 月,随访终点为疾病进展;无进展生存期(PFS)指治疗开始至疾病进展、死亡或失访的时间[5]。
1.5 统计学方法
选择SPSS 20.0 软件处理数据。正态性评估采用Kolmogorov-Smirnov 检验,符合正态分布计量资料以均数±标准差(±s)表示,比较采用t检验;不符合正态分布计量资料以[M(Q1,Q3)]表示,比较采用Mann-WhitneyU检验;计数资料以百分率(%)表示,比较采用χ2检验或Fisher确切概率法;多因素分析采用Cox 比例风险回归模型;生存分析采用Kaplan-Meier 法和log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料、化疗情况及近期疗效分析
424 例患者中男252 例,女172 例,中位年龄57.0(32.0~75.0)岁,根据HER2 基因状态划分,突变型12 例,野生型412 例;接受含铂联合化疗中位周期数为6.0(2.0~14.0)个,其中给予培美曲塞维持140 例,中位维持化疗周期数为5.0(2.0~8.0)个。治疗后达PR、SD 及PD 例数分别为96 例,228 例,100 例,ORR 和DCR 分别为22.64%(96/424),71.70%(324/424)。
2.2 HER2 基因状态与临床特征关系分析
HER2 基因状态与晚期初治肺腺癌患者年龄、性别及既往吸烟情况有关,差异有统计学意义(P<0.05)。见表1。
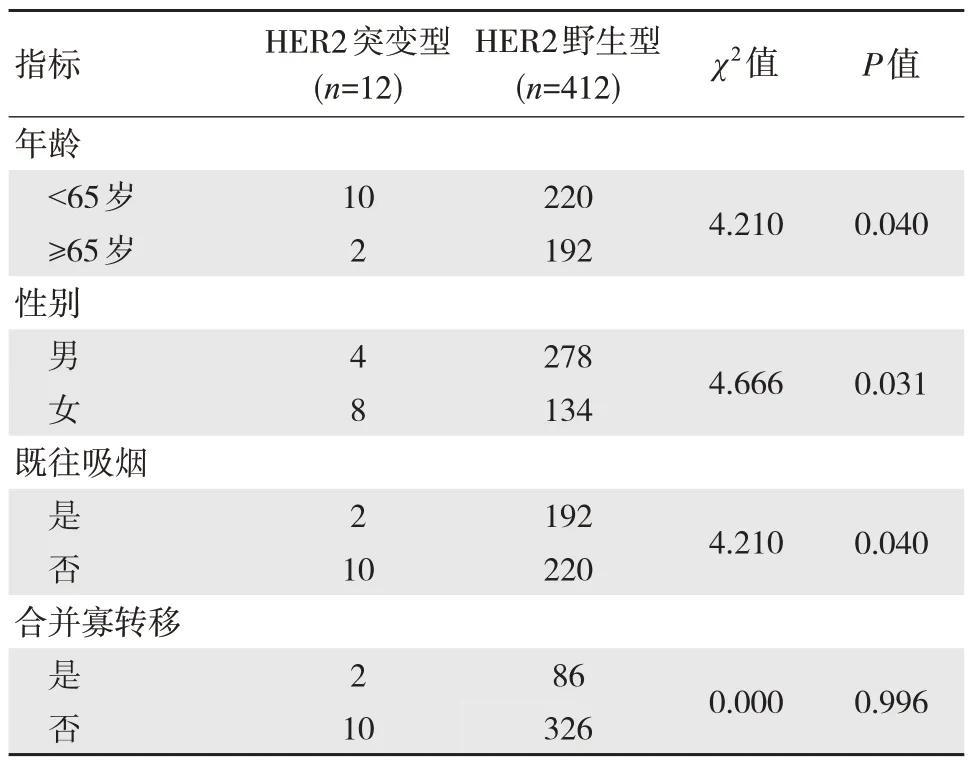
表1 HER 基因状态与临床特征指标相关性分析(例)
2.3 HER 基因状态对临床疗效的影响
HER2 突变组接受含铂联合化疗后ORR 和DCR 均显著高于HER2 野生组,差异有统计学意义(P<0.05)。见表2。

表2 HER 基因状态对临床疗效的影响 [n(%)]
2.4 晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素单因素分析
单因素分析结果显示,合并脑转移、给予维持化疗及HER2 基因型与晚期初治肺腺癌患者接受含铂联合化疗后生存获益有关,差异有统计学意义(P<0.05)。见表3。
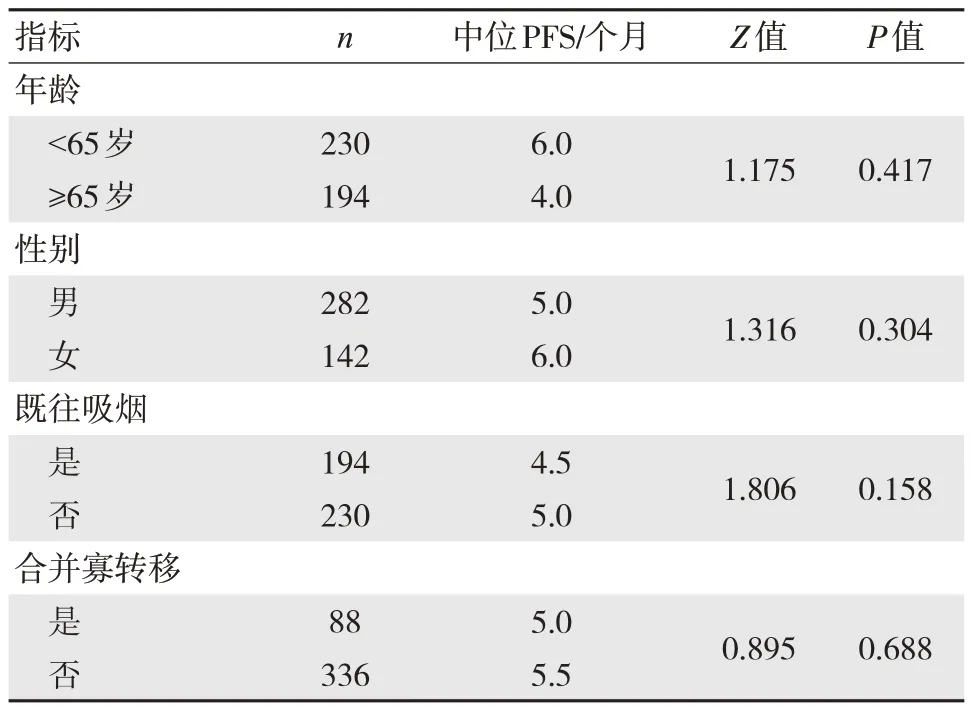
表3 晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素单因素分析

续表3 晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素单因素分析
2.5 晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素多因素分析
Cox 比例风险回归模型多因素分析结果证实,存在HER2 基因突变是晚期初治肺腺癌患者接受含铂联合化疗后PFS 独立危险因素(P<0.05)。见表4。
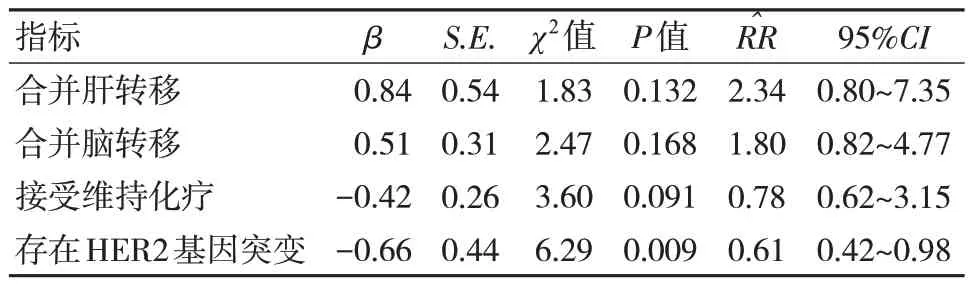
表4 晚期初治肺腺癌患者接受含铂联合化疗后生存获益影响因素多因素分析
3 讨论
NSCLC 患者中HER2 突变发生率较大,目前国内外报道一般从1% 至5% 不等,其中EGFR(-)/ALK(-)/KRAS(-)人群中这一比例更高(6%~8%)[6]。目前报道证实NSCLC 患者中HER2突变多为20 号外显子插入,主要通过影响P13K-AKT/MEK-ERK 通路活化,加快细胞克隆性增殖[7]。本研究纳入晚期肺腺癌患者424 例,其中检测到HER2 突变共128 例(30.19%),而其他驱动基因均为阴性;结果显示HER2 基因状态与晚期初治肺腺癌患者年龄、性别及既往吸烟情况有关,表明存在HER2 突变晚期肺腺癌患者具有一定临床特征,多见于年轻、不吸烟女性人群,与国外报道相符[8]。
HER2 突变近年来被当做NSCLC 患者潜在治疗靶点获得医学界大量关注,但目前仍缺乏疗效确切靶向药物[9]。NCCN 指南曾经推荐阿法替尼和曲妥珠单抗作为HER2 突变NSCLC 可选靶向药物,但后续研究缓解率不尽如人意,而拉帕替尼和达克替尼疗效亦欠佳[10]。有报道显示T-DM1 和Poziotinib 用于HER2 突变晚期NSCLC 患者治疗效果确切,ORR 可达44%~54%,中位PFS 接近6 个月[11-12];但以上两种药物在国内均未获批用于NSCLC 治疗,而II 期研究结果能否证实相较于化疗具有优势亦存在争议,故在临床实践中,HER2突变晚期肺腺癌一线治疗仍首选培美曲塞+铂类联合化疗[13]。
相关研究证实NSCLC 患者HER2 基因过表达与化疗原发耐药关系密切;同时肺腺癌患者培美曲塞继发耐药受HER2 表达上调影响明显,这主要与DNA 修复增强、细胞增殖激活及抗凋亡等有关[14];但存在HER2 突变是否可直接影响培美曲塞化疗效果仍不明确。有学者报道伴HER2 突变晚期肺腺癌患者采用包含培美曲塞化疗方案缓解持续时间超过9 个月[15];但亦有研究采用培美曲塞+铂类联合化疗治疗晚期初治肺腺癌患者,其中HER2 突变亚组中位PFS 仅为4.0 个月,远低于EGFR 和ALK 突变亚组[16]。本研究排除无法耐受化疗或要求停止化疗患者后进行疗效评估,结果显示HER2 突变亚组ORR、DCR 及中位PFS 分别为41.67%,91.67%,8.0 个月,整体疗效优于上述报道,造成这一差异可能原因为:本次研究无培美曲塞单药化疗病例且接受维持化疗比例高有关。
本研究Cox 比例风险回归模型多因素分析结果证实,存在HER2 基因突变是晚期初治肺腺癌患者接受含铂联合化疗后PFS 独立危险因素,说明晚期初治肺腺癌患者如存在HER2 基因突变接受一线联合化疗后生存获益更佳。本研究中生存获益评估仅纳入PFS 这一指标,而未分析OS 指标,这主要考虑纳入患者二线及更后线治疗方案差异较大,OS 评估混杂因素较多。此外因本研究属于单中心回顾性分析,结论无法避免偏倚,故仍需后续随机对照及长随访研究进一步证实。
综上所述,晚期初治肺腺癌患者接受含铂联合化疗后生存获益与HER2 基因突变独立相关,HER2 突变型人群接受含铂联合化疗PFS 更长。

