花椰菜高效CRISPR/Cas9基因编辑技术体系的构建
杨迎霞 葛贤宏 孙德岭 金庆东 陆国清 姚星伟

摘 要:CRISPR/Cas9基因编辑技术已经在许多农作物上成功应用,实现了许多重要农艺性状的精准改良。本研究参考甘蓝型油菜(Brassica napus L.)遗传转化体系,以花椰菜(Brassica oleracea L.var .botrytis)育种材料‘FQ-36为受体,以花青素合成关键基因BoANS为目标基因,构建CRISPR/Cas9表达载体,建立了农杆菌介导的花椰菜基因编辑技术体系,并获得22株再生植株,经PCR检测发现13株为转基因阳性株,转化效率为59.09%。与野生型相比,3株阳性株花球表面紫色呈现不同程度的消退,初步说明BoANS被成功编辑。花椰菜CRISPR/Cas9基因编辑技术体系的建立对后续开展基因功能研究和目标性状精准改良具有重要意义。目前该技术体系正在应用到花椰菜优异资源的创制中。
关键词:花椰菜;甘蓝型油菜;CRISPR/Cas9;基因编辑
中图分类号:S565.4 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2022.04.002
Construction of Efficient CRISPR/Cas9 Genome Editing Technology System in Cauliflower
YANG Yingxia1, GE Xianhong2, SUN Deling1,3, JIN Qingdong2, LU Guoqing1, YAO Xingwei1,3
(1.Tianjin Academy of Agricultural Sciences, Tianjin 300384, China; 2.College of Plant Science and Technology, Huazhong Agricultural University, Wuhan, Hubei 430070,China; 3.Tianjin Key Laboratory of Vegetable Genetics and Breeding, The State Key Laboratory of Vegetable Germplasm Innovation, Tianjin 300384,China)
Abstract: CRISPR / Cas9 gene editing technology has been successfully applied in many cropsand achieved the accurate improvement of important agronomic traits. Referred to the genetic transformation system of Brassica napus L., the CRISPR/Cas9 expression vector was constructed of key anthocyanin biosynthesis gene BoANS and introduced intothe breeding material'FQ-36' of Brassica oleracea L. var. botrytis. The Agrobacterium mediated gene editing technology system in cauliflower was established. As a result, 22 regenerated plants were obtained and 13 (59.09%)positive strains were obtained by PCR detection.Particularly,the purple color on the curd surface of the three plants faded in varying degrees compared to the wild type. The established CRISPR / Cas9 gene editing technology system in cauliflower will be of great significance for subsequent gene function research and accurate genetic improvement.The genome editing technology system in cauliflower is been applying successfully to create cauliflower wonderful breeding materials.
Key words: cauliflower; Brassica napus; CRISPR/Cas9; genome editing
花椰菜(Brassica oleracea L.var .botrytis)又名花菜、菜花,屬于十字花科芸薹属甘蓝种的一个变种,其味道鲜美、口感甜脆、营养丰富,同时具有抗癌防癌保健功能,深受广大消费者喜爱。我国花椰菜栽培面积和产量均位列世界第一,2019年我国花椰菜(包括青花菜)种植面积达5.467×105 hm2,约占世界总面积40%;产量达1.071×1010 kg,占世界总产量的40.67%[1],花椰菜在我国蔬菜生产中占有重要地位。
我国花椰菜分子育种研究虽然起步较晚,但是花椰菜全基因组序列图谱的公布和释放[2-3],极大地推动了花椰菜基因功能研究及生物育种技术的发展,对定位花椰菜重要农艺性状,揭示花球发育机制以及开展高效、精准分子聚合育种有着里程碑式的作用。建立高效、成熟的遗传转化体系是所有作物开展生物学研究的基础,特别是近年来基因编辑技术在许多农作物上的成功应用,实现了大量重要农艺性状精准改良,构建高效、成熟的植物遗传转化技术体系显得尤为重要。
目前,基于农杆菌介导的CRISPR/Cas9技术体系已经成功应用于水稻、玉米、大豆等农作物[4]。在甘蓝类蔬菜作物功能基因的研究过程中,研究者已利用CRISPR/Cas9基因编辑技术获得早花、雄性不育、无叶片蜡质层等具备优良性状的育种材料[5-7],此方法可快速地将优异基因变异向育种材料中累积,为高产、优质、多抗新品种的培育提供了新的技术储备[8]。然而目前该技术在花椰菜上的应用尚未见报道。
本研究参照甘蓝型油菜遗传转化体系[9],以花椰菜‘FQ-36为受体材料,以花青素合成途径中的关键功能基因BoANS为靶标基因,构建CRISPR/Cas9基因编辑载体,通过农杆菌介导的遗传转化体系进行靶向编辑,拟构建花椰菜高效CRISPR/Cas9基因编辑技术体系,整合花椰菜基因编辑技术、全基因组生物信息数据库和种质资源表型数据库,对搭建4.0版本花椰菜分子设计育种平台具有极大的推动作用。
1 材料和方法
1.1 试验材料
花椰菜育种材料‘FQ-36,由天津市农业科学院蔬菜研究所提供。该品系秋季栽培成熟期130 d,株型直立上冲紧凑,波浪型叶片,叶色深绿色,花球周正紧实、细嫩、平整,不抗黑腐病和霜霉病,遇低温、高温、强光等逆境胁迫花球表面易呈现着色不均的紫色。
1.2 载体
过渡载体(pCBC-DT1T2)和植物表达载体(35S-pKSE401)菌株由华中农业大学作物遗传改良国家重点实验室戴成老师提供。大肠杆菌为DH5α感受态细胞。根癌农杆菌(Agrobacterium tumefaciens)为GV3101感受态细胞。
1.3 sgRNA设计与CRISPR/Cas9载体构建
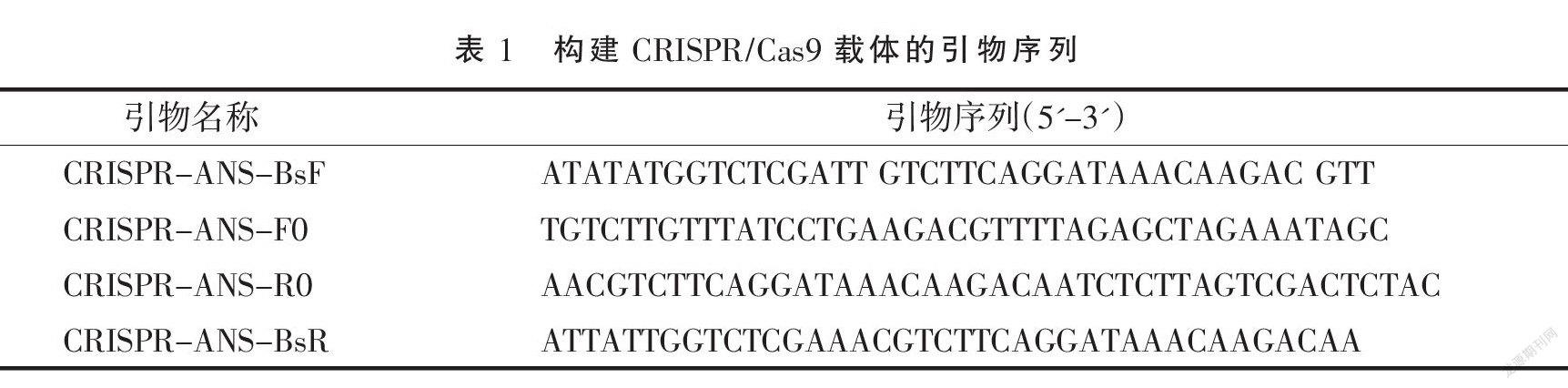
利用CRISPR-PV2.0在线软件(http://crispr.hzau.edu.cn/CRISPR2/)对BoANS基因(Bol014986)序列进行靶位点分析。靶位点选择标准:(1)位于基因外显子上;(2)GC含量不低于40%;(3)靠近基因编码区5端;(4)特异性好、脱靶效应低[10]。
CRISPR载体构建具体方法步骤详见参考文献[11]。以pCBC -DT1T2 为模板进行引物 PCR 扩增,得到含两个靶点(DT1 和 DT2)序列的gRNA表达盒,柱式DNA片段纯化试剂盒纯化后,用BsaI酶切PCR纯化产物和pKSE401并用T4DNA ligase 连接,得到最终载体。载体于-80 ℃下储存备用。
1.4 农杆菌介导的花椰菜遗传转化
农杆菌介导的花椰菜遗传转化体系以及使用的培养基配方主要参考甘蓝型油菜遗传转化方法[9],具体如下:切取0.8~1 cm左右的下胚轴作为外植体,用含有重组质粒的农杆菌菌液(OD=0.5)侵染外植体30 min,转入M1培养基上在25 ℃、黑暗条件下共培养2~3 d,再转入含卡那霉素的愈伤组织诱导M2培养基上,在26/22 ℃、16 h 光照/8 h 黑暗条件下继续培养21 d,然后将外植体转入芽分化M3培养基上,在26/22 ℃、16 h 光照/8 h 黑暗条件下继续培养14 d,最后切取幼芽,转入M4生根培养基,温度为26/22 ℃、光照条件为16 h 光照/8 h 黑暗。生根后移入基质,培养室内炼苗,移栽至大田继续培养,收获种子。
1.5 CRISPR/Cas9编辑植株的分子检测与表型鉴定
采用改良的CTAB法提取待检测植株的基因组DNA。经琼脂糖凝胶电泳和NanoDrop ND-1000检测,DNA浓度调至100 ng·μL-1备用。以其为模板,使用载体特异性引物U626-IDF 、U629-IDR(U626-IDF:TGTCCCAGGATTAGAATGATTAGGC;U629-IDR:AGCCCTCTTCTTTCGATCCATCAAC)进行PCR扩增。反应体系为:Premix Taq(KaRaTaqTM Version 2.0)5 μL、DNA模板1 μL(20 ng)、上下游引物各0.2 μL(0.2 μM)、ddH2O 3.6 μL。PCR反应程序为:95 ℃预变性4 min;95 ℃10 s,61 ℃15 s,72 ℃1 min,35个循环;72 ℃延伸7 min。扩增产物由1%浓度的琼脂糖凝胶电泳检测,并计算转化效率(转化效率=转基因阳性株数/总成株数)。对基因编辑阳性植株的表型进行观察和记录。
2 结果与分析
2.1 靶位点设计及载体构建
根据在线软件CRISPR-PV2.0分析结果,基于靶位点選择标准,在BoANS基因上选取了2个靶位点,即5'-GTCTTGTTTATCCTGAAGAC-3',5'-GTCTTCAGGATAAACAAGAC-3'。并在此基础上设计了用于CRISPR/Cas9载体构建的引物序列(表1)。
使用CRISPR-ANS-BsF、CRISPR-ANS-F0,CRISPR-ANS-R0、CRISPR-ANS-BsR 4对引物对过渡载体pCBC-DT1T2进行扩增,电泳检测并回收纯化。纯化后的质粒通过边酶切边连接方法连接到pKSE401载体上,成功获得pKSE401-sgRNA重组质粒。
2.2 农杆菌介导的花椰菜遗传转化技术体系的建立
参照甘蓝型油菜遗传转化技术体系,经过60 d左右的培养,获得了花椰菜遗传转化再生植株(图1)。
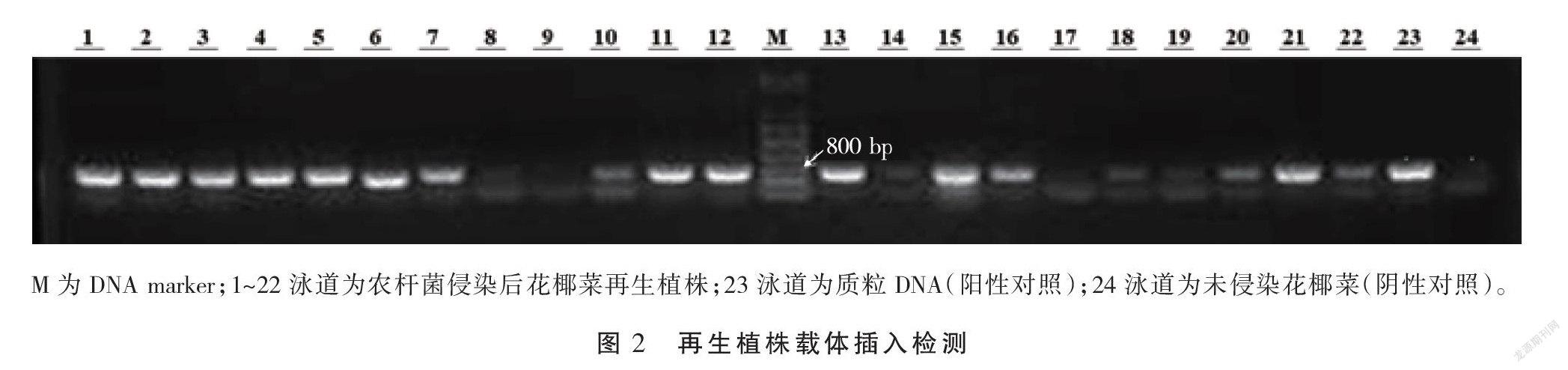
2.3 花椰菜再生植株的载体插入阳性检测
将生根的幼苗移栽到华中农业大学油菜工程中心转基因基地,共移栽24株,其中22株成活。对成活的再生植株收集幼嫩叶片提取DNA,利用U26启动子引物对这些植株进行PCR检测,琼脂糖凝胶电泳检测发现13株阳性株,对应泳道分别为1、2、3、4、5、6、7、11、12、13、15、16、21,这13株阳性株都扩增出726 bp的特异性条带(图2),与阳性对照(重组质粒)的扩增结果一致,由此初步判断这些为阳性转化植株,转化效率为59.09%。
2.4 轉基因花椰菜植株的田间表型鉴定
田间调查发现,13株转基因阳性植株均能正常结球,与野生型(图3-A)相比,有3株阳性植株花球紫色明显减弱,尤其是编号21号阳性株(图3-B)紫色减退非常明显,初步说明这些植株BoANS基因发生了突变。遗憾的是,由于武汉新冠疫情的暴发没有对这些植株的编辑位点进行检测,也没能从这些植株上收获种子。
3 结论与讨论
目前基于CRISPR/Cas9的基因编辑技术已经在多种植物中成功应用,建立高效、成熟的遗传转化体系对植物开展关键基因功能解析以及精准分子设计育种至关重要。芸薹属作物中结球甘蓝、芥蓝已经建立了成熟的遗传转化体系并实现了资源改良创制[12-13],花椰菜是遗传转化体系比较成熟,遗传转化效率相对较高的芸薹属作物[14-15],但目前还未见花椰菜基因编辑技术方面的相关报道。
ζ-胡萝卜素脱氢酶(ζ-carotene desaturase,ZDS)是植物类胡萝卜素生物合成途径的关键酶,当编码ZDS的基因沉默后,植物新生叶片将出现明显白化现象。郑爱红等[16]巧妙地把芥蓝BoZDS作为目标基因,以再生植株白化表型标记和Sanger测序检验编辑体系突变效率,成功构建了芥蓝CRISPR/Cas9基因编辑技术体系,转化效率达68.42%,本研究筛选的试验受体材料以及选择的目标基因与郑爱红试验设计有相似之处。本试验材料为‘FQ-36,前期预试验表明其再生率显著高于其它花椰菜品系,是非常理想的遗传转化受体材料,此外该材料极易受环境影响,当遇到高温、低温、强光照等逆境胁迫花球极易变紫,因此花球是否变紫可作为验证基因编辑体系的表型标记。花青素合成酶(ANS,anthocyanin synthase)是植物花青素合成的关键酶,催化花青素生物合成的倒数第2步,使无色花色素转变成有色花色素。ANS基因变异和表达量差异使植物呈现紫色、红色、粉色、黄色、白色等颜色,并且已经在覆盆子、石榴、草莓等多种植物中证明ANS基因突变是导致植物组织变成白色的重要原因[17-19 ]。前期试验通过代谢组和转录组数据分析,验证了ANS等是调控低温花球变紫的关键基因[20],本试验以BoANS为目标基因对CRISPR/Cas9技术在花椰菜上的应用进行了初步探索,并成功构建了花椰菜基因编辑技术体系,转化效率达59.09%。
天津市农业科学院与华中农业大学通过项目合作,将甘蓝型油菜遗传转化体系成功应用于花椰菜中[9],建立了花椰菜基因编辑遗传转化技术体系,并已经成功应用于花椰菜优异资源的创制中。
参考文献:
[1] Cultivation area and yield data of cauliflower in China.2019[DB/OL].[2022-01-09].https://www.fao.org/faostat/en/#data/QCL .
[2] SUND, WANGC, ZHANG X, et al. Draft genome sequence of cauliflower(Brassica oleracea L.var.botrytis)provides new insights into the C genome in Brassica species[J]. Horticulture Research, 2019, 6: 82.
[3] GUO N, WANG S, GAO L, et al. Genome sequencing sheds light on the contribution of structural variants to Brassica oleracea diversification[J]. BMC Biology, 2021, 19(1): 93.
[4] ZHU H, LI C, GAO C. Applications of CRISPR-Cas in agriculture and plant biotechnology[J]. Nature Reviews Molecular Cell Biology, 2020, 21(11): 661-677.
[5] MUROVEC J, GUCEK K, BOHANEC B, et al. DNA-Free genome editing of brassica oleracea and B. rapa protoplasts using CRISPR-Cas9 ribonucleoprotein complexes[J]. Frontiers in Plant Science, 2018, 9: 1594.
[6] MA C, LIU M, LI Q, et al. Efficient BoPDS geneediting in cabbage by the CRISPR/Cas9 System[J]. The Horticulture Journal, 2019, 5(4): 164-169.
[7] CAO W, DONG X, JI J, et al. BoCER1 is essential for the synthesis of cuticular wax in cabbage(Brassica oleracea L.var.capitata)[J]. Scientia Horticulturae, 2021, 277: 109801.
[8] LYZENGA W J, POZNIAK C J, KAGALE S. Advanced domestication: harnessing the precision of gene editing in crop breeding[J]. Plant Biotechnology Journal, 2021, 19(4): 660-670.
[9] DAI C, LI Y, LI L, et al. An efficient Agrobacterium-mediated transformation method using hypocotyl as explants for Brassica napus[J]. Molecular Breeding, 2020, 40(10): 96.
[10] LIU H, DING Y, ZHOU Y, et al. CRISPR-P 2.0: an improved CRISPR-Cas9 Tool for genome editing in plants[J]. Molecular plant, 2017, 10(3): 530-532.
[11] XING H L, DONG L, WANG Z P, et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants[J]. BMC Plant Biology, 2014, 14: 327.
[12] 崔慧琳, 李志远, 方智远, 等. 结球甘蓝自交系YL-1的高效遗传转化体系的建立及应用[J]. 园艺学报, 2019, 46(2): 345-355.
[13] LI Q, XU B, DU Y, et al. Development of ogura CMS restorers in brassica oleracea subspecies via direct Rfo(B) gene transformation[J]. TAG.Theoretical and Applied Genetics.Theoretische und Angewandte Genetik, 2021, 134(4): 1123-1132.
[14] 华学军, 陈晓邦, 范云六. BACILLUS THURINGIENSIS杀虫基因在花椰菜愈伤组织的整合与表达[J]. 中国农业科学, 1992, 25(4): 82-87.
[15] 蔡荣旗, 孙德岭, 赵前程, 等. 根瘤农杆菌介导Bt杀虫基因对花椰菜的转化初报[J]. 天津农业科学, 2000, 6(4): 9-12.
[16] 郑爱红, 张芬, 江敏, 等. 利用CRISPR/Ca9技术靶向编辑芥蓝BoaZDS[J]. 园艺学报, 2019,46(1): 57-64.
[17] RAFIQUE M Z, CARVALHO E, STRACKE R, et al. Nonsense mutation inside anthocyanidin synthase gene controls pigmentation in yellow raspberry (rubus idaeus L.)[J]. Frontiers in Plant Science, 2016, 7: 1892.
[18] ZHAO X, YUAN Z, FENG L, et al. Cloning and expression of anthocyanin biosynthetic genes in red and white pomegranate[J]. Journal of Plant Research, 2015, 128(4): 687-696.
[19] BEN-SIMHON Z, JUDEINSTEIN S, TRAININ T, et al. A “white” anthocyanin-less pomegranate (punica granatum L.) caused by an insertion in the coding region of the leucoanthocyanidin dioxygenase(LDOX; ANS) gene[J]. PLOS One, 2015, 10(11): e0142777.
[20] 郎朗, 牛國保, 单晓政, 等. 花椰菜白色花球变紫代谢物的测定及主成分分析[J]. 中国瓜菜, 2021, 34(4): 57-61.

