基于水杨酸和硫脲碳纳米点的制备及其抗炎作用研究
郑梦丹, 刘莉莉, 李娴静, 徐晓薇, 孙宏晨
(1.吉林大学口腔医院病理科, 2.牙周科,吉林 长春 130021)
炎症在疾病发生、发展中起重要作用[1],新型冠状病毒的炎症风暴未得到及时有效的控制会立刻导致机体出现多器官功能衰竭[2],甚至导致患者死亡。 炎症较严重时,由于病原微生物及其毒素的作用, 以及局部血液循环障碍、 发热等因素的影响,心、肝、肾等器官的实质细胞可发生不同程度的变性、坏死和器官功能障碍[3]。 因此,抑制过度炎症反应在调节免疫反应方面具有意义[4]。 用来抑制炎症的药物主要有抗生素、类固醇类激素、非甾体类抗炎药等[5]。 但临床应用抗生素易产生耐药性;固醇类激素用于系统性治疗容易导致皮肤、胃肠道副作用等; 非甾体抗炎药如阿司匹林存在溶解性不佳、导致消化和神经系统副反应等应用缺陷;而生物制品类如抑肽酶、抗氧化剂等成本高昂,不利于临床广泛使用。 纳米材料由于具有独特的尺寸效应,在人类生活中发挥着重要的作用。 纳米材料已逐渐被应用于各种领域,例如光电器件、机械、计算机、医学诊断等[6]。 碳纳米点(CDots)是指尺寸小于10 nm 的由碳元素作为主要成分的纳米材料,其不仅有稳定的荧光特性,良好的生物相容性,还能够进行多功能修饰,从而在肿瘤治疗中抵抗多药耐药、靶向肿瘤微环境[7]。 此外,还可通过载药和光热治疗、光声治疗等各种策略相结合发挥抗肿瘤作用[8]。 本研究以水杨酸和硫脲为原料通过化学反应合成小分子药物碳纳米点,探讨其对脂多糖(LPS)诱导的细胞炎症模型的抗炎作用,结合材料表征分析其可能机制,从而为控制炎症提供新的策略。
1 材料和方法
1.1 主要试剂
水杨酸(≥99.5%)、硫脲(99%)(上海麦克林生化科技有限公司,中国),用于封装的环氧硅树脂A和B(98%)(奥斯邦有限公司,中国)。 高糖DMEM培养液(Gibco 公司,中国),胎牛血清(Biological Industries 公司,美国)和青霉素/链霉素溶液(Hyclone公司, 美国)。 磷酸缓冲盐溶液 (phosphate buffer saline,PBS)粉(Amresco 公 司,美 国),Annexin Ⅴ-FITC/7-AAD 细胞凋亡检测试剂盒(天津三箭技术股份有限公司,中国),CCK-8 试剂盒(上海碧云天生物技术有限公司, 中国)。 小鼠肿瘤坏死因子-α(TNF-α)抗体、小鼠白细胞介素-1β(IL-1β)抗体、小鼠GAPDH 抗体、辣根过氧化物酶(horseradish peroxidase,HRP)-羊抗小鼠二抗 (Proteintech 公司,美国),胎牛血清白蛋白(bovine serum albumin,BSA)、RIPA 裂解液、蛋白酶抑制剂、磷酸酶抑制剂、蛋白上样缓冲液(5×)、十二烷基硫酸钠-聚丙烯酰胺凝脉电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配制试剂盒(上海碧云天生物技术有限公司,中国),彩色预染蛋白质分子量标准 (10 000~180 000)(Thermo Fisher Scientific公司, 美国), 聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(Bio-Rad 公司,美国),聚偏氟乙烯[poly(1,1-difluoroethylene),PVDF]膜(Millipore 公司,美国),电化学发光(electrochemiluminescence,ECL)显影液(Proteintech 公司,美国)。TRIeasyTM总RNA 提取试剂盒 (上海翊圣科技有限公 司, 中 国),PrimerScripteTMRT Reagent Kit with gDNA Eraser 试剂盒和SYBR Premix Ex Taq 试剂盒(TaKaRa 公司,中国),引物(上海Sangon Biotech 公司,中国)。渗析袋(截留分子量=1 000 D)(Spectrum Laboratories 公司,美国)。 三氯甲烷、异丙醇、乙醇等普通商用化学试剂均为分析纯。 所有实验用水通过蒸馏提纯2 次。
1.2 水杨酸/硫脲碳纳米点的合成
将1.53 g 的水杨酸和2.4 g 的硫脲添加到20 mL去离子水中,然后将混合物在家用500 W 的微波炉中加热4 min。 在该加热过程中,整体体系从原来的无色液体变成棕色液体,并最终形成亮黄色的簇状固体。 接下来,为了去除未反应的小分子,将制备好的碳纳米点用截留分子量为1 000 D 的渗析膜在去离子水中渗析1 d, 进而完全去除未反应的小分子原料(如水杨酸等)。 最后,使用含有少量无水乙醇的DMEM 培养液溶解碳纳米点,并将碳纳米点配成不同浓度的溶液,以备后续实验使用。
1.3 碳纳米点的表征
使用H-800 透射电子显微镜 (TEM,Hitachi 公司,日本)对合成碳纳米点的形态进行表征。 使用AVATAR 360 傅里叶变换红外光谱 (FTIR) 仪器(Nicolet 公司,美国)分别测试得到水杨酸、硫脲和碳纳米点的FTIR 光谱。通过ESCALAB MKII 型能谱仪(VG 公司,美国)得到碳纳米点的X 射线光电子能谱。
1.4 碳纳米点的体外毒性试验
小鼠巨噬细胞系RAW264.7(上海中国科学院细胞库,中国)培养于含有10%胎牛血清和1%青霉素/链霉素的高糖DMEM 培养液中,将细胞置于37 ℃、5% CO2恒温细胞培养箱中孵育。
通过CCK-8 试剂盒测定法测试碳纳米点的细胞毒性。 将细胞接种于96 孔板中进行细胞增殖能力测定。 将RAW264.7 细胞以1×104个/孔的密度接种,并将其培养过夜使细胞贴壁。 然后弃去原培养液, 将DMEM 培养液稀释碳纳米点至0、10、20、50、100 和200 μg/mL, 随后分别将其添加到每个孔中。孵育24 h 后,向每孔中添加10 μL CCK-8 溶液,37 ℃下温育2 h 后,使用酶标仪(型号:RT-6000;深圳雷都生命科技有限公司,中国)在450 nm 波长光激发下测量吸光度值。 细胞存活率(%)=不同浓度碳纳米点组吸光度值/空白对照组吸光度值×100%
1.5 实时荧光定量聚合酶链反应(RT-qPCR)检测炎症细胞因子TNF-α 和IL-1β 的水平
将RAW264.7 细胞以2×105个/孔的密度接种于6 孔板中,培养24 h 后设置分组:①空白对照组;②LPS 对照组(100 ng/mL);③碳纳米点组(100 ng/mL LPS,200 μg/mL 碳纳米点)。分别孵育24 h 和48 h,收集细胞,并通过TRIeasyTM总RNA 提取试剂盒提取总RNA。 使用PrimerScripteTMRT Reagent Kit with gDNA Eraser 试剂盒, 将1 μg 总RNA 样品用于每个逆转录反应。使用SYBR Premix Ex Taq 试剂通过MxPro Mx3005P 实时PCR 检测系统进行RTqPCR 以测定TNF-α、IL-1β 和ACTB 的水平 (其中ACTB 用作内部对照)。实验中具体所用引物序列见表1,具体操作按试剂说明书进行。

表1 RT-qPCR 引物序列Table 1 RT-qPCR primer sequences
1.6 Western bloting 法检测炎症细胞因子TNF-α和IL-1β 的表达
将RAW264.7 细胞以2×105个/孔的密度接种于6 孔板中,培养24 h 后去除培养液。 实验分为:①空白对照组;②LPS 对照组(100 ng/mL);③碳纳米点组(100 ng/mL LPS,200 μg/mL 碳纳米点)。 分别孵育24 h 和48 h 后, 使用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 缓冲液裂解细胞以获得细胞蛋白质。取30 μg 蛋白质提取物在SDS-PAGE 上电泳,然后将其转移到PVDF 膜上。 在室温下用5% BSA 封闭1 h,然后将其与一抗在4 ℃孵育过夜。 使用以下一抗: 抗GAPDH [10494-1-AP,1∶10 000(Proteintech)],抗TNF-α[17590-1-AP,1∶1 000(Proteintech)]和抗IL-1β[bs-0812R,1∶2 000(Bioss)]。 然后,加入二抗[17780-1-AP,1∶10 000(Proteintech)],并在室温下孵育1 h。 根据传统的实验操作流程,使用增强的化学发光试剂检测信号,进行显色观察,并通过Image J 软件分析条带灰度值对结果进行定量。
1.7 统计学分析
采用SPSS 21.0 软件进行统计学分析。 各组细胞中TNF-α 和IL-1β 的表达水平均以均数±标准差(±s)表示,2 组间样本均数采用两独立样本t 检验进行比较。 以P<0.05 为差异有统计学意义。
2 结果
2.1 TEM 结果
TEM 结果显示,镜下碳纳米点具有良好的分散性,没有发生聚集。 在高分辨率透射电镜图像中可以清楚观察到碳纳米点的晶格条纹分布均匀,清晰可辨,晶格间距约0.21 nm。 通过测量透射电镜图中纳米粒子直径进行统计, 碳纳米点直径为3.0~4.2 nm,平均3.5 nm。 详见图1。
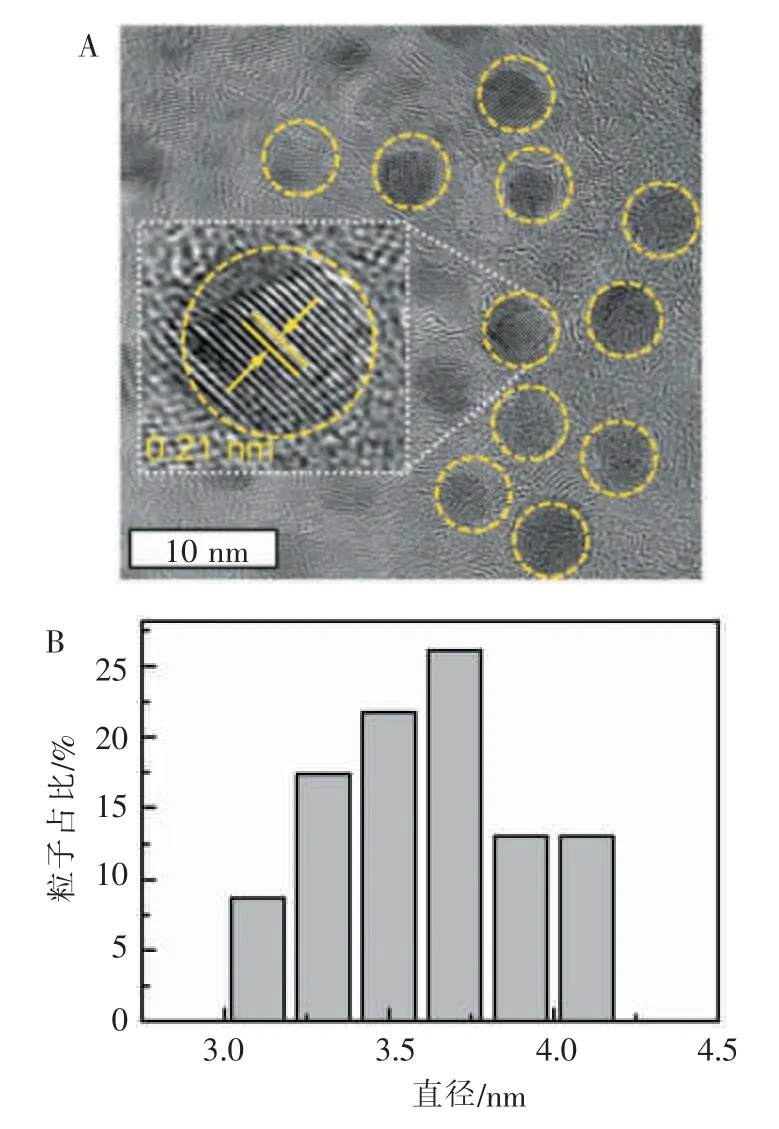
图1 碳纳米点的表征Figure 1 Characterizations of the CDots
2.2 FTIR 和X 射线光电子能谱结果
水杨酸的FTIR(图2A)显示,羧酸C=O 伸缩振动位于1 670 cm-1, 羧基C-O 伸缩振动位于1 292 cm-1,羧基O-H 弯曲振动位于1 325 cm-1。 以上所有的振动峰都属于羧基基团[9]。 此外,酚羟基在1 246 cm-1处具有C-O 伸缩振动,在1 325 cm-1处具有弯曲振动。羧基和酚羟基O-H 的伸缩振动范围从2 900 cm-1开始,至3 500 cm-1结束。 硫脲的FTIR(图2B)显示,在3 100~3 500 cm-1处,N-H 发生伸缩振动[10],在1 610 cm-1处发生N-H 弯曲振动,在1 080 cm-1处发生C-N 伸缩振动, 在1 410 和1 475 cm-1处有NH=S 伸缩振动。 碳纳米点的FTIR(图2C)显示,碳纳米点的O-H/N-H 伸缩振动在3 000~3 500 cm-1, 碳纳米点的C=O 伸缩振动位于1 620 cm-1,N-H 弯曲振动位于1 540 cm-1。此外,碳纳米点在2 050 cm-1处还出现了一个新的吸收峰。

图2 水杨酸、硫脲及合成碳纳米点的FTIR 分析Figure 2 FTIR spectra of salicylic acid, thiourea, and CDots
碳纳米点的X 射线光电子能谱显示,其由碳元素(C)、氮元素(N)、氧元素(O)和硫元素(S)组成(图3), 且元素的原子数比例为C∶N∶O∶S=54.4∶35.7∶2.0∶7.9。

图3 碳纳米点的X 射线光电子能谱Figure 3 X-ray photoelectron spectrum of the fabricated CDots
2.3 碳纳米点的生物安全性
CCK-8 实验结果显示, 随着碳纳米点浓度从0增加至200 μg/mL, 各组细胞活性仍维持在80%~90%。 实验中,经CCK-8 溶液处理后,细胞在短时间内颜色明显变化, 不同浓度的碳纳米点处理后,细胞增殖与对照组相比没有明显下降。 如图4 所示,各浓度(10、20、50、100 和200 μg/mL) 碳纳米点均没有明显的细胞毒性(P>0.05)。此外,实验中镜下没有观察到明显的细胞形态改变。

图4 不同浓度碳纳米点对RAW264.7 细胞活性的影响Figure 4 The effect of different concentrations of CDots on viabilities of RAW264.7 cells
2.4 RT-qPCR 结果
与碳纳米点共培养24 h 后,LPS 组的TNF-α 水平比空白对照组高23.3 倍,LPS 处理组的IL-1β 水平比空白对照组组升高315 倍;碳纳米点组TNF-α和IL-1β 的表达比LPS 组分别降低了44.8%和89.7%(P<0.01), 见图5A、B。 处理48 h 后,LPS 组TNF-α 的表达比空白对照组高8.3 倍,IL-1β 的表达比空白对照组高353.8 倍;碳纳米点组TNF-α 的表达比LPS 组低26.6%(P<0.05),IL-1β 的表达比LPS 组低78.6%(P<0.01),见图5C、D。
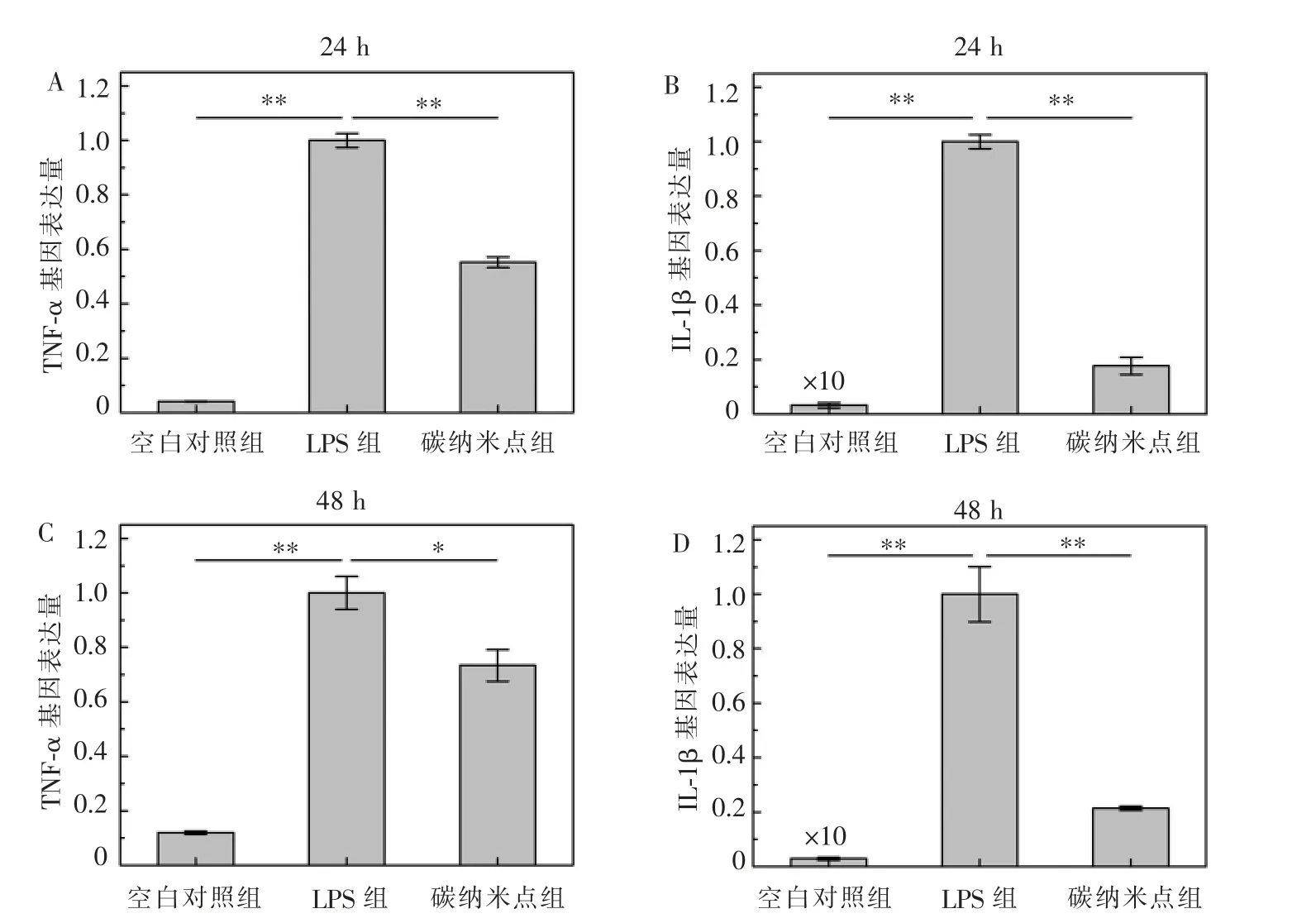
图5 RT-qPCR 法检测碳纳米点的体外抗炎效果Figure 5 In vitro anti-inflammation effect of CDots evaluated by RT-qPCR
2.5 Western blotting 结果
处理24 h 后,LPS 组细胞相对于空白对照组,TNF-α 和IL-1β 表达显著增加,条带明显增宽(图6A)。碳纳米点组细胞TNF-α 和IL-1β 表达显著降低(P<0.05),见图6B。 处理48 h 后,与空白对照组比,TNF-α 表达稍上升,IL-1β 表达显著增加,条带明显增宽(图6C)。 碳纳米点组相对于LPS 组,TNF-α 的表达显著降低(P<0.01),IL-1β 的表达降低(P<0.05)。详见图6D。

图6 Western blotting 法检测碳纳米点处理后,各组细胞中TNF-α 和IL-1β 的蛋白表达量Figure 6 Western blotting assay of inflammation-related protein TNF-α and IL-1β after treatment with CDots
3 讨论
碳纳米点具有良好的生物相容性,同时还具有合成便利,反应原料价格低廉、易于批量生产的优点,因此,可以安全地应用于生物医学[11]。 本文中所制备的碳纳米点在TEM 下其晶格间距约0.21 nm,与先前研究中报道的石墨结构中晶面之间的距离(100)一致[12]。清楚的晶格条纹证明了我们所制备的碳纳米点是经过了反应原料水杨酸和硫脲之间的缩聚和碳化反应而生成的,而不只是单纯的小分子之间的物理吸附。 碳纳米点的平均直径为3.5 nm,具有良好的分散性,该特点不仅有利于碳纳米点进入细胞, 也有利于碳纳米点在体内的形成是均匀分布的[13],从而能更高效率地发挥抗炎作用。
FTIR 分析揭示了碳纳米点的化学结构和形成机制。 水杨酸的FTIR 证明其具有羧基和酚羟基,而硫脲的FTIR 显示,在3 100~3 500 cm-1处发生N-H 伸缩振动, 在1 610 cm-1处发生N-H 弯曲振动,在1 080 cm-1处发生C-N 伸缩振动,在1 410和1 475 cm-1处有N-H=S 伸缩振动, 显示存在胺基。 水杨酸的羧基/羟基和硫脲的胺基确保随后的脱水缩合和碳化反应以形成碳纳米点。 碳纳米点的FTIR 显 示,O-H/N-H 在3 000~3 500 cm-1处有伸缩振动,说明碳纳米点中存在羟基和胺基。 与水杨酸的C=O 伸缩振动相比, 碳纳米点的C=O 伸缩振动移至1 620 cm-1,后者与酰胺I 带的位置一致。与硫脲相比,碳纳米点的N-H 弯曲振动也从1 610 cm-1移至1 540 cm-1,后者与酰胺Ⅱ带的位置一致[14]。此外, 合成的碳纳米点在2 050 cm-1处出现了一个新的吸收峰,可能是由于仲胺的N-H 伸缩振动所产生的[15]。这些结果说明,碳纳米点的形成是基于羧基/羟基和胺基之间的脱水缩合及进一步碳化[16]。 进一步的研究显示,X 射线光电子能谱证明碳纳米点由碳元素、氮元素、氧元素和硫元素组成,其中碳元素来自于水杨酸和硫脲, 氧元素来自于水杨酸,氮元素和硫元素来自于硫脲。元素的原子数比例为C∶N∶O∶S=54.4∶35.7∶2.0∶7.9, 可以看出碳元素为主要成分,因而称其为碳纳米点。 已有研究显示,合成小分子碳纳米点的原料官能团之间可以发生化学反应,使得药品具有抗炎作用[17-18]。 因此,我们认为本文中合成的碳纳米点通过水杨酸的羧基与硫脲的胺基之间发生反应,生成了具有抗炎作用的酰胺键[17,19],同时仍保持了具有抗炎活性的表面官能团[18],使得合成碳纳米点具有更加良好的生物抗炎应用潜能。并且,由于碳纳米点的纯化过程中已经完全去除未反应的小分子原料(水杨酸和硫脲),所以发挥抗炎作用的是碳纳米点本身。 除此以外,红外官能团的检测也显示,合成的碳纳米点具有羧基基团,因而具有强吸水性, 碳纳米点之间表面大量的羧基、羟基及氨基基团能够电离,使碳纳米点具有非常好的亲水性,并在水溶液中能维持单分散状态,更加有利于其在细胞内和体内的均匀分布。
生物安全性对于碳纳米点的应用起着至关重要的作用。 本研究中,我们通过CCK-8 实验观察碳纳米点的细胞毒性,不同浓度的碳纳米点与细胞共培养24 h 后均未表现出明显的毒性作用, 同时,在镜下没有观察到明显的细胞形态改变,证实了合成的碳纳米点具有较好的生物相容性,为进一步的体外和体内应用提供基础。
为了研究碳纳米点的抗炎作用, 我们使用LPS诱导了RAW264.7 细胞的炎症状态,并通过检测碳纳米点处理后细胞内炎症因子TNF-α 和IL-1β 的表达,来评估碳纳米点对炎症的抑制作用。LPS 是革兰氏阴性菌的内毒素,可在动物中引起强烈的免疫反应。 TNF-α 由活化的巨噬细胞产生,并在免疫反应的急性期增加。IL-1β 也由活化的巨噬细胞产生,是炎症反应的重要介质。先前的研究显示,LPS 作用于巨噬细胞以释放TNF-α,而TNF-α 能和LPS 共同进一步诱导细胞释放IL-1β, 导致IL-1β 的分泌量明显高于TNF-α。 我们利用LPS 处理细胞24 h 和48 h 后,通过RT-qPCR 实验检测到IL-1β 和TNF-α显著增加, 通过Western blotting 实验检测到IL-1β和TNF-α 对应条带明显增宽,均说明LPS 成功诱导了细胞的炎症状态。 利用200 μg/mL 碳纳米点和LPS 共同处理细胞后,RT-qPCR 实验检测到相对于单独LPS 处理的细胞,其TNF-α 和IL-1β 显著降低(P<0.05)。Western blotting 实验进一步检测到TNF-α和IL-1β 蛋白表达降低, 表明碳纳米点在蛋白水平抑制了炎症因子的表达。 研究表明,水杨酸能够通过抑制环氧合酶活性,减少前列腺素生成进而发挥抗炎作用[20],合成的碳纳米点保留了水杨酸的主要官能团,因此,具有抗炎活性。 此外,某些含有酰胺基团的物质,例如β-内酰胺,可以达到强抗炎作用,红外测试结果证明合成的碳纳米点生成了酰胺键。 因此,我们推测合成的碳纳米点能够稳定高效地发挥抗炎作用,分子中合成的酰胺键发挥了有效的协同作用,增强了抗炎效果[18]。
综上所述,我们通过微波辅助加热水杨酸和硫脲制备了一种具有抗炎作用的碳纳米点,所得的碳纳米点具有纳米级尺寸、优异的生物相容性、良好的水溶性, 并通过RT-qPCR 和Western blotting 实验证明了药物碳纳米点对炎症因子有抑制作用,证明其能够很好地应用于抗炎, 为后续开发更多种类、更强药效的抗炎药物体系提供了更多的研究思路,具有良好的应用前景。 同时,碳纳米点表面所具有的羧基和氨基等化学基团,也有利于对其进行表面修饰,从而有望实现更多的生理功能。

