替雷利珠单抗用于脐尿管癌患者维持性治疗1例并文献复习
陈杰勋 陈冬明 王 恺 王 冬 许贤林
南京医科大学附属逸夫医院泌尿外科 (江苏 南京 21000)
脐尿管癌是一种少见的恶性疾病,早期诊断困难,恶性程度高,预后不佳。因缺乏大宗病例研究,目前暂无规范的诊治模式。本文报道1例脐尿管癌患者的治疗经过,结合国内外文献进行探讨其临床特点、诊断和治疗方法,提高对该疾病的认识。
1 临床资料
患者,男性,61岁,2020年8月11日因“全程无痛性肉眼血尿3天”就诊于我院门诊,可见血凝块,无尿频、尿急、尿痛,无腰酸腰痛,行彩超示:膀胱上方低回声区,大小约22mm×20mm,内见点状强回声,遂以“膀胱占位性病变”收住入院。入院时病人生命体征平稳,实验室检查均未见异常。腹部CT平扫+增强示膀胱前壁中部见团块软组织密度影,大小约20mm×25mm,增强后明显强化(图1)。既往有糖尿病5年,口服二甲双胍缓释片,血糖控制佳。

图1 术前CT示膀胱前壁中部见团块软组织密度影,增强后明显强化。
完善检查后,与患者沟通后,排除手术禁忌证,于2020年8月13日在全身麻醉下行“经尿道膀胱镜检查术+扩大性膀胱部分切除术”。膀胱镜检查示膀胱顶壁一大小约2.5×3cm肿物,表面可见钙化灶。遂行扩大性膀胱部分切除术,具体步骤如下:取腹部正中切口,长约15cm,依次切开皮肤、皮下筋膜、脂肪直达腹膜,打开腹膜见膀胱顶部一大小约3cm×2cm花瓣样肿物与腹相连(图2),切开膀胱,吸尽尿液,距肿瘤3.0cm处连同部分正常膀胱壁一并切除,同时整块切除脐外侧韧带两旁腹膜、膀胱脐韧带及脐部,周围肠道未见转移及淋巴结肿大,彻底止血,灭菌注射用水浸泡5min创面,留置腹腔引流管1根,逐层缝合。

图2 术中表现:见膀胱顶部一大小约3×2cm花瓣样肿物与腹相连(食指所指为肿瘤)。
2 结 果
手术顺利,手术时间为3h30min,术中出血200mL。术后予以抗感染补液、护胃等治疗。术后1周拔除引流管,2周拔除导尿管。术后病理结果示:中-低分化腺癌(肠型)(图3),部分区域为粘液腺癌(图4),可见神经侵犯,切缘阴性。免疫组化:CK7(散+)、CK20(3+)(图5)、Villin(3+)(图6)、CDX-2(3+)(图7)、CA125(-)、PSA(-)、P63(-)、GATA3(-)。术后恢复良好,予以出院。后患者就诊于江苏省人民医院肿瘤科予以紫杉醇脂质体250mg(第1天)+卡铂400mg(第2天)静滴化疗1疗程,于2020年10月27日再次来我院维持原方案化疗,每3周为一个周期,共3疗程,每次用药前一天查血常规、肝肾功能、电解质等指标,用药后每周查血常规、肝肾功能、电解质。查组织切片PD-L1蛋白表达:肿瘤细胞中PD-1高表达。期间因患者家中有事,直至2021年3月28日序贯予以替雷利珠单抗200mg静滴,每3周为一个周期,共4疗程。第1次用药前查血常规、肝肾功能、电解质、心肌酶谱、甲状腺功能、皮质醇激素、胸部CT未见明显异常,CD4细胞244个/uL(参考区间414~1440个/μL)、CD8细胞124个/μL(参考区间238~1250个/μL)、CD3细胞392个/μL(参考区间770~2860个/μL)。之后每次用药前一天查血常规、肝肾功能、电解质等指标,用药后每周查血常规、肝肾功能、电解质。第4次用药前再次血常规、肝肾功能、电解质、心肌酶谱、甲状腺功能、皮质醇激素、胸部CT未见明显异常,CD4细胞528个/μL(参考区间414~1440个/μL)、CD8细胞544个/μL(参考区间 238~1250个/μL)、CD3细胞1136个/μL(参考区间770~2860个/μL)。术后每3月复查1次胸腹部CT及膀胱镜检查。目前患者恢复良好,随访16个月复查腹部CT示脐尿管癌术后,膀胱前壁见点状高密度影,邻近脂肪间隙清晰,未见明确肿块影。
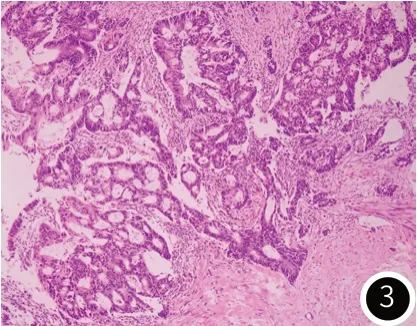
图3 组织病理提示中-低分化腺癌(肠型)(HE×100)。

图4 组织病理提示部分区域为粘液腺癌(HE×100)。
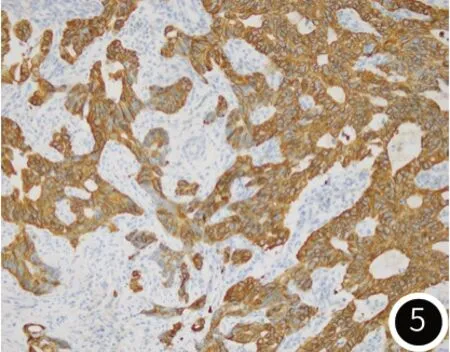
图5 肿瘤组织免疫组化检测CK20阳性(SP×200)。

图6 肿瘤组织免疫组化检测Villin阳性(SP×200)。
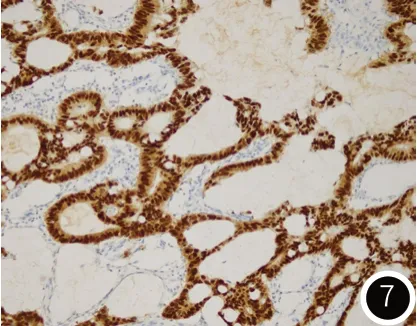
图7 肿瘤组织免疫组化检测CDX-2阳性(SP×200)。
3 讨 论
3.1 脐尿管癌临床表型及诊断标准脐尿管癌发病率低,约占成人恶性肿瘤的0.01%,占膀胱肿瘤的0.2%,高发年龄为50~70岁,男性多于女性,男女比例约为1.8∶1[1]。本例患者发病年龄为61岁,符合文献报道发病年龄。脐尿管癌临床表现与生长部位有关:4%位于脐尿管近端的肿瘤较早破溃后脐部流出黏液性或血性液体;6%位于脐尿管中段或侵犯腹壁的肿瘤,能在下腹部触及肿块;90%位于脐尿管远端的肿瘤可压迫膀胱,突破膀胱后有血尿[2]。因脐尿管位于Retzius间隙中,位置较深,脐尿管癌发病隐匿,早期一般无临床表现,当肿瘤侵犯膀胱时绝大多数以肉眼血尿为始发症状。肉眼血尿同时也是膀胱癌最常见,本病例门诊时误以为膀胱癌,当肿瘤位置位于膀胱顶部时,应考虑到脐尿管癌可能。
脐尿管癌的临床诊断主要依靠膀胱镜检查和影像学检查。80%患者通过膀胱镜可见膀胱内肿物,但应注意当肿瘤未突破膀胱黏膜时,膀胱镜检查不一定能观察到肿瘤组织[3]。B超是临床最常用的检查方法,脐尿管癌声像图主要为不均匀低回声团块伴钙化,常向膀胱腔内突出,血流分布以周边型为主。CT检查是脐尿管癌检查的重要方法,表现为:多为于Retzius间隙内脐尿管走行区近膀胱顶及前壁,与脐尿管长轴一致;肿瘤密度均匀或不均匀,常见钙化和低密度黏液区;动脉期肿瘤轻中度强化,静脉期及排泄期肿瘤强化较前明显;矢状位可更好显示脐尿管、膀胱和肿瘤三者关系[4-6]。MRI的脐尿管癌影像特征为:平扫肿瘤实性成分T1WI等低信号,T2WI稍低信号,DWI扩散受限呈高信号,增强扫描肿瘤实性部分明显强化,囊性成分不强化[7]。
脐尿管癌临床的诊断标准:只要肿瘤定位于膀胱前壁或顶部,膀胱内无腺性膀胱炎及肠上皮化生,无膀胱尿路上皮癌,可见脐尿管残留结构,脐尿管癌的诊断即可成立[8]。脐尿管癌Sheldon分期:Ⅰ期,肿瘤局限于脐尿管黏膜;Ⅱ期,肿瘤局限于脐尿管内;Ⅲa期,肿瘤侵犯膀胱;Ⅲb期,肿瘤侵犯腹壁;Ⅲc期,肿瘤侵犯腹膜;Ⅲd期,肿瘤侵犯膀胱以外的其他器官;Ⅳa 期,局部淋巴结转移;Ⅳb期,远处转移[9]。本病例符合脐尿管癌的诊断,按照Sheldon分期系统,属于Ⅲa期。
3.2 脐尿管癌组织胚胎学来源及病理分型尿管为胚胎早期连接脐带与膀胱的管状结构,胎儿出生后该结构逐渐闭合为一纤维条索,即脐正中韧带。脐尿管组织学上可分为3层,由外向内依次为平滑肌层、黏膜下结缔组织层和移行上皮层。未闭合的脐尿管残余容易发生脐尿管癌,Hue和Jacquin于1863年首次报道脐尿管癌[10-11]。脐尿管癌的发病机制仍不清楚,可能与脐尿管上皮细胞增生及黏膜上皮化生有关,亦有可能于脐尿管遗留的肠腺上皮有关[12]。
脐尿管癌的组织学类型主要为腺癌(约92%),其次还包括黏液细胞癌、移行细胞癌、透明细胞癌、鳞状细胞癌及神经内分泌肿瘤等[13-14]。由于组织形态学上的重叠,区分脐尿管癌与原发性膀胱腺癌和继发性膀胱腺癌(特别是结直肠癌)具有一定难度。病理类型的鉴别常需要免疫组化,脐尿管癌免疫组化中CK20、CK7、CD15、CDX2、Villin、CK34βE12常为阳性表达,而结直肠癌中CK7表达常为阴性[11,15-16]。本例病例术后病理报告为中-低分化腺癌为主,混合有黏液腺癌,免疫组化CK20、CK7、CDX2、Villin阳性与文献基本一致。
3.3 脐尿管癌的治疗方案及PD-1抑制剂大多数脐尿管癌患者就诊时为中晚期,总体预后不佳,5 年生存率约为45%~49%,与病理分期分级、手术切缘、淋巴管血管浸润有关[17]。Palla Garcia等[18]研究指出脐尿管癌≥Ⅲ期患者5年的OS、CSS和RFS分别显著降低至38.0、35.2和28.4%。脐尿管癌术后的治疗包括化疗、放疗、靶向治疗、免疫治疗等[9,18-19]。脐尿管癌侵袭性较高,即使早期诊断并治疗,也易出现复发及转移。手术治疗是非转移性脐尿管癌的主要治疗方式,包括扩大性部分膀胱切除术和根治性膀胱切除术。根治性膀胱全膀胱切除术因手术创伤大,术后生活质量下降,并不能延长患者生存时间,故大部分学者推荐扩大性部分膀胱切除术。淋巴结清扫是否对脐尿管癌患者有益处仍有很大的争议,有文献报道淋巴结清扫与总生存时间和肿瘤无进展生存时间无关,主要用来确定肿瘤的分期[20-21]。本病例因术前CT未提示有淋巴结转移,术中也未触及肿大淋巴结,故未行淋巴结清扫,以免加重创伤。
由于脐尿管癌发病率低、缺乏大宗病例研究,目前尚无统一的标准治疗方案,故有必要探讨脐尿管癌患者适宜的综合治疗方案。值得注意的是,脐尿管癌与结直肠癌病理组织上有很多共同点,有很多中心采用治疗结直肠癌的方案治疗脐尿管癌[18,22]。又因脐尿管癌多累及膀胱,临床上又有部分学者参照膀胱尿路上皮癌的治疗方案[9,19]。综合上述特点,紫杉醇联合铂类化疗是临床治疗癌症的主要化疗方案之一,在胃肠道肿瘤中疗效确切,副作用较少。同时,将化疗与免疫治疗联合应用已成为目前治疗难治性肿瘤的新治疗方法。
近年来,免疫治疗在肿瘤中发展迅速,其中PD-1/PD-L1信号通路已经成为免疫治疗新靶点,其抑制剂目前已在多种恶性肿瘤中应用[23]。替雷利珠单抗是一种针对程序性死亡受体-1(PD-1)的人源化单克隆抗体(IgG4变体),在多种局部晚期或转移性肿瘤中表现出良好的抗肿瘤作用,目前国家食品药品监督管理局已批准用于尿路上皮癌、非经典型霍金奇淋巴瘤、非小细胞肺癌、肝细胞癌。近年有学者尝试性将替雷利珠单抗用于难治性肾癌、胆管癌、浆液性子宫内膜癌,均取得较好治疗效果[24-26]。
目前尚不明确PD-1抑制剂在脐尿管癌中的治疗作用,仅有少量研究报道替雷利珠联合化疗在胃癌中的作用。NCT30469557临床试验显示替雷利珠联合化疗作为一线治疗方案在中国晚期胃癌/胃食管结合部腺癌中疗效确切,其中客观有效率(ORR)为46.7%,疾病控制率(DCR)为80%,中位无进展生存期(PFS)为6.1个月[27]。在本例患者治疗过程中,研究者注意到Jia等[9]的报道,运用顺铂和PD-1抑制剂治疗2例脐尿管癌,随访45个月,病人病情稳定。本例病例术后病理提示中-低分化腺癌(肠型),且肿瘤细胞PD-L1高表达,选择紫杉醇脂质体和卡铂治疗后,序贯予以替雷利珠单抗治疗,用药过程患者未出现不适反应。
本研究报道的1例替雷利珠单抗和Jia等[9]报道的2例PD-1抑制剂治疗脐尿管癌均属个案报道。由于缺乏相关的临床和基础研究,目前替雷利珠单抗治疗脐尿管癌的机制尚不明确。结合本例病例在运用紫杉醇与卡铂治疗4疗程后T淋巴细胞明显下降,予以替雷利珠单抗治疗后T淋巴细胞上升至正常水平的临床现象,推测其机制可能为:肿瘤的发生、发展及转移与血管生成关系密切,紫杉醇联合卡铂对肿瘤血管的形成有抑制作用,但会影响T淋巴细胞功能,替雷利珠单抗能改善甚至逆转T淋巴细胞失功状态,重新激活效应T淋巴细胞的攻击与杀伤能力,增强抗血管生成治疗的敏感性,延长肿瘤内血管“正常化形成”的时间窗并阻碍周边组织微小血管形成,从而促进抗血管形成治疗效果[24]。检索国内外文献,鲜见报道替雷利珠单抗用于脐尿管癌治疗,本研究尝试性运用TC方案序贯替雷利珠单抗治疗脐尿管癌为临床治疗脐尿管癌提供一种可参考的治疗方案。
综上所述,脐尿管癌临床罕见、以血尿首发症状为主、易与膀胱癌相混淆,诊断主要依据腹部CT及术后病理,扩大性膀胱部分切除术联合全身化疗及替雷利珠免疫治疗为有效的治疗方法,短期疗效理想,长期治疗效果需要多中心、大样本病例的报道。

