肠复方对肠癌荷瘤小鼠免疫调节作用的研究*
林宏远,邓湘琴,崔超宇,谭骏岚,龙梦玲,宋程,梁慧
1.湖南中医药大学,湖南 长沙 410208; 2.湖南省肿瘤医院,湖南 长沙 410013
结直肠癌的发病呈上升趋势,我国结直肠癌发病率在常见恶性肿瘤中为第4位,死亡率为第5位[1]。近年研究表明,结肠癌的发生、发展与免疫细胞、细胞因子等免疫介质的紊乱密切相关[2]。在结直肠癌肿瘤组织中浸润了大量的免疫细胞,包括自然杀伤细胞(natural killer cell,NK)、调节性T细胞(regulatory cells,Treg)等,同时分泌大量的免疫促进相关细胞因子和免疫抑制相关细胞因子参与结直肠癌免疫微环境的调控。在结直肠癌肿瘤免疫微环境中,NK细胞及免疫促进相关细胞因子白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)有利于维持正常的免疫功能,发挥抗肿瘤免疫作用,拮抗结直肠癌发生发展。Treg细胞及免疫抑制相关细胞因子 IL-10、转化生长因子β(transforming growth factors-β,TGF-β)则引发免疫逃逸,抑制抗肿瘤免疫作用,促进了大肠癌的发生发展[3]。前期临床研究证实,肠复方治疗晚期大肠癌有效,可提高患者瘤体控制率,延长无疾病进展时间,提高远期生存获益[4],提高晚期大肠癌患者外周血中NK细胞数量和CD4/CD8比值,改善患者的细胞免疫功能[5]。前期研究提示,在荷瘤小鼠瘤体和外周血中,肠复方对髓源抑制性细胞(myeloid-derived suppressor cells,MDSCs)有明显的抑制作用,增加瘤体中CD4+、CD8+T细胞的水平,从而提高机体免疫状态、抑制肿瘤发生[6]。基于此,为进一步探讨肠复方的组方规律,本研究拟探索其不同治则发挥抗肿瘤作用及对肿瘤组织免疫微环境的影响。
1 材料
1.1 细胞及动物小鼠结肠癌细胞株CT26,购自中国医学科学院细胞库,编号ZQ0190。BALB/c小鼠,4~6周龄,50只(实验动物合格证号:4300470059729;实验动物使用编号:00190458),购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘) 2016-0002。在湖南省肿瘤医院动物实验中心SPF条件下饲养,予以自由饮食。本研究获得中南大学湘雅医学院附属肿瘤医院动物实验伦理委员会批准,伦理批号:2019-18。
1.2 药物及试剂香菇菌多糖片(湖北广仁药业有限公司,规格:10 mg/片,批号:1903010);肠复方(党参10 g,黄芪30 g,白术15 g,陈皮10 g,麦芽 15 g,鸡内金15 g,薏苡仁30 g,香附15 g,郁金15 g,莪术15 g,土鳖虫15 g,半枝莲30 g,蛇舌草30 g,壁虎10 g,茯苓10 g,女贞子10 g,甘草5 g)、健脾益气扶正(党参10 g,白术15 g,茯苓10 g,黄芪30 g,女贞子10 g,鸡内金15 g,麦芽15 g,甘草5 g)、祛湿化瘀解毒(陈皮10 g,薏苡仁30 g,香附15 g,郁金 15 g,莪术15 g,半枝莲30 g,蛇舌草30 g,土鳖虫 15 g,壁虎10 g)(以上中药均购自湖南省肿瘤医院中药房)。RPMI 1640培养基(美国Sigma公司,批号:RNBH5043);胰蛋白酶(上海碧云天生物技术有限公司,批号:C0201);胎牛血清(美国Gibco公司,批号:10099-141);青霉素链霉素混合液(上海碧云天生物技术有限公司,批号:SV30010);MTT试剂(美国Sigma公司,批号:M2128);IL-10抗体(美国Proteintech公司,批号:20850-1-AP);TNF-α抗体(美国Proteintech公司,批号:60291-1-Ig);IL-2 抗体(美国Proteintech公司,批号:26156-1-AP);Foxp3抗体(英国Abcam公司,批号:ab215206);TGF-β抗体(英国Abcam公司,批号:ab215715);NK1.1抗体(美国eBioscience公司,批号:11-594-81);40 ng·L-1多聚甲醛(上海碧云天生物技术有限公司,批号:P0099);二步法试剂盒(北京中杉金桥生物技术有限公司,批号:PV-9000);DAB试剂盒(北京中杉金桥生物技术有限公司,批号:ZLI-9018)。
1.3 仪器超净工作台(北京亚泰隆,型号:YT-CJ-2NB);二氧化碳培养箱(上海三藤仪器,型号:DH-160I);倒置生物显微镜(北京中显恒业仪器,型号:DSZ2000X);流式细胞分析仪(Beckman公司);摇床(中国江苏其林贝尔,型号:TS-92);包埋机(常州中威电子仪器,型号:BMJ-A);切片机(浙江金华益迪试验器材,型号:YD-315);盖玻片、载玻片(海门远泰公司,型号:DY89-1,AY89-2);台式冷冻离心机(德国Eppendorf公司,型号:TGL-18R)。
2 方法
2.1 药物制备将购买的中药经湖南省肿瘤医院药剂科邹霞药师鉴定后使用。温水浸泡1 h,水量超出药物3~5 cm,大火煮沸后转小火煎30 min,趁热过滤,药渣按前法再煎煮2次,将3次药液混匀、过滤,恒温水浴箱上浓缩为扶正祛邪组浓度为3.6 g·mL-1、扶正组浓度为1.4 g·mL-1、祛邪组浓度为2.2 g·mL-1,4 ℃保存备用。
2.2 建模、动物分组及给药方法常规复苏CT26细胞,将细胞培养含10%胎牛血清的RPMI 1640培养液中;置于37 ℃、5%CO2培养箱内培养并传代。用0.25%胰蛋白酶消化收集对数生长期的细胞,使用PBS液配制成细胞密度为 1×107mL-1的单细胞悬液。取细胞浓度为1×107mL-1的CT26细胞悬液0.1 mL,即接种细胞数为1×106mL-1,分别注射到BALB/c小鼠的右腋下,建立小鼠结肠癌皮下移植瘤模型。按随机数字表法将造模成功的50只小鼠随机分模型组、扶正祛邪组、扶正组、祛邪组和香菇多糖组,每组10只。于造模后第7天皮下种植瘤生长至1 cm左右时开始干预,按 70 kg 人肠复方使用剂量给予小鼠相应等效剂量,扶正祛邪组按照每日使用剂量为36 g·kg-1灌胃给药,扶正组每日使用剂量为14 g·kg-1、祛邪组每日使用剂量为22 g·kg-1,小鼠香菇菌多糖片使用剂量为 5.2 mg·kg-1,模型组给予蒸馏水。以上药液每次灌胃0.2 mL,每天灌胃1次,每周5 d,连续干预4周。
2.3 对荷瘤小鼠的体质量及抑瘤率的影响常规每周测定各组小鼠体质量。干预结束后颈椎脱臼法处死小鼠,剥离肿瘤,称重记录,并计算各组药物的抑瘤率。
抑瘤率(%)=(1-实验组平均瘤质量/模型组平均瘤质量)×100%
2.4 流式检测小鼠瘤体中NK细胞水平每组随机选取5只小鼠,剥离瘤体组织,采用无菌眼科剪将瘤体组织剪碎,移液枪吹散,将含组织的悬液过200目细胞滤网,300 r·min-1离心 5 min得到沉淀,弃上清,PBS重悬收集细胞沉淀。每个瘤体细胞悬液样本吸取1×106个细胞,加入500 μL的Binding Buffer悬浮细胞,加入的NK1.1流式抗体染色,避光孵育30 min,300 r·min-1离心5 min,弃上清后用PBS清洗2次,用1%多聚甲醛定容至300 μL,过350目滤网。4 ℃避光保存,流式上机检测。
2.5 免疫组化检测小鼠瘤体Treg、IL-10、TGF-β、IL-2、TNF-α的表达每组随机选取5只小鼠,脱颈处死小鼠、剥离瘤体,石蜡固定包埋瘤体,间隔5 μm进行石蜡连续切片20张,每隔5张取一张表,插入固定,BSA封闭,分别滴加Treg、IL-10、TGF-β、IL-2、TNF-α抗体,4 ℃过夜,孵育二抗。DAB显色,脱水,透明,封片,显微镜下阳性表达定位于细胞核,为棕黄褐色。显微镜下每张切片选择3个视野,放大400倍下观察视野中阳性细胞表达个数,取多个视野阳性细胞数。免疫组化染色图像结果使用IPP(Image-Pro Plus 6.0)软件进行分析。测量集成光密度及面积,用平均光密度评价Treg、IL-10、TGF-β、IL-2、TNF-α的表达水平。
平均光密度(IOD)=集成光密度/面积
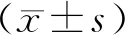
3 结果
3.1 对肠癌荷瘤小鼠体质量的影响与模型组同期比较,治疗第28天扶正祛邪组、扶正组、香菇多糖组小鼠体质量显著升高(P<0.01,P<0.05),而祛邪组小鼠体质量显著降低(P<0.01)。与治疗第0天比较,各组在治疗后第28天,小鼠体质量均有不同程度地降低,其中模型组、祛邪组降低最为显著(P<0.01),香菇多糖组小鼠体质量亦有降低(P<0.05)。见表1。

表1 不同治则对肠癌荷瘤小鼠体质量的影响
3.2 对肠癌荷瘤小鼠抑瘤率的影响与模型组比较,扶正组、香菇多糖组小鼠瘤质量显著减轻(P<0.05),抑瘤率显著升高,扶正祛邪组、祛邪组小鼠瘤质量极显著减轻(P<0.01),抑瘤率极显著升高。见表2。

表2 不同治则对肠癌荷瘤小鼠抑瘤率的影响
3.3 对肠癌荷瘤小鼠瘤体中NK细胞含量的影响通过流式细胞术检测发现,与模型组比较,扶正祛邪组、扶正组、祛邪组瘤体中NK细胞的水平显著升高(P<0.01),香菇多糖组虽低于模型组,但差异无统计学意义(P>0.05)。见图1。

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组;与模型组比较,**P<0.01
3.4 对肠癌荷瘤小鼠瘤体Treg、IL-10、TGF-β的影响与模型组比较,扶正组、香菇多糖组小鼠瘤体中Treg、IL-10、TGF-β的水平显著降低(P<0.05),扶正祛邪组和祛邪组极显著降低(P<0.01);与香菇多糖组比较,扶正组小鼠瘤体中Treg、IL-10、TGF-β的水平均明显降低(P<0.05),扶正祛邪组和祛邪组显著降低(P<0.01);与扶正祛邪组比较,扶正组与祛邪组小鼠瘤体中Treg、IL-10、TGF-β的水平均显著升高(P<0.01,P<0.05)。见图2、图3、图4及表3。

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组

表3 不同治则对荷瘤小鼠瘤体Treg、IL-10、TGF-β表达的影响 值)
3.5 对肠癌荷瘤小鼠瘤体IL-2、TNF-α表达的影响与模型组比较,祛邪组、香菇多糖组小鼠瘤体中IL-2、TNF-α表达水平显著升高(P<0.05),扶正祛邪组、扶正组极显著升高(P<0.01);与香菇多糖组比较,祛邪组小鼠瘤体中 IL-2、TNF-α表达水平显著升高(P<0.05),扶正祛邪组、扶正组极显著升高(P<0.01);与扶正祛邪组比较,扶正组小鼠瘤体中 IL-2、TNF-α表达水平显著降低(P<0.05),祛邪组极显著降低(P<0.01)。见图5、图6及表4。

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组

注:A:模型组;B:扶正祛邪组;C:扶正组;D:祛邪组;E:香菇多糖组

表4 不同治则对荷瘤小鼠瘤体IL-2、TNF-α表达的影响
4 讨论
近年来,随着民众饮食结构的变化与癌症筛查技术的进步,结直肠癌发病率呈逐步上升趋势[7]。越来越多的证据表明,结直肠癌患者存在免疫抑制现象,现免疫治疗成为继手术、放疗、化疗后第四大治疗方式。多项研究证实,中医药以其多靶点、增效减毒等优势,在改善结直肠癌患者免疫功能方面取得了显著的疗效[8]。中医并无“肠癌”这一病名,根据其临床症状和体征,归属于“肠结”“癥瘕”等范畴,是多种病因共同作用下的结果。其发病为本虚标实,脾气亏虚是大肠癌发病内在基础,湿热瘀毒为其发病重要条件,治疗应以“抗癌解毒、扶正祛邪”为基本原则[9]。肠复方以“健脾益气扶正、祛湿化瘀解毒”立法,在既往临床应用和实验研究中均证实肠复方对于结直肠癌的治疗疗效显著。本研究进一步观察不同组分对肿瘤生长、瘤体免疫细胞及免疫相关细胞因子的调控作用,分析不同治则在肠癌治疗中所发挥的作用,进一步明确肠复方不同治则在免疫调控中的作用及其疗效机制,为临床配伍提供科学依据。
本研究发现肠复方健脾益气扶正法偏重于稳定小鼠体质量,但对肠癌瘤体的抑制作用不明显。祛湿化瘀解毒法偏重于抑制瘤体生长,但并不能稳定小鼠的体质量,反而使体质量下降。而健脾益气扶正法和祛湿化瘀解毒法在稳定瘤体质量、控制瘤体生长方面均有明显优势。究其原因,脾胃为后天之本,气血生化之源,脾胃之气健,则饮食摄纳正常,气血生化有源,推测健脾益气扶正治法发挥了主要作用。研究证实,益气健脾类中药可有效改善大肠癌术后患者的免疫功能及胃肠功能,增强机体免疫能力,调节胃肠动力,进一步稳定体质量[10]。而活血化瘀中药可通过抑制肿瘤血管生成、抑制肿瘤细胞增殖、提高机体免疫力等直接抗肿瘤[11],但化瘀解毒中药寒凉、辛散,久用易损伤脾胃、耗散气血,伤及正气[12],故祛湿化瘀解毒法的小鼠体质量下降明显,但其抑制肿瘤生长的作用较优。扶正祛邪组荷瘤小鼠不但体质量稳定,而且抑瘤率高,全方配伍既能发挥抑瘤抗癌作用,又能发挥减轻化瘀解毒药物伤正的副反应,发挥最大的治疗效应。
结直肠癌的发生发展与肿瘤免疫微环境密切相关,肿瘤微环境是指肿瘤局部浸润的免疫细胞、间质细胞及所分泌的活性介质等与肿瘤细胞共同构成的局部内环境[13]。研究显示,肿瘤微环境中的免疫细胞及其分泌的细胞因子具有多种协助肿瘤发生发展的生物学行为,包括参与肿瘤局部血管生成、协助肿瘤细胞发生转移及免疫逃逸等[14-18]。以Treg细胞及IL-10、IL-6、TGF-β等细胞因子促进了大肠癌的发生发展。Treg细胞是一类抑制免疫应答的Th细胞亚群,肿瘤细胞可利用Treg细胞实现免疫逃逸[19-20]。IL-10和TGF-β可诱导Treg分化,Treg细胞亦可通过释放IL-10、TGF-β等免疫抑制相关细胞因子参与肿瘤细胞的免疫耐受和免疫抑制。TGF-β是NK细胞抗肿瘤应答的主要抑制因子之一,在多种肿瘤患者的瘤体中发现TGF-β的含量较正常人体高[21]。另一方面,在结直肠癌免疫微环境中,T细胞、NK细胞等细胞及其分泌的细胞因子如IL-2、IFN-γ、TNF-α发挥抗肿瘤免疫作用,拮抗结直肠癌发生发展。NK细胞作为机体固有免疫的主要效应细胞,其杀伤活性无MHC限制,不依赖抗体,在肿瘤微环境中表达增高[22-23]。NK细胞可以调节核转录因子的活性,从而影响细胞因子的基因表达,抑制IL-2、TNF-α基因转录,从而调节免疫功能[24]。IL-2可促进T细胞增殖,刺激NK细胞生长,并增强其杀瘤活性,TNF-α不仅对多种肿瘤细胞在体外具有细胞毒作用,可通过对肿瘤细胞的直接杀伤作用来发挥抗肿瘤作用。中医药对于肿瘤免疫微环境的调节具有重要意义。研究发现,玉屏风散增强lewis肺癌小鼠中肿瘤浸润的NK细胞,降低肿瘤微环境中NK免疫抑制相关细胞因子 TGF-β及 IL-10,进而增强NK细胞对肿瘤的杀伤活性[25]。同时免疫细胞分泌大量的细胞因子如IL-2、TNF-α、IL-10、TGF-β等参与结直肠癌免疫微环境的调控[26]。许荣忠等[27]发现祛邪治则和扶正祛邪治则均可调控肺癌患者的免疫功能,而祛邪治则在抑制MDSCs和Treg方面作用更强。研究发现,肝癌全方及其不同治法拆方通过改变细胞增殖和周期,从而发挥抑制肝癌的作用[28]。健脾消癌方含药血清能抑制HCT116细胞迁移及侵袭,以健脾益气为治则的健脾消癌方可能通过抑制Akt/mTOR信号通路的激活,从而抑制细胞增殖、侵袭迁移,发挥抗结肠癌及抗复发转移作用[29]。本研究结果推测,肠复方不同组分可能通过上调NK细胞及IL-2、TNF-α,下调Treg及 IL-10、TGF-β的表达来实现免疫调节,从而抑制瘤体生长。
综上所述,本研究发现,扶正祛邪组、扶正组小鼠瘤体中NK细胞及IL-2、TNF-α的表达水平显著增加。肠复方扶正祛邪组以及祛邪组小鼠瘤体中Treg及IL-10、TGF-β的表达水平显著降低。在控制瘤体、抑制肿瘤生长及瘤体免疫细胞因子正向及负向调控方面,健脾益气扶正加祛湿化瘀解毒组均有明显优势,推测健脾益气扶正加祛湿化瘀解毒法降低免疫抑制作用主要来源于其祛湿化瘀解毒法组分,而增强免疫促进作用主要来源于其中健脾益气扶正法组分。对免疫功能的调节得益于健脾益气扶正法、祛湿化瘀解毒法的共同作用,不同治则协同作用,从而提高机体免疫、诱导肿瘤细胞凋亡。

