Caco-2 细胞模型中头花蓼提取液对左氧氟沙星吸收的影响*
蒙文莎,袁 丽,王 朴,郑 林,巩仔鹏,李月婷,王爱民,黄 勇△
(1. 贵州医科大学贵州省药物制剂重点实验室·药用植物功效与利用国家重点实验室,贵州 贵阳 550004; 2. 贵州医科大学药学院,贵州 贵阳 550004; 3. 贵州医科大学民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004)
左氧氟沙星为第3代氟喹诺酮类抗菌药物,对革兰阳性菌和革兰阴性菌均有广谱活性,临床主要用于治疗呼吸道和泌尿道感染[1]。头花蓼为苗族传统药用植物头花蓼的全草,具有利尿通淋、清热利湿、活血散瘀等功效[2],对尿路感染有较好疗效,其所含多酚化学成分没食子酸和原儿茶酸具有抗氧化、抗菌、抗炎等作用[3-5]。目前以头花蓼为原料药已上市的苗药制剂有四季草颗粒、热淋清颗粒等,其中热淋清颗粒是以头花蓼水提物制成的单方制剂,对泌尿系统感染具有独特疗效[6]。热淋清颗粒常与左氧氟沙星联用治疗前列腺炎、急性附睾炎等泌尿道感染,与单独使用相比,联用后具有起效快、不良反应少、用药周期短、治愈率高等优点[7-9],但两药联用后是否发生药物相互作用尚未见报道。本课题组前期的药物代谢动力学研究发现,与单用左氧氟沙星相比,头花蓼提取液和左氧氟沙星联用后,左氧氟沙星的平均驻留时间(MRT)、血药浓度达峰时间(tmax)、表观清除率(CLz/F)和表观分布容积(Vz/F)均显著增加,而其药- 时曲线下面积(AUC0-∞)和峰浓度(Cmax)均显著降低,表明两药联用后发生了药物相互作用[10]。为此,本研究中以没食子酸和原儿茶酸作为头花蓼提取物的指标性成分,考察头花蓼提取液与左氧氟沙星联用后对两药在Caco - 2 细胞模型中吸收的影响[11-14],从而为两药的临床使用提供参考。现报道如下。
1 仪器、试药与细胞
仪器:ACQUITY UPLC I- Class/Xevo TQ - S 型超高效液相色谱- 三重四极杆串联质谱仪,包括自动进样器,二元梯度泵,柱温箱,真空脱气机,MassLynx 4.1质谱工作站(美国Waters公司);Model 680型酶标仪(伯乐生命医学产品<上海>有限公司);TS-100F型倒置显微镜(日本Nikon 公司);Millipore Millicell ERS. 2 型细胞电阻仪(美国Millipore 公司);8000DH 型CO2培养箱、超低温冰箱(美国Thermo Fisher Scientific 公司);超净工作台(北京东联哈尔仪器制造有限公司);Transwell培养板(聚碳酯膜,孔径0.4 μm,直径12 mm,美国Coming公司);MTN-2800D 型氮气吹干仪装置(天津奥特塞恩斯仪器有限公司);KQ - 500DE 型数控超声波清洗器(昆山市超声仪器有限公司)。
试药:头花蓼提取物(本课题组提取[15]);左氧氟沙星对照品(批号为130455-201607,含量97.3%),葛根素对照品(批号为110752-201512,含量98.0%),原儿茶酸对照品(批号为110809-201604,含量90.8%),没食子酸对照品(批号为110831-201605,含量98.0%),均购自中国食品药品检定研究院;BCA 蛋白定量试剂盒(上海索莱宝生物有限公司,批号为20190603);细胞增殖(MTS)试剂盒(普洛麦格生物有限公司,批号为0000383823);澳洲胎牛血清(批号为2279804CP),链-青霉素(批号为15140122),胰酶消化液(批号为C25200056),DMEM 高 糖 培 养 基( 批 号 为C11995500BT),均购自美国Gibco 公司;其余试剂均为分析纯;水为超纯水。
细胞株:结直肠腺癌Caco - 2 细胞株(中科院上海细胞库)。
2 方法与结果
2.1 含量测定
2.1.1 溶液制备
头花蓼提取液:取头花蓼提取物500 mg,精密称定,加入4 950 μL 磷酸盐缓冲液(PBS)和50 μL 的二甲基亚砜(DMSO),制备成质量浓度为100 mg/mL的头花蓼溶液,置-20 ℃贮藏,备用。
左氧氟沙星溶液:取左氧氟沙星对照品90 mg,加入2 970 μL PBS和30 μL DMSO,制备成质量浓度为30 mg/mL(83 017 μmol/ L)的左氧氟沙星溶液,置- 20 ℃贮藏,备用。
对照品溶液和内标溶液:取原儿茶酸、没食子酸、左氧氟沙星对照品各适量,精密称定,置容量瓶中,并用甲醇定容至10 mL,得原儿茶酸(0.831 mg/ mL),没食子酸(1.002 mg/mL),左氧氟沙星(1.002 mg/mL)单一对照品溶液。取葛根素对照品4.95 mg,精密称定,用50%甲醇定容至10 mL,得葛根素(0.495 mg/mL)对照品溶液;取适量,置100 mL容量瓶中,用50%甲醇定容,制备成质量浓度为20 ng/mL 的内标溶液,置-20 ℃贮藏,备用。
空白细胞悬液:取Caco - 2 细胞适量,接种于含10%胎牛血清和1%链-青霉素的高糖DMEM培养液中,在37 ℃、5%CO2培养箱中培养。待细胞生长约80%时,用0.25%胰蛋白酶消化液消化细胞,按1×105mL-1密度接种于6 孔培养板,每孔2 mL,1 周内隔天换液1 次,1 周后每天换液1 次,连续14 d,复制屏障模型细胞[16-21]。取模型细胞,用Hanks缓冲液洗去细胞表面杂质,加入超纯水2 mL,反复冻融裂解细胞,收集细胞悬液,置-20 ℃保存,待用。
样品溶液:取细胞悬液500 μL,加入20 ng/mL内标溶液50 μL,再加入500 μL甲醇沉淀蛋白,涡旋超声(功率500 W,频率40 kHz)处理10 min,12 000 r/ min 离心10 min,取上清液置离心管中,37 ℃下N2吹干;200 μL 50%甲醇水溶液互溶,涡旋超声10 min,12 000 r/ min 离心10 min,取上清液,即得。
2.1.2 试验条件
色谱条件:色谱柱为Waters BEH C18柱(50 mm ×2.1 mm,1.7 μm);保护柱为Waters Van Guard BEH C18柱(5 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液(A)- 0.1%甲酸乙腈(B),梯度洗脱(0~0.3 min 时90% A,0.3~1 min 时90% A→85% A,1~2 min 时85%A→90%A,2~3 min 时90%A,3~4 min 时90%A→10% A);流速为0.30 mL/min;柱温为40 ℃,进样体积为1 μL。
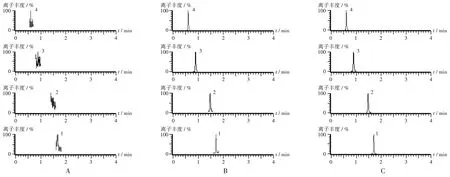
1. 左氧氟沙星 2. 葛根素 3. 原儿茶酸 4. 没食子酸A. 空白细胞悬液 B. 空白细胞悬液+对照品溶液 C. 细胞摄取样品图1 超高效液相色谱质谱串联色谱图1.Levofloxacin 2.Puerarin 3.Protocatechuic acid 4.Gallic acidA.Blank cell suspension B.Blank cell suspension+ reference solution C.Samples solution after cell absorptionFig.1 UPLC-MS/MS chromatograms
质谱条件:电喷雾电离源(ESI),正、负离子模式;毛细管电压为2.0 kV,离子源温度为120 ℃;喷雾气与反吹气为N2,去溶剂气流速为800 L/h,去溶剂气温度为400 ℃,多反应监测(MRM)扫描方式,质谱数据采集及处理软件为MassLynx 4.1 质谱工作站。待测成分及内标的质谱条件见表1。色谱图见图1。

表1 待则成分及内标的质谱条件Tab.1 Mass spectrometry conditions of components to be tested and internal standard
2.1.3 方法学考察
精密量取2.1.1项下各单一对照品溶液适量,分别量取适量空白细胞悬液加入,用甲醇倍比稀释,制成系列混合对照品溶液,按“2.1.1 样品溶液处理”项下方法操作,按2.1.2 项下试验条件进样测定,以待测成分质量浓度(X,ng/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,按相关规定计算定量限[15]。回归方程与线性范围、定量限见表2。并进行精密度、稳定性、提取回收试验。结果3种待测成分日内精密度的RSD为3.53%~11.69%(n=6),日间精密度的RSD为4.22%~13.23%(n=6);样品室温下放置1,2,3 d 时仪器响应值的RSD均小于15%(n=5);提取回收率为87.06%~105.59%。
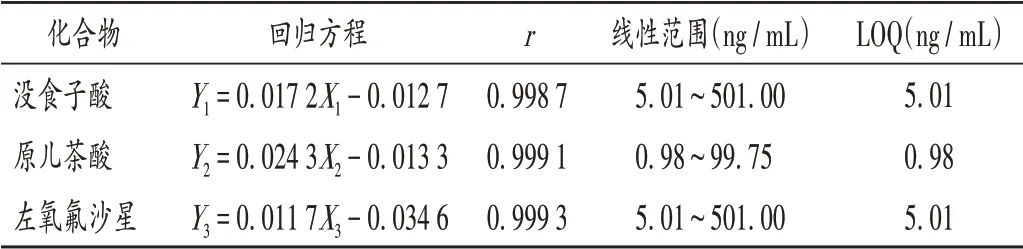
表2 回归方程、线性范围、定量限Tab.2 Regression equations,linear ranges and LOQs
2.2 细胞形态观察
取2.1.1项下空白细胞悬液中模型细胞,显微镜下观察,可见细胞生长均匀,边界清晰,成单层膜状态。详见图2。

A. 培养2 d B. 培养14 d图2 Caco-2细胞一般形态A.Culture for 2 d B.Culture for 14 dFig.2 General morphology of Caco-2 cells
2.3 Caco-2 细胞毒性考察
取生长状态良好的Caco-2细胞适量,以每孔100 μL,1×105mL-1的密度接种于96孔板中,在37 ℃及5%CO2培养箱中孵育24 h。试验分为空白对照组、给药组。空白对照组加入完全培养基溶液(10%胎牛血清+ 1%链-青霉素+ 89%高糖DMEM 培养基);给药组分别加入0.5,1.0,2.0,4.0,5.0,8.0,16.0 mg/ mL 头花蓼提取液和5,10,20,40,80,160,320,640 μmol/mL 左氧氟沙星溶液,每孔100 μL,培养24 h 后,用MTS 法考察头花蓼提取液和左氧氟沙星对Caco-2细胞的安全性。每个浓度平行6 个孔,重复操作3 次。结果见图3。可见,头花蓼提取液质量浓度在0~1 mg/mL时对细胞存活率无显著影响,>1 mg/mL时有一定影响。故选择1 mg/mL作为给药质量浓度;左氧氟沙星质量浓度在0~160 μmol/mL范围时对细胞存活率无明显影响,> 160 μmol/ mL 时有一定影响。故选择160 μmol/mL作为给药质量浓度。
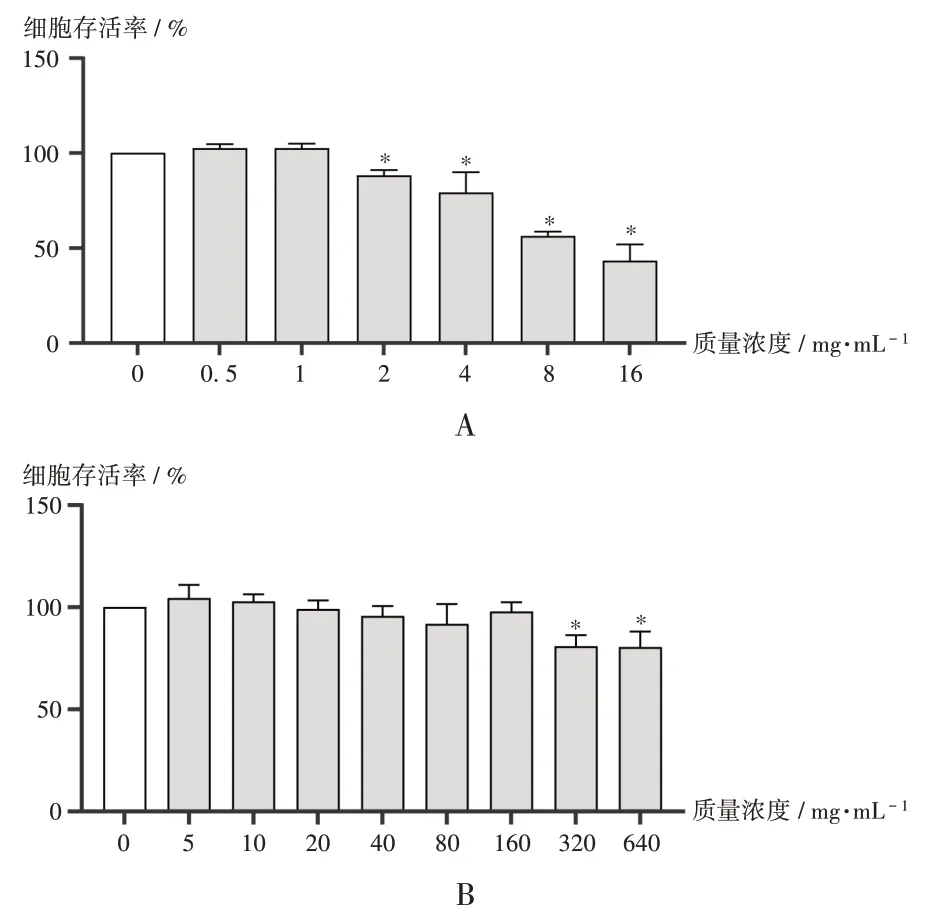
A. 头花蓼提取液 B. 左氧氟沙星图3 药物对Caco-2细胞存活率的影响(± s,n=6)注:与0 mg/mL比较,*P < 0.01。图4同。A.Polygonum capitatum extract solution B.LevofloxacinFig.3 Effect of drugs on survival rate of Caco-2 cells(±s,n=6)Note:Compared with 0 mg/mL,*P < 0.01(for Fig.3-4).
2.4 细胞摄取试验
取2.2项下模型细胞,用Hanks缓冲液(HBSS)洗去表面杂质。实验分为3 组,头花蓼提取物组(A 组)加入1 mg / mL 头花蓼提取液2 mL;左氧氟沙星给药组(B 组)加入160 μmol/ mL 左氧氟沙星溶液2 mL;头花蓼提取液与左氧氟沙星合用组(C 组)加入1 mg/mL 头花蓼提取液和160 μmol/mL 左氧氟沙星溶液共2 mL,在37 ℃、5%CO2培养箱中培养1 h,取出,加入4 ℃超纯水终止试验,并快速用超纯水清洗3遍细胞单分子层,最后每孔加入2 mL超纯水。反复冻融裂解细胞,取出细胞,超声处理10 min,得细胞悬液,按“2.1.2样品处理方法”项处理,进样分析并计算摄取量。另取10 μL的细胞悬液,采用BCA 法测定蛋白含量。摄取量= 药物(mg)/ 蛋白(g)。结果见图4。可见,左氧氟沙星与头花蓼提取液合用后,左氧氟沙星的细胞摄取量为(3.903±0.394)μg / g显著少于单用时的(5.895 ± 0.663)μg / g(P< 0.01);头花蓼提取液指标性成分没食子酸和原儿茶酸合用后的细胞摄取量分别为(0.076±0.015)μg / g和(0.060±0.008)μg / g,少于单用时的(0.094 ± 0.022)μg / g 和(0.074±0.018)μg / g,但无显著差异(P>0.05)。
3 讨论
药物是基于细胞内众多特定靶点而设计的分子实体,必须通过多重生物屏障,与胞内靶点结合,才能发挥效应。传统药物代谢动力学仅以血药浓度表征药物作用浓度,不能完全反映真实的药物效应,故迫切需要将传统、宏观的药物代谢动力学研究拓展到细胞/ 亚细胞水平行进入靶细胞的药物代谢动力学研究。
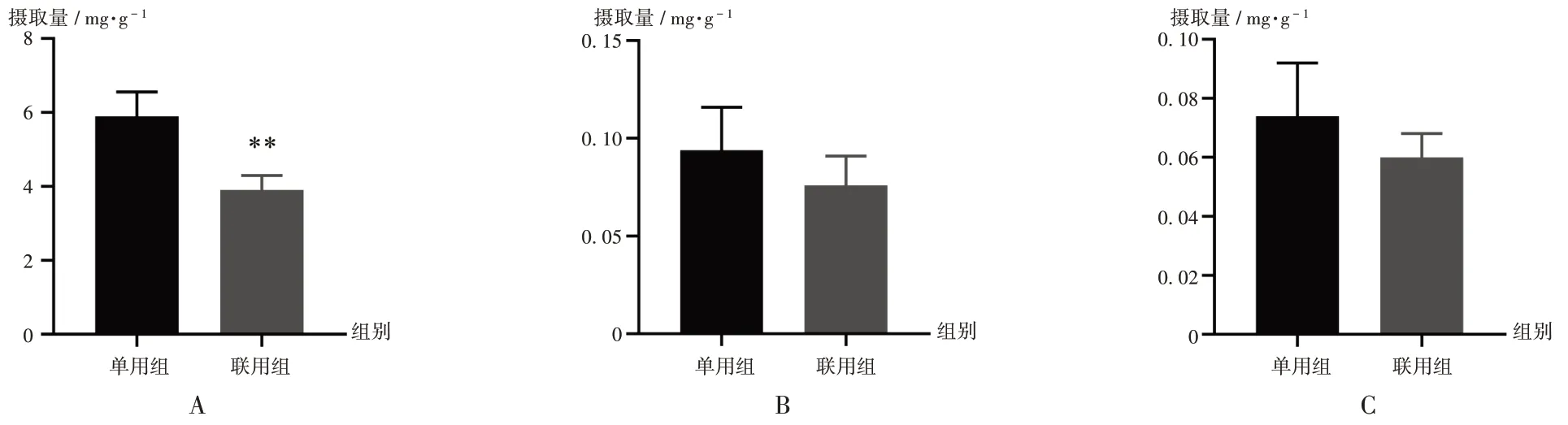
A. 左氧氟沙星 B. 原儿茶酸 C. 没食子酸图4 左氧氟沙星与头花蓼提取液联用前后3种成分的细胞摄取量比较(± s,n=5)A.Levofloxacin B.Protocatechuic acid C.Gallic acidFig.4 Comparison of cell absorption of three compounds before and after levofloxacin combined with Polygonum capitatum extract solution(±s,n=5)
本研究中,头花蓼提取液与左氧氟沙星合用后,左氧氟沙星在Caco-2细胞中的摄取量减少,而头花蓼提取液中指标性成分没食子酸和原儿茶酸在Caco - 2细胞中的摄取未受明显影响。其原因可能为,化学药物常具有明确的作用靶部位/靶点,而中药重在调理机体的功能状态,通过调控靶部位的生理状态,创造更有利于化学药物代谢处置、发挥药效的微环境。左氧氟沙星为P 糖蛋白(P - gp)、多药耐药相关蛋白(MRP)、乳腺癌耐药蛋白(BCRP)等外排蛋白的底物[22-23],头花蓼提取液可能通过调控Caco - 2 细胞的生理状态从而诱导了上述外排蛋白的活性,将左氧氟沙星从细胞中外排,降低了其在细胞内的浓度。中药发挥作用是多组分多靶点产生的协同效果,而化学药具有明确的作用靶点,故左氧氟沙星不能显著影响头花蓼提取液的摄取。两药联用的具体机制有待下一步研究证实。
综上所述,头花蓼提取液能显著降低左氧氟沙星在Caco - 2 细胞中的吸收,而左氧氟沙星对头花蓼提取液的吸收无影响。该研究可为两药的临床使用提供参考。

